метаболическая активность неопластического характера что такое
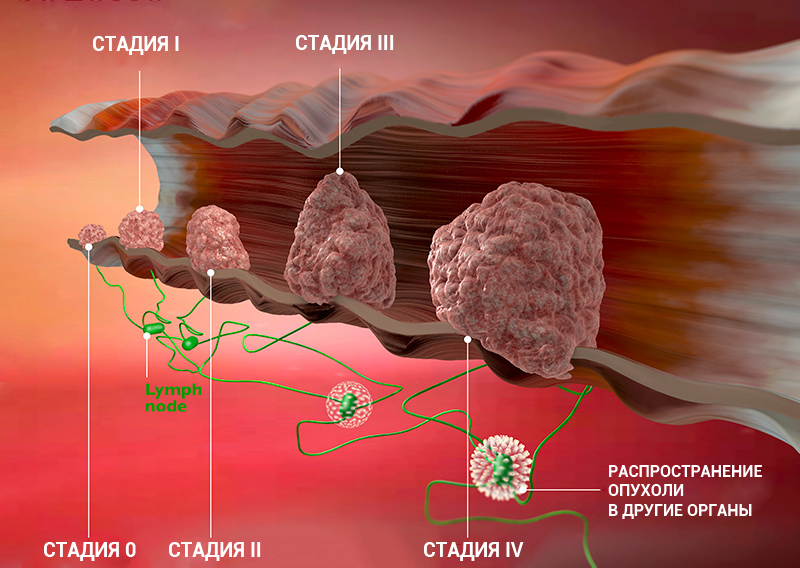
Стадии рака: классификация онкологических заболеваний
Стадия онкологического заболевания дает информацию о том, насколько велика опухоль и распространилась ли она по организму. Это помогает врачам определять прогноз пациента и план лечения.
С помощью врача-онколога, резидента Высшей школы онкологии Сергея Югая разбираемся, как врачи устанавливают стадии рака и что каждая из них означает.
На что влияет стадия онкологического заболевания?
Стадирование нужно, чтобы спрогнозировать, какие у пациента шансы на выздоровление, а также чтобы определить, какой метод лечения будет наиболее эффективен в конкретном случае, — поясняет Сергей Югай.
Все начинается с медицинского осмотра и обследований — УЗИ, КТ, МРТ, ПЭТ-КТ и других методов в зависимости от вида рака. Затем врач берет кусочек опухоли — биопсию или удаляет опухоль целиком во время операции, а после отправляет материал на гистологический анализ, чтобы поставить диагноз.
Стадии рака по TNM-классификации
Стадии онкологического процесса описывают разными способами — это зависит от вида опухоли. Один из самых распространенных способов — стадирование с помощью TNM-классификации.
Т характеризует первичную опухоль, ее размеры и вовлечение окружающих структур в опухолевый рост, например, прорастание в стенку кишки или желудка. N говорит о наличии в лимфоузлах метастазов и количестве пораженных лимфоузлов, а М — о наличии отдаленных метастазов (во внутренних органах, костях, ЦНС или лимфоузлах, которые расположены далеко от первичной опухоли), — объясняет Сергей Югай.
Индекс Т принимает значения от 0 до 4. 0 означает, что первичная опухоль не обнаружена, 1 — опухоль маленькая, а 4 — опухоль проросла в прилегающие ткани. Таким образом, чем больше цифра рядом с Т, тем ситуация сложнее. При некоторых видах рака N принимает значение 0 или 1, при других — 0, 1 или 2, а иногда — 0, 1, 2 и 3. 0 означает, что опухоль не проникла в ближайшие лимфоузлы, а 3 — что поражено множество лимфоузлов. M0 показывает, что метастазов нет, а 1 — что метастазы есть.
Онкологи выставляют стадию по TNM клинически — до операции или когда операция не планируется и патоморфологически — при изучении удаленной во время операции опухоли, — объясняет Сергей.
Клиническая стадия обозначается буквой «c», например, cT2. Патоморфологическая — буквой «p», например, pN1.
От правильной стадии зависит тактика лечения. Например, пациент — мужчина с раком желудка и стадией cT1N0M0. Это значит, что опухоль прорастает в слизистую и подслизистый слой стенки желудка. В этом случае пациенту показана операция. Если же стадия выше (cT2N1M0, например), то есть опухоль пациента прорастает в мышечный слой, и есть метастазы в лимфоузлах, то может понадобиться химиотерапия перед операцией, которая позволит улучшить результаты лечения, — добавляет Сергей.
Стадию рака могут обозначать с помощью цифр — 0, I, II, III, IV. Что это значит?
Клинические стадии (0, I, II, III, IV) тесно связаны с системой TNM. Как правило, одна клиническая стадия включает в себя несколько вариантов стадирования по TNM. Эти варианты характеризуются схожими прогнозом и подходом к лечению. Например, стадии T1N3M0, T2N3M0, T3N2M0 рака легкого объединяются в IIIВ стадию, так как при любой из этих ситуаций пациент будет иметь примерно одинаковый прогноз и тактику лечения. В этом конкретном примере необходима химиолучевая терапия, а не операция, — комментирует Сергей Югай.
Меняется ли стадия после лечения, при прогрессировании заболевания?
Нет, стадия выставляется один раз. Но есть нюансы:
Например, мы хотим посмотреть, как опухоль ответила на лечение, чтобы понять, можно ли делать операцию. После лечения опухоль уменьшилась, и мы добавляем к стадии новые данные. При прогрессировании опухолевого процесса первоначальная стадия также остается прежней, но, к сожалению, прогноз будет менее благоприятный. Например, у человека II стадия рака желудка. Он прооперирован, и прогноз у него хороший. Через 2 года врачи обнаруживают у пациента метастазы в легких. Стадия остается II, но рак у пациента уже метастатический, что очень усложняет положение, — говорит Сергей.
Бывает, что люди сравнивают свою ситуацию с историями других пациентов. Если речь идет о разных онкологических заболеваниях, то такие сравнения некорректны — это заболевания с разными прогнозами и схемами лечения:
Например, с нейроэндокринным раком поджелудочной железы люди могут жить десятилетиями, а при метастатической стадии рака поджелудочной железы — полгода или год, — объясняет врач-онколог.
Что может повлиять на прогноз людей с одинаковой стадией и одним видом рака?
Сергей Югай выделяет три фактора:
Метаболическая активность неопластического характера что такое
Исследование «всего тела» заключается в сканировании пациента от уха до верхней трети бедра. Т.е. в область исследования будут включены голова (частично, от козелка уха, без захвата головного мозга), шея, органы грудной полости, брюшной полости, малого таза и костная система (без верхних и нижних конечностей).
Сканирование нижних конечностей проводится за дополнительную плату.
Вопрос №2. Что такое радиофармпрепарат?
Радиофармпрепарат (РФП) – это соединение, состоящее из специального вещества и радионуклида (изотопа, радионуклидной метки). Специальное вещество отвечает за то, в каком органе накопится РФП, а радионуклидная метка позволяет врачу-диагносту увидеть это накопление на изображении.
В настоящее время для производства РФП используется очень широкий спектр как специальных веществ, так и радионуклидных меток. Во всем мире самым часто используемым у онкологических больных соединением специального вещества и радионуклидной метки является 18 F-фтордезоксиглюкоза ( 18 F-ФДГ). В данном соединении 18 F выполняет функцию радионуклидной метки, ФДГ – специального вещества.
Вопрос №3. Что такое физиологическое накопление РФП?
Физиологическое накопление (гиперфиксация) РФП – это повышенное накопление РФП, определяющееся в различных органах и системах в норме.
Физиологическое накопление наблюдается при исследованиях со всеми РФП: 18 F-ФДГ, 11 С-холином, 11 С-метионином, 68 Ga-ПСМА и т.д. В зависимости от типа РФП меняется лишь местоположение физиологической гиперфиксации. Например, при ПЭТ и ПЭТ/КТ с самой часто используемой 18 F-ФДГ физиологическое накопление РФП определяется в коре головного мозга, ротоглотке, носоглотке, мышцах гортаноглотки, миокарде левого желудочка, чашечно-лоханочных системах почек, фрагментарно по ходу петель толстой кишки, мочевом пузыре.
 |  |
| Физиологическое накопление 18 F-ФДГ в коре головного мозга. | |
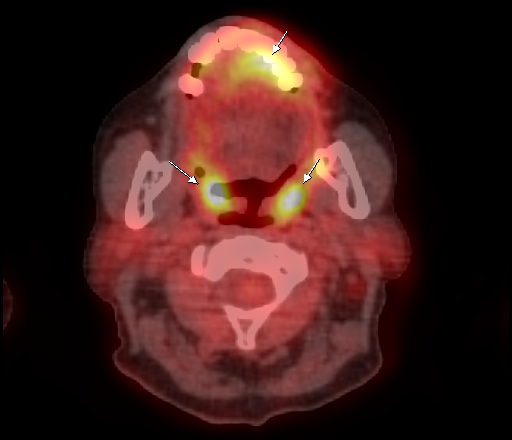 | 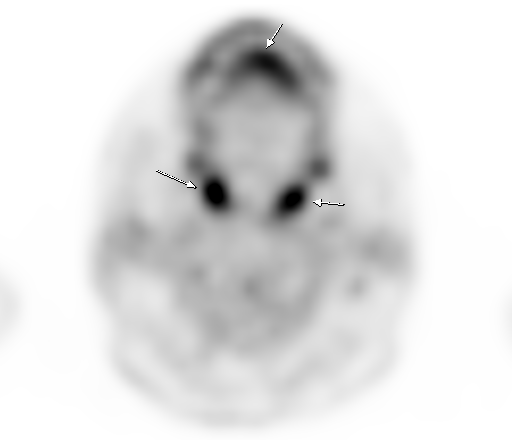 |
| Физиологическое накопление 18 F-ФДГ в ротоглотке. | |
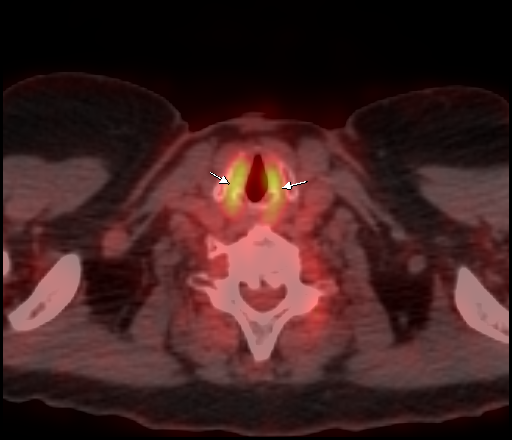 | 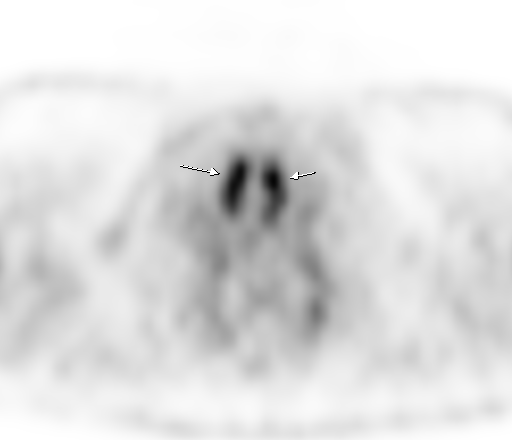 |
| Физиологическое накопление 18 F-ФДГ в мышцах гортаноглотки. | |
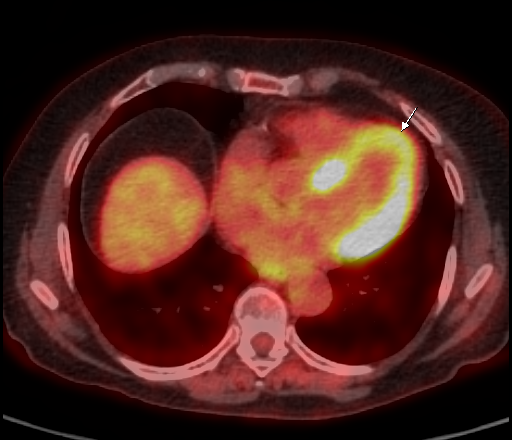 |  |
| Физиологическое накопление 18 F-ФДГ в миокарде левого желудочка. | |
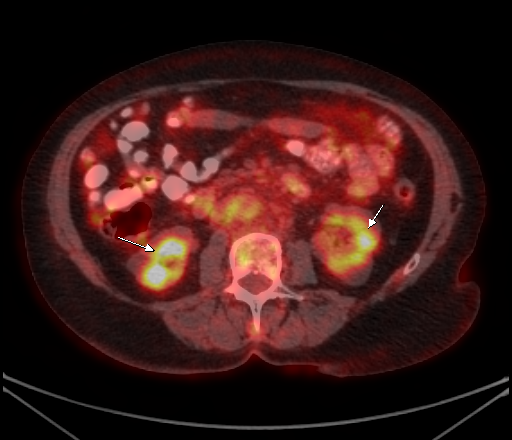 |  |
| Физиологическое накопление 18 F-ФДГ в чашечно-лоханочных системах почек. | |
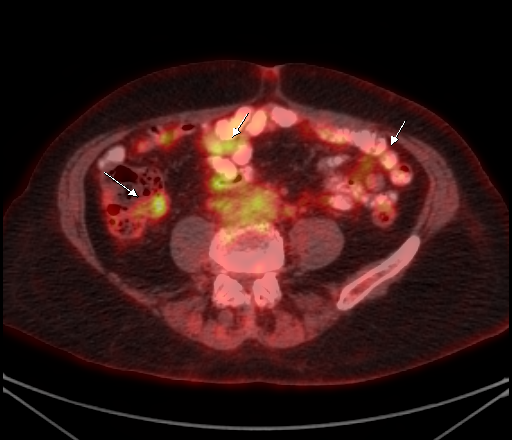 | 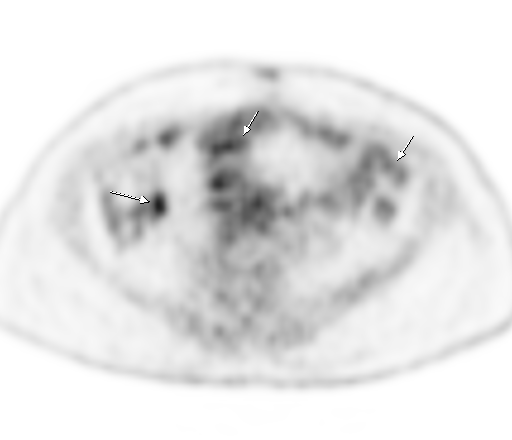 |
| Физиологическое накопление 18 F-ФДГ по ходу петель толстой кишки. | |
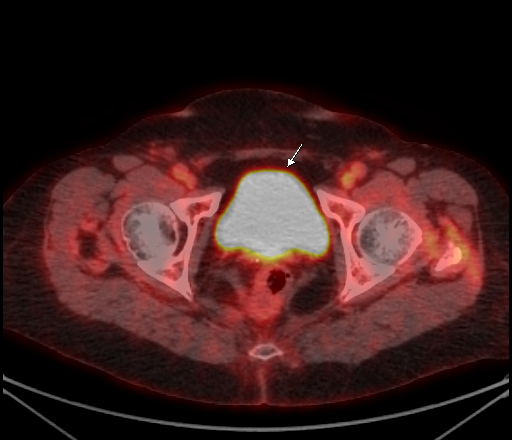 | 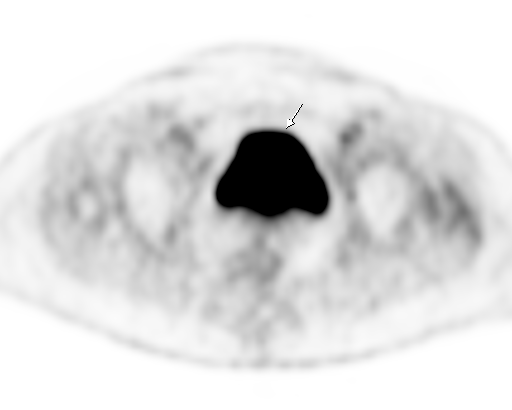 |
| Физиологическое накопление 18 F-ФДГ в мочевом пузыре. | |
Вопрос №4. Что такое патологическое накопление РФП?
Патологическое накопление РФП – это повышенное накопление РФП в органах и тканях, регистрирующееся при заболеваниях, чаще всего в злокачественных опухолях.
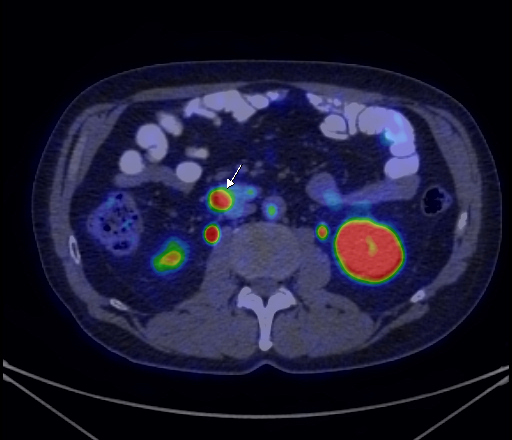 |
| Данные ПЭТ/КТ с 68 Ga-DOTA-TATE у пациента с нейроэндокринной опухолью тощей кишки. В проекции злокачественной опухоли, расположенной в тощей кишке, определяется очаг патологической гиперфиксации РФП. |
 |  | 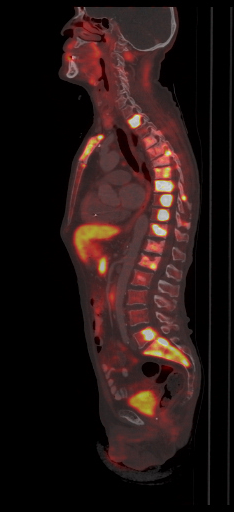 |
| Данные ПЭТ/КТ с 11 С-холином у пациента с раком предстательной железы. Состояние после простатэктомии. В костях скелета визуализируются множественные очаги патологического накопления РФП (метастазы). | ||
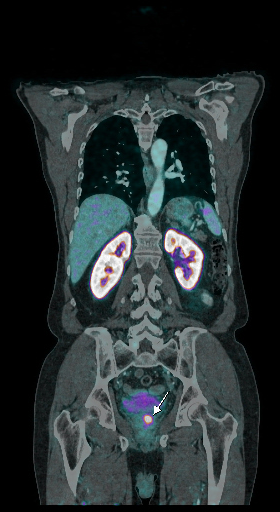 | 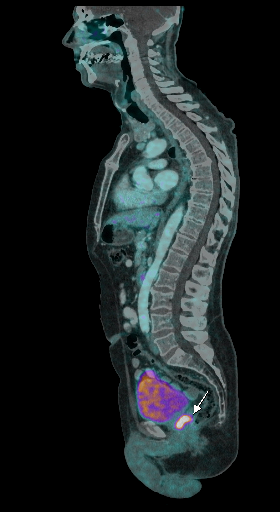 | 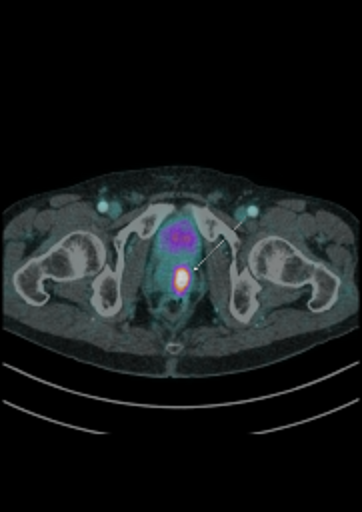 |
| Данные ПЭТ/КТ с 68 Ga-ПСМА у пациента с местным рецидивом рака предстательной железы. Состояние после лучевой терапии. В левых отделах предстательной железы определяется очаг патологического накопления РФП. | ||
Вопрос №5. Что такое метаболически активное и метаболически неактивное образование?
Метаболически неактивное образование – это образование, которое не накопило РФП. Чаще всего отсутствие повышенного накопления РФП в опухоли свидетельствует о ее доброкачественной природе.
Метаболически активное образование – это образование, в котором накопился РФП в повышенном количестве. Повышенное накопление РФП в опухоли чаще всего свидетельствует о ее злокачественном характере.
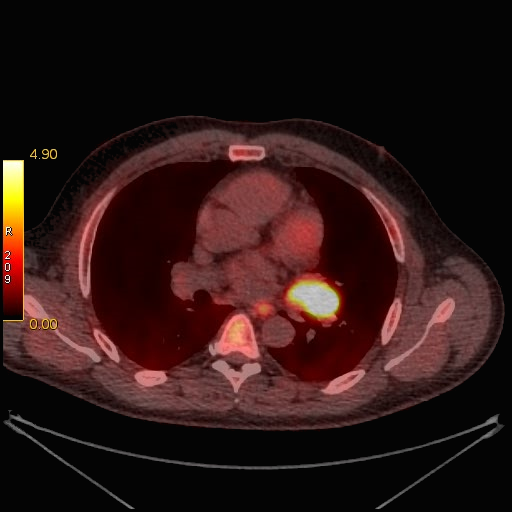 |
| Данные ПЭТ/КТ с 11 С-метионином у больного с метаболически активным образованием корня левого легкого (типичный карциноид). |
Вопрос №6. Что такое SUV?
SUV (Standardized Uptake Value, стандартизированный уровень захвата) – это величина, отражающая интенсивность накопления РФП в зоне интереса, например, в опухоли.
Показатель SUV рассчитывается программным комплексом автоматически и измеряется в различных единицах. В нашем Центре, как и в большинстве отечественных и зарубежных медицинских учреждений, где проводится позитронная эмиссионная томография, в качестве единиц измерения показателя SUV принято использовать г/мл (g/ml).
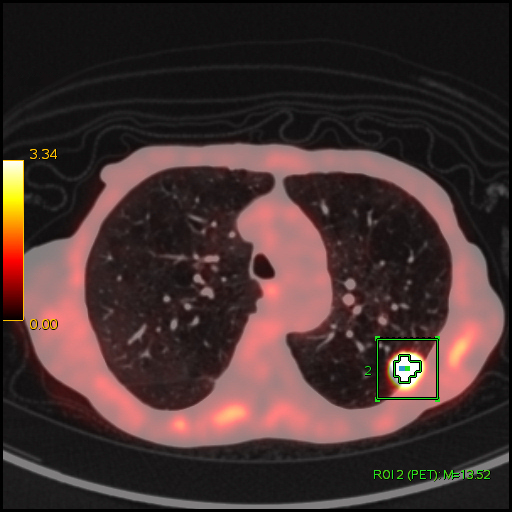 |
| Данные ПЭТ/КТ с 18 F-ФДГ. Оконтуривание метаболически активной злокачественной опухоли левого легкого для измерения показателя SUV. В данном случае величина SUV в опухоли определяется на уровне 13,52 g/ml. |
Вопрос №7. Для чего используется величина SUV?
Величина SUV в основном используется для оценки ответа злокачественной опухоли на проведенное лечение. Важно подчеркнуть, что в ряде клинических ситуаций показатель SUV в опухоли является единственным критерием, позволяющим оперативно получить информацию о чувствительности образования к только что начатой терапии.
Если опухоль чувствительна к лечению, то уровень SUV в ней при повторном ПЭТ-исследовании будет снижаться, если нечувствительна или малочувствительна (резистентна, устойчива) – значение SUV останется без изменений или увеличится. Следует помнить, что своевременная диагностика устойчивости опухоли к лечению позволит скорректировать план лечения, а в некоторых случаях и радикально его изменить.
Как уже было сказано выше, для оценки эффективности терапии врач-радиолог оценивает динамику показателя SUV до и после лечения.
Существует четыре варианта метаболического ответа опухоли на проведенное лечение:
Результаты ПЭТ с 18 F-ФДГ у пациента с диффузной В-клеточной крупноклеточной лимфомой до лечения (а), после 2 курса ПХТ (б) и через 13 месяцев после окончания терапии (в).
а – до лечения в средостении визуализируется массивное метаболически активное образование с уровнем SUV=12,6;
б – после 4 курса ПХТ отмечается значительное уменьшение метаболического объема опухоли и снижение показателя SUV до 3,4 (достигнут частичный метаболический ответ, т.е. опухоль чувствительна к выбранной ПХТ);
в – через 13 месяцев после окончания ПХТ очагов патологической гиперфиксации РФП в проекции органов средостения не обнаружено (достигнут полный метаболический ответ).
Метаболическая активность неопластического характера что такое
Актуальность проблемы. В настоящее время большинство онкобольных нуждаются в комбинированном лечении [4,6]. Наблюдаемые у ряда больных неудачи побудили в последнее время шире прибегать к выбору тактики лечения в зависимости от оценки распространенности процесса [3]. Происходит постоянная оптимизация методов для оценки распространения заболевания у пациентов с опухолями пищевода и желудка. Компьютерная томография (КT) представляет стандарт в определении инвазии опухоли. КТ является неинвазивным и наименее дорогостоящим из доступных методов, но имеет серьезные ограничения в плане точной постановки диагноза [5]. Позитронно-эмиссионная томография (ПЭТ) также является неинвазивным, но предоставляет качественно иную информацию по сравнению с КТ, благодаря своей функции участия в метаболическом процессе опухоли, а не только определяя размер опухоли [1]. Многие исследователи показали, что снижение метаболической активности, измеренной значением стандартизированного накопления (SUV) на ПЭТ/КТ, в результате терапии является прогностически значимым критерием [7,9,10]. Следует отметить, что ПЭТ/КТ изображения были изучены у ограниченного количества больных и, согласно другим исследованиям, прогностическая ценность является сомнительной [8,11]. Тем не менее данные ПЭТ/КТ при злокачественных опухолях верхних отделов желудочно-кишечного тракта не были подтверждены [2] и требуют дальнейшего изучения.
Цель работы: выявить зависимость коэффициента максимального поглощения радиофармпрепарата18F-ФДГ от следующих характеристик опухолевого процесса – глубины инвазии опухолевого процесса, гистологической структуры опухоли и степени дифференцировки злокачественной опухоли.
Материалы и методы исследования. В исследование были включены 56 больных с установленным диагнозом или подозрением на злокачественную опухоль верхних отделов желудочно-кишечного тракта, в возрасте от 29 до 89 лет, проходивших обследование на базе отделения радиоизотопной диагностики АО «Республиканского диагностического центра» г. Астана в период с 2010 по 2012 г. Основными критериями включения в исследование явились: наличие или подозрение на злокачественную опухоль желудка или пищевода; проведение позитронно-эмиссионной томографии, совмещенной с компьютерной томографией. Локализация патологического процесса в пищеводе отмечена у 16 больных (28,5%), локализация в желудке – у 40 больных (71,5%). Всем больным проведено ПЭТ/КТ исследование на базе Республиканского Диагностического Центра г. Астана. Позитронно-эмиссионный томограф, совмещенный с 16-срезовым компьютерным томографом GeminiGXL 16 фирмы Philips производства 2008 года. Для проведения ПЭТ/КТ исследования на базе РДЦ создан производственный комплекс, включающий циклотрон «Cyclone 18/9» для производства короткоживущих изотопов, радиохимическая лаборатория для производства радиофармпрепаратов. При проведении ПЭТ/КТ использовался радиофармацевтический препарат «Фтордезоксиглюкоза, 18F, раствор для внутривенного введения». Вводимая доза препарата зависела от площади поверхности тела исследуемого человека. Поверхность тела рассчитывалась по номограмме, исходя из веса и роста больного. Диагностическая доза препарата составляла 220 МБк на 1 м2 поверхности тела пациента; как правило, использовали 300–550 МБк на одно исследование. Препарат вводился внутривенно медленно в объеме 5,0–10,0 мл.
Результаты и их обсуждение. Нами проведен анализ показателя SUVmax в первичной опухоли и определена зависимость коэффициента SUVmax в зависимости от основных характеристик онкологического процесса, таких как глубина инвазии опухолевого процесса, гистологическая структура и дифференцировка опухоли.
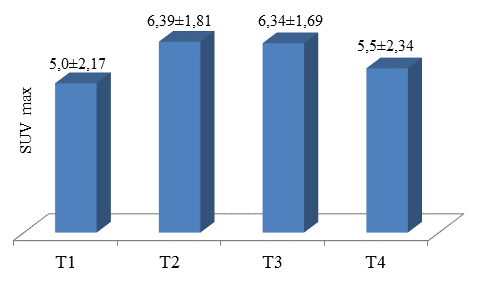
Накопление фармпрепарата в первичной опухоли у больных со злокачественными новообразованиями верхних отделов желудочно-кишечного тракта варьировало от 2,1 до 13, в среднем составило 6,25±2,26.
Зависимость максимального накопления радиоизотопа глюкозы от глубины инвазии опухолевого процесса в стенку органа представлена на рисунке 1.
Рисунок 1. Коэффициент SUVmax в зависимости от глубины инвазии опухолевого процесса
Как видно из представленной диаграммы, максимальное накопление радиофармпрепарата не зависело от глубины инвазии стенки органа опухолевым процессом. Наибольшие показатели накопления радиофармпрепарата в первичной опухоли отмечены при прорастании мышечного (Т2, n=27) и серозного (Т3, n=21) слоев. Наиболее низкие показатели отмечены при поражении только слизистого слоя (Т1, n=3) и при прорастании в соседние органы (Т4, n=5). Полученные данные не имели статистически значимых различий (p=0,41).
Проведен анализ содержания радиофармпрепарата ФДГ 18F в зависимости от протяженности поражения органа. Полученные данные представлены в таблице 1.
Таблица 1. Коэффициент SUVmax в зависимости от протяженности поражения органа
ДИАГНОСТИЧЕСКАЯ ЭФФЕКТИВНОСТЬ В ОНКОЛОГИИ ПОЗИТРОННОЙ ЭМИССИОННОЙ ТОМОГРАФИИ С 18F-ФТОРДЕОКСИГЛЮКОЗОЙ
Резюме. Рассмотрены вопросы эффективности применения позитронной эмиссионной томографии (ПЭТ) с 18F-фтордеоксиглюкозой в диагностике, мониторинге, оценке результатов лечения различных злокачественных новообразований. Показано, что адекватное применение ПЭТ в диагностических алгоритмах позволяет повысить точность комплексной диагностики, оптимизировать тактику обследования и лечения больных и является экономически оправданным.
Одним из главных, интенсивно развивающихся направлений ядерной медицины в настоящее время является позитронная эмиссионная компьютерная томография (ПЭТ) — метод диагностики, основанный на регистрации распределения в организме позитронизлучающих радионуклидов, которыми могут быть маркированы практически все биологически активные вещества. ПЭТ позволяет не только определять анатомо-функциональное состояние органов и физиологических систем, но и дает уникальную возможность оценивать метаболизм тканей, кинетику различных химических соединений в организме на молекулярном уровне.
Для ПЭТ в клинических и экспериментальных целях применяется достаточно широкий набор радионуклидов — 18 F, 11 C, 13 N, 15 O, 12 4I, 68 Ga, 82 Rb, 76 Br. Носите-
лями позитронных излучателей могут быть аминокислоты, углеводы, нуклеиновые кислоты, гормоны и их производные, лекарственные препараты и так далее.
По способу производства позитронизлучающие радионуклиды разделяются на две группы: 1-я — циклотронные ( 18 F, 11 C, 13 N, 15 O, 124 I), производимые на медицинских циклотронах; 2-я — генераторные ( 68 Ga, 82 Rb), получаемые из специальных генераторов непосредственно в радионуклидных лабораториях.
Более 90% всех ПЭТ проводится с 18 F-фтор-2- деокси-D-глюкозой ( 18 F-ФДГ), что обусловлено достаточно большим периодом полураспада фтора-18 (110 мин) и возможностью оценки углеводного обмена как показателя уровня метаболических процессов в нормальных и патологических тканях. Наиболее широкое применение ПЭТ с 18 F-ФДГ нашла в кардиологии, неврологии, нейрохирургии и в онкологии, где проводится около 80% всех исследований.
Клетки злокачественных опухолей характеризуются высоким уровнем метаболизма глюкозы, обусловленного усиленной активностью гликолитических ферментов (гексокиназы, фосфофруктокиназы и пируватдегидрогеназы), а также увеличенным мембранным трансфером глюкозы, вызванного повышенным количеством транспортных молекул. Активация генов, ко-
дирующих синтез глюкозных транспортеров, является одним из признаков злокачественной трансформации. 2-деокси-D-глюкоза (ДГ) является аналогом глюкозы, который при поступлении из плазмы в клетку фосфорилируется гексокиназой и задерживается интрацеллюлярно в виде ДГ-6-фосфата, поскольку ни один из ферментов гликолитического обмена не воспринимает его как субстрат. Наряду с этим, ДГ-6-фосфат обладает медленным клиренсом из клетки, обусловленным слабой мембранной проницаемостью, а в связи с очень низкой концентрацией глюкоза-6-фосфатазы в клетках распад ДГ-6-фосфата минимальный. Благодаря этим механизмам в злокачественных опухолевых клетках создается аккумуляция ДГ, являющаяся общим принципом, на котором основано применение 18 F-ФДГ в онкологии [1].
Приблизительно через 40 мин после внутривенного
введения активность большинства тканей определяется преимущественно 18 F-ФДГ-6-фосфатом, поэтому получаемые изображения распределения фтора-18 в это время отражают относительные уровни гликолиза. Таким образом, ПЭТ с 18 F-ФДГ может быть использована как метод оценки уровня гликолиза в опухолях для дифференцировки злокачественных и доброкачественных процессов, контроля гликолитических уровней во время лечения. Показано существование зависимости между повышением уровня гликолиза и скоростью роста опухоли, ее агрессивностью [2].
Со времени появления первых коммерческих позитронных эмиссионных томографов в начале 1990-х годов сменилось три поколения аппаратов. Приборы третьего поколения имеют кольцевую схему компоновки детекторов, что позволяет существенно повысить чувствительность, пространственное разрешение, статистическую достоверность информации, уменьшить время регистрации данных. Эффективность диагностического применения двухдетекторных позитронных эмиссионных томографов (аппараты первого поколения) сопоставима с эффективностью специализированных ПЭТ-сканеров при размерах опухолей более 15 мм, тогда как при меньших размерах чувствитель-
ность составляла около 80% от чувствительности аппаратов третьего поколения [3].
Создание гибридных ПЭТ-/КТ-систем, обеспечивающих регистрацию и наложение соответствующих КТи ПЭТ-срезов, дало возможность одновременно получать структурную и функциональную информацию о протяженных участках тела, что позволяет качественно улучшить диагностический процесс [4].
В онкологии ПЭТ применяется в таких целях:
для ранней диагностики первичных опухолей; определения распространенности процесса, стадирования; определения степени злокачественности; оценки эффективности лечения; диагностики рецидивов и метастазирования после лечения; прогностической оценки.
ПЭТ может выполняться в трех режимах: 1-й (статический) — получение планарных и томографических изображений в оптимальных для регистрации интервалах времени; 2-й (динамический) — исследование кинетики радиофармпрепарата (РФП) на протяжении определенных промежутков времени; 3-й — сканирование всего тела (СВТ).
Кроме того, часто применяется сочетание нескольких режимов. СВТ и статические исследования обычно проводятся через час после внутривенного введения 100–400 МБк 18 F-ФДГ. Методики выполняются натощак через 6–8 ч после еды.
В онкологической практике диагностическая эффективность ПЭТ с 18 F-ФДГ зависит от локализации опухоли, ее размеров, патогистологических и биохимических особенностей, а также от целей проведения исследования.
В онкологии головы и шеи показана высокая эффективность применения ПЭТ с 18 F-ФДГ для диагностики первичного плоскоклеточного рака верхних отделов дыхательных путей и пищеварительного тракта [5–7]. ПЭТ обладает высокой точностью в выявлении рецидивов опухолей как у больных с клиническими проявлениями [8, 9], так и у тех пациентов, у которых рак не диагностировался другими методами [10]. При сопоставлении с обычными диагностическими методами (ультразвуковым исследованием (УЗИ), рентгенографией, компьютерной томографией (КТ), магнитнорезонансной томографией (МРТ)) ПЭТ с 18 F-ФДГ дает дополнительную и клинически значимую информацию при ранней диагностике первичного и метастатического рака головы и шеи, выявлении рецидивов после лучевой терапии и химиотерапии. В исследовании E. Krestnik et al. [11] чувствительность ПЭТ при первичной диагностике опухолей головы и шеи составила 73,3%, данные ПЭТ позволили уточнить стадию процесса в 20,8% наблюдений. Ложнонегативные (6,6%) и ложнопозитивные (20,0%) результаты при диагностике рецидивов после химиои лучевой терапии были обусловлены воспалительными процессами в тканях. Авторы считают, что при диагностике рака головы и шеи ПЭТ должна применяться до КТ или МРТ.
G.W. Goerres et al. [12] рекомендуют использовать ПЭТ с ФДГ у всех больных раком головы и шеи как для стадирования, так и для исключения рецидивов. Струк-
турные изображения менее эффективны, чем ПЭТ, для диагностики местных рецидивов и поражения лимфоузлов. ПЭТ может быть рекомендована для стадирования в этой клинической группе, поскольку накопление ФДГ в лимфоузлах с высокой вероятностью (до 81%) соответствует злокачественному процессу.
При опухолях головы и шеи у больных с метастазами в шейные лимфатические узлы и неустановленной локализацией первичного очага чувствительность и специфичность ПЭТ составили соответственно 100 и 94%, в то время как при обычных методах диагностики (КТ и/или МРТ, панэндоскопия) эти показатели были 92 и 76%. В 20% наблюдений данные ПЭТ существенно повлияли на выбор лечения. Таким образом, ПЭТ должна быть первым диагностическим методом у больных с метастазами в шейные лимфоузлы неизвестной опухоли в тех случаях, когда данные тонкоигольной аспирационной биопсии указывают на злокачественный процесс, а первичный очаг не выявлен. В свою очередь она может служить руководством для биопсии и других диагностических методов [13].
Применение ПЭТ с 18 F-ФДГ для послеоперационного мониторинга больных дифференцированным раком щитовидной железы показало чувствительность при выявлении метастазов в пределах 50–75%. В группе больных с повышенными уровнями тиреоглобулина (ТГ) и отрицательными данными СВТ с йодом-131 чувствительность составляла 82–85%. [14–16]. ПЭТ позволяла диагностировать дополнительные регионарные метастазы, в том числе менее 1 см в диаметре; в то же время не зафиксировано накопления ФДГ в легочных метастазах менее 1 см, хотя они обладали способностью накапливать йод-131. Высокая диагностическая эффективность при мелких легочных метастазах обеспечивается спиральной КТ. Таким образом, ПЭТ с 18 F-ФДГ не способна заменить СВТ с йодом-131 при мониторинге дифференцированного рака щитовидной железы, однако, может эффективно применяться для диагностики метастатических поражений при повышенных уровнях ТГ и негативных сканах с радиойодом. ПЭТ может проводиться на фоне супрессивной гормонотерапии тироксином, в этих случаях чувствительность исследования выше, чем при высоких уровнях тиреотропного гормона. Этот метод может обеспечить дополнительную диагностическую информацию, уточняющую хирургическую тактику при регионарных метастазах.
В диагностике рака молочной железы (РМЖ) наиболее важным практическим направлением применения ПЭТ с 18 F-ФДГ является оценка распространенности процесса, которая по своей эффективности превышает другие методы. При диагностике первичного очага РМЖ чувствительность и специфичность ПЭТ составляли 93 и 75%, в выявлении мультифокальных поражений чувствительность метода была вдвое выше, чем при сочетанном применении УЗИ и маммографии. ПЭТ является наиболее точным неинвазивным методом диагностики метастатического поражения аксиллярных лимфатических узлов (чувстительность — 79%,
специфичность — 92%). ПЭТ нецелесообразно использовать для скрининга или первичного стадирования, но она может быть ценным дополнением к стандартному обследованию для лимфатического картрирования и диагностики отдаленных метастазов [17, 18]. При диагностике первичного очага РМЖ ПЭТ не превосходит маммосцинтиграфию с 99m Tc-тетрафосмином [19]. ПЭТ с 18 F-ФДГ является высокоэффективным методом оценки результатов химиотерапии РМЖ и обладает достоверной прогностической значимостью в отношении состояния опухоли после лечения [20, 21].
Необходимо также отметить, что ПЭТ обладает высокой чувствительностью и специфичностью в диагностике рака легкого и является важным дополнением к рентгенографии и КТ грудной полости, особенно при плохой демаркации поражения, необходимости дифференцировки между злокачественным и доброкачественным процессами [22]. Показана потенциальная экономическая эффективность применения ПЭТ в алгоритмах дифференциальной диагностики солитарных легочных очагов [23].
Рядом исследований установлено значительное преимущество ПЭТ с 18 F-ФДГ по сравнению с контрастной КТ в диагностике метастазов немелкоклеточного рака легкого (НМРЛ) в лимфоузлы средостения [24– 27]. Использование ПЭТ привело к изменению стадии болезни у 27–62% больных НМРЛ и пересмотру тактики лечения у 25–52% пациентов [28–30]. Стадия заболевания, определенная по данным ПЭТ, является существенным прогностическим фактором выживаемости больных НМРЛ. Кроме того, применение ПЭТ позволяет уменьшить количество инвазивных процедур, необходимых для стадирования [31]. Исследованием М. Dietlien et al. [32] установлено, что использование позитронных эмиссионных томографов третьего поколения в режиме сканирования всего тела при дооперационном стадировании у больных НМРЛ является экономически эффективным. У больных с мелкоклеточным раком легкого (МРЛ) также показана высокая эффективность ПЭТ с 18 F-ФДГ при стадировании и мониторинге, установлена ее бóльшая чувствительность по сравнению с обычными методами в диагностике метастатических поражений лимфатических узлов средостения и корня легкого, костных метастазов. ПЭТ позволяет упростить процедуру стадирования [33].
При проведении лучевой терапии рака легкого ПЭТ может применяться в двух направлениях: для получения дополнительной информации об облучаемом объеме и для ранней оценки эффективности лечения [34, 35].
У больных раком пищевода применение ПЭТ с 18 F-ФДГ наиболее эффективно для стадирования. В диагностике нерегионарных и отдаленных метастазов чувствительность исследования составляет 45–70%, что превышает показатели КТ [36–38]. У 17% больных ПЭТ позволила уточнить стадию процесса и избежать неоправданных хирургических вмешательств [39].
Кроме того, ПЭТ с 18 F-ФДГ может быть методом
«метаболической биопсии» при патологических процессах в грудной полости в тех ситуациях, когда биоп-
сия нерезультативна или проведение ее опасно. В случаях злокачественного поражения при визуальном анализе предикативные значения положительного и отрицательного результатов составляли 90 и 100%, при количественном анализе — соответственно 90 и 85%. Таким образом, негативные данные виртуально исключают злокачественные новообразования, а положительные — с высокой вероятностью указывают на них и требуют дальнейшего обследования [40].
В диагностике рака желудка показана высокая эффективность ПЭТ прежде всего при аденокарциномах гастроэзофагеального соединения [41–43]. При этих формах рака точность метода в диагностике органных метастазов и поражений отдаленных лимфатических узлов была выше, чем при КТ. Подтверждена возможность применения ПЭТ для оценки эффективности химиотерапии [44, 45].
Чувствительность ПЭТ при распространенном раке желудка составляла 60%; при этом в случае локализации процесса в проксимальном отделе она была 74%, при локализации в дистальном отделе — 41%. Ограниченные возможности диагностики связаны с диффузным ростом опухоли, муцинозными типами и перстневидноклеточной формой рака желудка [46]. Аналогичные результаты были получены при использовании ПЭТ с 18 F-ФДГ для диагностики рецидивов рака желудка: чувствительность и специфичность составляли соответственно 70 и 69%, предикативные значения положительного и отрицательного результатов — 78 и 60%. В группе больных с перстневидноклеточным раком чувствительность и специфичность ПЭТ были 62 и 60%. Ввиду низкой чувствительности и отрицательного предикативного показателя ПЭТ нецелесообразно использовать для скрининговых целей после проведенного лечения, однако этот метод может дать важную дополнительную информацию относительно прогноза заболевания [47].
Применение ПЭТ с 18 F-ФДГ в дооперационном стадировании у больных с колоректальным раком позволило диагностировать нераспознанный процесс в 19,2% наблюдений, изменить стадию в 13,46%, модифицировать объем операции в 11,54%, изменить терапевтический подход у больных раком прямой кишки в 17,85% случаев [48]. СВТ с 18 F-ФДГ обладает высокой эффективностью в диагностике рецидивов колоректального рака независимо от локализации поражения [49–52]. По данным Lonneux M. et al. [53], чувствительность и специфичность метода при рецидивах колоректального рака составляла соответственно 97 и 72%, в то время как у обычных методов диагностики — 41 и 36%. Использование ПЭТ в 53% случаев привело к снижению числа неоправданных лапаротомий, осуществленных в результате неточного предоперационного стадирования. ПЭТ оказалась более точным методом по сравнению с обычными методами визуализации в оценке резектабельности рецидивов — 82 против 68%.
Поскольку ФДГ-6-фосфат дефосфорилируется гепатоцитной глюкозо-6-фосфатазой и в нормальной ткани печени создаются пониженные уровни радио-
активности, опухолевые узлы в печени должны отчетливо визуализироваться в виде очагов гиперфиксации РФП. Однако это отмечается только при холангиокарциномах и метастазах внепеченочных опухолей [54, 55], высокодифференцированные гепатоцеллюлярные карциномы часто трудно диагностируются, так как метаболизм ФДГ в них и нормальной ткани печени очень сходен [56]. Чувствительность ПЭТ при диагностике гепатоцеллюлярных карцином составляла только 55– 69% [56–58]. Метаболическая активность опухолевой ткани может быть идентифицирована с помощью динамической ПЭТ и вычисления метаболического клиренса ФДГ [59].
При начальном стадировании больных раком внепеченочных желчных протоков ПЭТ с 18 F-ФДГ может обеспечить дополнительной информацией как относительно первичной опухоли, так и регионарных метастазов. По данным Т. Kato et al. [60], чувствительность КТ в диагностике первичного рака желчных протоков составляла 80%, ПЭТ — 60%; в половине наблюдений с неинформативными результатами КТ ПЭТ установлен правильный диагноз. При регионарных метастазах чувствительность, специфичность и точность КТ были 54, 59 и 57%, тогда как ПЭТ — 38, 100 и 73% соответственно.
ПЭТ может быть успешно применена в комплексной диагностике рака поджелудочной железы и, в первую очередь, для выявления регионарных и отдаленных метастазов и для оценки эффективности лечения [61]. По данным ряда исследований, чувствительность ПЭТ в диагностике рака поджелудочной железы достигала 85–95%, специфичность — 78–90% [62–65]. Основная проблема при использовании обычных методов визуализации — трудность дифференцировки между очаговыми или диффузными панкреатитами и раком. ПЭТ не способна заменить методы структурной визуализации в оценке распространенности опухоли и ее резектабельности, но может быть эффективна при неопределенных и отрицательных результатах КТ. Анализ кинетики ФДГ в очаговых поражениях поджелудочной железы при динамической ПЭТ позволяет значительно улучшить точность диагностики [66].
Метод ПЭТ с 18 F-ФДГ оказался неэффективным в диагностике опухолей почек. Рядом исследований показана чувствительность метода, варьирующая от 40 до 94% [67–69]. При характеристике первичной опухоли ПЭТ не обладает какими-либо преимуществами перед КТ. Низкая чувствительность ПЭТ обусловлена прежде всего тем, что нормальная ренальная экскреция 18 F-ФДГ может снижать контраст между опухолевой и нормальной тканью, уменьшая эффективность диагностики. Наряду с этим, очевидно, влияют определенные гистологические и биохимические факторы, например, некоторые большие опухоли с экстраренальным распространением слабо накапливали 18 F-ФДГ или не визуализировались. Протоколы ПЭТ с отсроченным получением изображений могут улучшить точность диагностики в тех случаях, когда данные КТ сомнительны или исследование не может быть осуществлено в связи
с йодной аллергией или почечной недостаточностью. ПЭТ с 18 F-ФДГ оказалась более точной по сравнению с КТ в диагностике отдаленных метастазов (94 против 89%), исследование показано у больных с солитарными метастазами или при неинформативных данных КТ. Показаниями к ПЭТ могут быть также неблагоприятные патогистологические данные после нефрэктомии, такие как высокая гистологическая степень по Fuhrman или распространенная локальная стадия [70].
При раке предстательной железы высокая диагностическая эффективность ПЭТ с 18 F-ФДГ подтверждена только в отношении отдаленных метастазов [71, 72]. Невысокая точность диагностики местнораспространенного рака простаты обусловлена двумя факторами: экскрецией мочи и специфическими метаболическими характеристиками опухоли. Клетки первичного рака простаты показали низкую экспрессию glut-1 транспортеров, которая способствует слабому накоплению 18 F-ФДГ в опухоли [73, 74].
ПЭТ с 18 F-ФДГ оказалась достаточно эффективной в диагностике семиномных и несеминомных опухолей яичка, за исключением дифференцированной тератомы. Наиболее целесообразно применение ПЭТ для оценки эффективности лечения и раннего выявления рецидивов герминогенных опухолей; проведение исследования более чем через 2 нед после окончания химиотерапии обеспечивает точность в оценке терапевтического эффекта 86% (чувствительность — 78%,
специфичность — 90%) [75, 76].
В онкогинекологии показана достаточно высокая эффективность ПЭТ с 18 F-ФДГ при дифференцировке злокачественных и доброкачественных новообразований в тазу: чувствительность — 83%, специфичность — 78%. В группе больных с подозрением на поражение яичников чувствительность и специфичность составляли соответственно 93 и 80%, негативный и позитивный предикативные показатели — 92 и 82%. Ложноотрицательные результаты получены при серозных опухолях пограничных степеней, сквамозноклеточной цервикальной карциноме и мезотелиоме, ложноположительные — при доброкачественной серозной цистаденоме, эндометриозе, эндометриоме [77]. ПЭТ может быть точным и эффективным средством диагностики рецидивов рака яичника в тех наблюдениях, когда обычные методы неинформативны, особенно у больных с повышенными уровнями СА 125. По данным
T. Torizuka et al. [78], чувствительность, специфичность и точность ПЭТ в диагностике рецидивов рака яичника составляли 80, 100 и 84%, тогда как эти показатели при КТ и МРТ брюшной полости и таза были соответственно 55, 100 и 64%. Методом ПЭТ выявлены рецидивы у 7 из 9 пациентов с ложноотрицательными данными, полученными при обычных методах визуализации. Среди наблюдений с повышенными уровнями СА 125 обычными методиками рецидивы правильно локализованы у 53,3% больных, ПЭТ — у 86,7%.
В диагностике опухолей опорно-двигательного аппарата ПЭТ с 18 F-ФДГ может быть существенным дополнением к обычным методам исследования. Основ-
ные трудности связаны с дифференциальным диагнозом между доброкачественными и первичными злокачественными костными поражениями, широко варьирующими по гистологической структуре. Дополнение статических изображений динамической ПЭТ с определением количественных показателей позволяет повысить специфичность исследования до 93,3% при чувствительности 81,3% [79].
При диагностике костных метастазов чувствительность и специфичность ПЭТ с 18 F-ФДГ составляли соответственно 87–96% и 66–98% и превышали эти показатели при остеосцинтиграфии с 99m Tc-MДФ. Применение ПЭТ показано при необходимости дифференцировки между доброкачественными и метастатическими поражениями, особенно в случаях с одиночными костными очагами иу больных с сомнительными данными остеосцинтиграфии [80, 81]. В наблюдениях с костными метастазами первичных злокачественных костных опухолей чувствительность, специфичность и точность ПЭТ составляли 90, 96 и 95%, тогда как при остеосцинтиграфии с 99m Tc-МДФ эти показатели были соответственно 71, 92 и 88%. У больных с метастазами саркомы Юинга диагностические показатели ПЭТ были выше, чем при остеосцинтиграфии, но в случаях с метастазами остеосаркомы чувствительность ПЭТ оказалась значительно ниже [82].
В диагностике опухолей мягких тканей ПЭТ с 18 F-ФДГ может быть эффективно использована для дифференцировки между доброкачественными и злокачественными поражениями [83], стадирования сарком [84], диагностики местных рецидивов и легочных метастазов [85, 86]. При использовании порогового значения для злокачественных процессов отношения опухоль/фон равного 3,0 чувствительность ПЭТ составляла 97,0%, специфичность — 65,7%, точность — 86,3%. Если ПЭТ применяется для идентификации всех поражений, которые требуют радикального хирургического лечения, специфичность и точность возрастают до 76,0 и 88,2%, чувствительность снижается до 92,2% [87]. ПЭТ не может заменить МРТ, так как не дает достаточно точных анатомо-топографических деталей, необходимых для хирургического лечения, но может быть эффективно использована в ряде ситуаций: при сомнительных данных УЗИ и МРТ, определении метаболической активности опухоли для решения вопроса о необходимости гистологического исследования, расхождении данных биопсии и методов визуализации.
В 1990-е годы рядом исследований была подтверждена высокая чувствительность и специфичность ПЭТ с 18 F-ФДГвдиагностикекакместно-распространенных, так и диссеминированных меланом [88–90]. В некоторых работах было показано, что данные ПЭТ могут изменять тактику лечения у 40% больных [91–92]. ПЭТ с 18 F-ФДГ может служить важным дополнениемкобычным методам обследования при стадировании у больных злокачественной меланомой. Чувствительность и специфичность ПЭТ при диагностике метастатических очагов меланомы составляла 97 и 56%, тогда как при обычных методах обследования — соответствено 62
и 22%. В 34% наблюдений стадия процесса была правильно установлена только с помощью ПЭТ [93].
Функциональные изображения, получаемые при ПЭТ с 18 F-ФДГ, могут играть важную роль в лечении лимфом, обеспечивая более точное назначение терапии в соответствии с действительным состоянием больного как в начале лечения, так и в дальнейшем, во время и после завершения терапии первой линии. При начальном стадировании ПЭТ существенно повышает количество выявляемых пораженных лимфатических узлов, хотя число больных, у которых изменяется тактика лечения, относительно невелико — не более 10% в большинстве исследований [94–96]. Чувствительность и специфичность ПЭТ с 18 F-ФДГ в режиме сканирования всего тела при ходжкинских лимфомах составляли 86 и 96%, при неходжкинских — 89 и 100%; для КТ эти показатели при ходжкинских лимфомах были 81 и 41%, при неходжкинских — 86 и 67%. При лимфогранулематозе специфичность ПЭТ была достоверно выше, что обусловлено неспособностью КТ дифференцировать активный процесс и рубцовую ткань после лечения [97]. Эффективность ПЭТ с 18 F-ФДГ в диагностике лимфом выше, чем при сканировании с 67 Ga- цитратом [98]. Следует отметить, что ПЭТ является полезным дополнением к обычной КТ, главная роль метода в этих случаях — оценка состояния лимфатических узлов с пограничными размерами. При контроле эффективности первичного лечения ПЭТ может оказать существенное влияние на оценку остаточного процесса, диагностируемого обычными методиками. Отрицательные данные ПЭТ указывают на низкую вероятность последующих рецидивов, положительные сканы отражают активный неопластический процесс, но могут быть также обусловлены воспалительными инфекционными процессами или посттерапевтическими изменениями в лимфоузлах. При этих исследованиях метод ПЭТ с 18 F-ФДГ оказался не эффективнее результатов МРТ [99].
При множественной миеломе показана высокая диагностическая точность ПЭТ с 18 F-ФДГ: в случае остеолитических очагов чувствительность составляла 92,7%, при диффузных костных поражениях в зависимости от интерпретации чувствительность колебалась в пределах 83,8–91,9%, специфичность — 83,3–100%. У 60,9% больных с литическим поражением костей ПЭТ указывала на большую протяженность процесса, чем обычная рентгенография. Результаты ПЭТ в 14,0% наблюдений повлияли на лечение. ПЭТ не адекватна для рутинного применения, но она оправдана в тех случаях, когда большая чувствительность метода может изменить тактику лечения больных, например, при солитарной плазмоцитоме. Другое возможное направление применения ПЭТ — контроль эффективности лечения у больных с несекретирующей миеломой, когда определение уровней парапротеина не отражает активности заболевания [100].
При диагностике злокачественных нейроэндокринных новообразований, по данным S. Adams et al. [101], увеличенный метаболизм глюкозы установлен толь-
ко в случае низкодифференцированных гастроэнтеропанкреатических опухолей с высокой пролиферативной активностью и метастазов медуллярного рака щитовидной железы, сопровождающихся быстрым повышением уровней раково-эмбрионального антигена. ПЭТ с 18 F-ФДГ при нейроэндокринных опухолях должна проводиться только при негативных результатах сцинтиграфии с 99m Tc(V)-ДМСА и соматостатинрецепторными РФП.
Кроме того, ПЭТ с 18 F-ФДГ достаточно широко применяется в педиатрической онкологии. Наиболее частые показания: ходжкинская и неходжкинская лимфомы: стадирование, рестадирование, оценка эффективности лечения, планирование лучевой терапии; саркомы (остеосаркома, саркома Юинга, мягкотканная саркома, особенно рабдомиосаркома): стадирование, оценка эффективности лечения, рестадирование, диагностика рецидивов; нейробластома (при МИБГнегативных случаях или ПЭТ со специфическими маркерами при опухолях симпатической нервной системы); опухоли ЦНС (стадирование, прогностические оценки, оценка эффективности лечения, диагностика рецидивов, планирование лучевого лечения; могут быть использованы другие позитронные РФП, например, меченые аминокислоты). Реже ПЭТ показана для оценки эмбриональных опухолей, гепатобластомы, опухоли Вильмса, диагностики неизвестного первичного опухолевого очага, нейрофиброматоза I типа при подозрении на злокачественную трансформацию [102].
Таким образом, ПЭТ с 18 F-ФДГ в настоящее время в онкологической практике является одним из ведущих инструментальных методов диагностики, который в развитых странах стал существенным компонентом комплексного обследования больных. ПЭТ может применяться не только для ранней диагностики первичных злокачественных новообразований. В первую очередь это высокоэффективный метод стадирования, диагностики рецидивов и метастазирования, оценки эффективности лечения широкого спектра злокачественных новообразований. Адекватное применение ПЭТ в диагностических алгоритмах позволяет повысить точность комплексной диагностики, оптимизировать тактику обследования и лечения больных и является экономически оправданным. Внедрение ПЭТ в клиническую практику является непременным условием совершенствования диагностического процесса в онкологии.