Соматотропный гормон это что такое у детей
Соматотропный гормон это что такое у детей
Соматотропный гормон – гормон, вырабатываемый гипофизом и являющийся одним из ключевых регуляторов процессов роста и развития человека. Нормальная концентрация соматотропного гормона в крови особенно важна для детей от рождения до полового созревания, так как в этот период он способствует правильному росту костей.
Гормон роста человека, соматотропин.
Синонимы английские
GH, Human Growth Hormone, HGH, Somatotropin.
Нг/мл (нанограмм на миллилитр).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Анализ определяет количество соматотропного гормона в крови. Соматотропный гормон производится гипофизом – железой размером с виноградину, расположенной у основания мозга за переносицей. Гормон обычно секретируется в кровь волнообразно в течение суток с пиком концентрации, как правило, в ночное время.
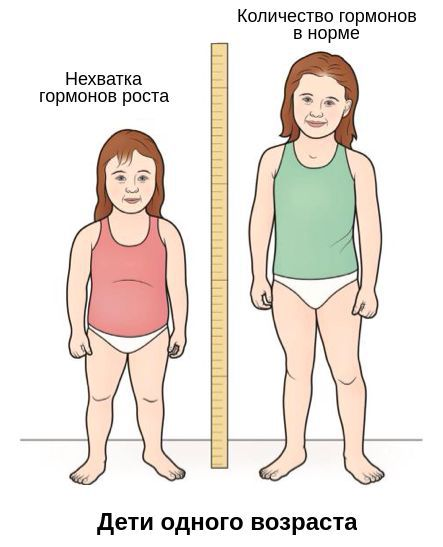
Соматотропный гормон необходим для нормального роста и развития детей, поскольку он способствует увеличению костей в длину от самого рождения ребенка и до конца его полового созревания. При недостатке образования соматотропного гормона ребенок медленнее растет. Избыточное образование соматотропного гормона часто наблюдается при опухоли гипофиза (обычно доброкачественной). Чрезмерный синтез гормона способствует излишнему удлинению костей и продолжению роста даже после полового созревания, что может приводить к гигантизму (росту выше 2 метров). Также при избытке соматотропного гормона могут наблюдаться грубые черты лица, общая слабость, замедленное половое развитие и головные боли.
Хотя у взрослых соматотропный гормон частично теряет активность, все же он продолжает играть роль в регуляции плотности костей, поддержании мышечной массы и метаболизме жирных кислот: дефицит гормона может привести к снижению плотности костей, уменьшению мышечной массы, изменению уровня липидов. Однако анализ на соматотропный гормон не является общепринятой практикой для обследования пациентов с пониженной плотностью костей, недоразвитыми мышцами и с повышенным содержанием липидов – недостаток соматотропного гормона довольно редко является причиной этих расстройств.
Избыточное производство соматотропного гормона у взрослых может вызвать акромегалию, характерная черта которой не удлинение костей, а их чрезмерная толщина. Хотя такие симптомы, как утолщение кожи, потливость, утомляемость, головные боли и боли в суставах, в начале болезни не сильно выражены, дальнейшее повышение уровня гормона может привести к увеличению рук и ступней, кистевому туннельному синдрому (болезненному ощущению в запястье) и патологическому увеличению внутренних органов. Из-за повышенного уровня соматотропного гормона иногда возникают папилломы на теле и полипы в кишечнике. Без лечения акромегалия и гигантизм часто приводят к осложнениям: диабету второго типа, повышенному риску сердечно-сосудистых заболеваний, повышенному кровяному давлению, артриту и общему сокращению продолжительности жизни.
Для диагностики аномалий соматотропного гормона наиболее часто проводится тест на его стимуляцию и подавление. Поскольку соматотропный гормон в течение дня высвобождается гипофизом волнами, спонтанное измерение концентрации гормона обычно не применяется в клинической практике.
Для чего используется исследование?
Анализ на соматотропный гормон не рекомендуется выполнять для общего обследования организма. В основном он осуществляется только при подозрениях на нарушения, связанные с его производством, и назначается после выполнения анализов на другие гормоны либо для помощи в исследовании функции гипофиза.
Анализ выполняется для проверки избыточного или недостаточного количества производства соматотропного гормона и для получения информации о том, насколько тяжело заболевание. Он является частью диагностического обследования при выяснении причин аномального синтеза соматотропного гормона, а кроме того, может использоваться для оценки эффективности лечения акромегалии или гигантизма.
Вместе с анализом на соматотропный гормон часто выполняется и анализ на инсулиноподобный фактор. Последний также отражает избыток или недостаток соматотропного гормона, но его уровень остается стабильным в течение дня, тем самым делая его показателем среднего содержания соматотропного гормона.
Диагностика отклонений СГ часто включает в себя тест на его стимуляцию и подавление, которые используются для оценки функции гипофиза и изменений уровня соматотропного гормона.
Для проверки функционирования гипофиза часто используются и другие исследования, такие как анализ на Т4 (тироксин), тиреотропный гормон, кортизол, фолликулостимулирующий гормон (ФСГ), лютеинизирующий гормон (ЛГ) и тестостерон (у мужчин). Они обычно выполняются перед анализом на соматотропный гормон для того, чтобы убедиться, что их показатели соответствуют норме либо находятся под контролем принимаемых лекарств. Например, гипотиреоз у детей должен быть вылечен до исследования на дефицит соматотропного гормона, иначе полученные показатели могут быть ошибочно низкими. Образец крови, взятый для теста на подавление соматотропного гормона, используется и для анализа на уровень глюкозы, чтобы убедиться, что организм обследуемого пациента достаточно подавлен принятым раствором глюкозы.
Поскольку физические упражнения обычно временно повышают уровень соматотропного гормона, иногда его недостаточность оценивают после интенсивных упражнений, совершаемых в течение некоторого периода времени.
Анализ на соматотропный гормон и инсулиноподобный фактор роста периодически могут назначать детям, подвергшимся радиоактивному лечению центральной нервной системы или облучению перед трансплантацией стволовых клеток. Это довольно распространено при остром лимфобластном лейкозе, когда радиация может подействовать на гипоталамус и гипофиз и таким образом повлиять на рост.
Когда назначается исследование?
Тест на стимуляцию соматотропного гормона выполняется, если у ребенка наблюдаются следующие симптомы дефицита этого гормона:
Тест на стимуляцию у взрослых пациентов может потребоваться при симптомах дефицита соматотропного гормона или гипопитуитаризма: пониженная плотность костей, утомляемость, нарушение липидного метаболизма, пониженная устойчивость к физическим упражнениям. Как правило, сначала выполняются анализы на другие гормоны, чтобы узнать, не являются ли иные болезни причиной этих симптомов. Недостаточность производства соматотропного гормона – довольно редкое явление как среди детей, так и среди взрослых. Дефицит гормона у взрослых может возникнуть из-за генетической предрасположенности к болезни гипоталамуса или гипофиза.
Тест на подавление соматотропного гормона проводится, если у ребенка наблюдаются признаки гигантизма либо у взрослого присутствуют признаки акромегалии. Такой анализ может потребоваться и в случае, когда возникает подозрение на опухоль гипофиза, иногда тест выполняется вместе с анализом на инсулиноподобный фактор – 1 и анализами на другие гормоны для мониторинга эффективности лечения болезни.
Анализы на соматотропный гормон и инсулиноподобный фактор – 1 могут выполняться регулярно через определенные интервалы в течение многих лет для мониторинга возможных рецидивов аномалий соматотропного гормона.
Что означают результаты?
Референсные значения
Интерпретировать результаты анализов на соматотропный гормон нужно с большой осторожностью. Уровень выделения гормона гипофизом постоянно варьируется (на диаграмме это можно отразить в виде волнообразной линии), так что для получения объективных показателей необходимо измерять его несколько раз и как итог брать средний результат. Важно не ошибиться, приняв суточные колебания нормы уровня гормона за аномалию.
Уровень соматотропного гормона повышен в утренние часы, а также после физических упражнений. Следует сопоставить показатели соматотропного гормона с данными анализа на инсулиноподобный фактор и с реакцией организма на стимуляцию и подавление соматотропного гормона.
Тест на стимуляцию соматотропного гормона
Если уровень соматотропного гормона не повышается тестом на его стимуляцию (содержание его остается ниже, чем должно быть) и при этом наблюдаются симптомы пониженного содержания соматотропного гормона и инсулиноподобного фактора, то вполне вероятно, что дефицит соматотропного гормона можно будет вылечить. В случае понижения уровня тиреотропного гормона в первую очередь необходимо выяснить, не является ли недостаточность щитовидной железы причиной симптомов, похожих на дефицит соматотропных гормонов. Кроме того, возможно наличие гипопитуитаризма или общее снижение функциональной активности гипофиза. Анализ на дефицит соматотропного гормона обычно выполняется лишь после обследования функции щитовидной железы. При диагностике гипопитуитаризма прежде, чем выполнить анализ на соматотропный гормон, необходимо назначить лечение гипопитуитаризма и измерить скорость роста.
Если у пациента после интенсивных физических нагрузок не повышается уровень соматотропного гормона, это может указывать на его нехватку. В этом случае требуются дополнительные анализы.
Тест на подавление соматотропного гормона
Если при проведении теста на подавление соматотропного гормона его уровень понижается незначительно (то есть содержание гормона остается выше, чем должно быть) и при этом наблюдаются симптомы гигантизма или акромегалии, а также повышенное содержание инсулиноподобного фактора, вполне вероятно, что соматотропный гормон синтезируется в избыточном количестве. Обнаруженные рентгеноскопическим анализом, компьютерной томографией или отображением магнитного резонанса уплотнения порой свидетельствует об опухоли гипофиза (обычно доброкачественной). При мониторинге после излечения от опухоли повышенный уровень соматотропного гормона может указывать на рецидив болезни.
Опухоли гипофиза являются наиболее распространенной причиной избыточного производства соматотропного гормона, хотя иногда они вызывают и его недостаточность. Они могут влиять не только на выработку соматотропного гормона, но и на производство других гормонов гипофиза, таких как адренокортикотропный гормон (синдром Кушинга) или пролактин (галакторея). При развитии опухоль относительно большого размера способна подавлять выработку гормонов гипофизом и повреждать окружающие ткани.
Результаты анализа на соматотропный гормон зависят от нескольких факторов. Во-первых, это лекарственные препараты, повышающие (амфетамины, аргинин, допамин, эстрогены, глюкагон, гистамин, инсулин, леводопа, метилдопа и никотиновая кислота) и понижающие (кортикоиды и фенотиазины) уровень соматотропного гормона. Во-вторых, обследование с применением радиоактивных веществ менее чем за неделю до исследования.
После выявления причин аномального уровня соматотропного гормона его обычно можно скорректировать. Для лечения дефицита соматотропного гормона у детей используют синтетический гормон роста (у взрослых его применяют редко). Если причиной избыточного производства соматотропного гормона являются опухоли гипофиза, то в таком случае может применяться сочетание хирургических, медикаментозных методов и радиооблучения.
Чтобы лечение прошло успешно, важно выявить аномалии соматотропного гормона как можно раньше. Увеличение размеров костей, обусловленное гигантизмом и акромегалией, является постоянным. Если эти болезни не лечить, дефицит соматотропного гормона может привести к низкому росту у детей.
Кроме того, могут наблюдаться долговременные осложнения, связанные с нарушениями производства соматотропного гормона. Например, акромегалия иногда вызывает полипы в толстом кишечнике (что увеличивает риск возникновения рака кишечника), диабет, повышенное кровяное давление и болезни зрения. Если опухоль гипофиза непрерывно разрушает его клетки, может потребоваться многократная гормональная терапия. Усиленный рост костей грозит ослаблением их прочности, защемлением нервов (кистевой туннельный синдром) и артритом.
Между тем следует иметь в виду, что в большинстве случаев низкий рост не связан с недостаточностью соматотропного гормона. Он может быть обусловлен наследственностью, разнообразными болезнями и внешними факторами, а также различными генетическими отклонениями.
Изредка симптомы дефицита соматотропного гормона могут наблюдаться и при его нормальном или даже повышенном уровне, это происходит благодаря наследственной резистентности (устойчивости) к соматотропному гормону. В таком случае его уровень повышен, в то время как уровень инсулиноподобного фактора, напротив, понижен.
Кто назначает исследование?
Эндокринолог, педиатр, терапевт, онколог, хирург.
Недостаток гормона роста
Является ли недостаток гормона роста болезнью? Как выражается дефицит соматотропина и что это такое, его причины, как лечить?Все эти пункты будут рассмотрены в статье врачом-эндокринологом.
Соматотропный гормон, его значение и функции
Соматотропин, в сокращении СТГ, а наиболее известен, как гормон роста, очень важен для роста костей и тканей организма ребенка. Данное вещество отвечает за физическое, половое и умственное развитие, а его недостаток неминуемо приведет к трудностям.
Самый активный синтез соматотропина приходится на детство и подростковый возраст, далее постепенно снижается и приостанавливается, что вызывает старение организма. Снижение концентрации в тканях происходит после 20 лет и более интенсивно начинается после 25.
Достаточно интересен тот факт, что данный гормон не вырабатывается в организме постоянно одинаковыми порциями, в течение суток у него есть пики и спады. Так, наибольшая выработка приходится на время сна и занятий активным физическим трудом (пробежки, плавание, подъем веса и т.п.).
Основная роль, какое количество СТГ будет выработано, зависит от генетической предрасположенности. Встречаются случаи, когда уже с рождения для нормального развития детям требуется дополнительно количество соматотропина.
Часто можно увидеть вопрос о том, какое заболевание сопровождается дефицитом гормона роста, так вот, пациенты с развитым остеопорозом практически всегда имеют нехватку соматотропина.
По МКБ код Е23 у данной патологии (Международной классификации болезней).
Основные функции
Уже было отмечено, что основная роль соматотропина заключается в росте костей, однако, это не все его функции, необходимо упомянуть еще ряд:
Существуют еще функции, которые выполняет гормон роста, но самые значимые из них перечислены.
Причины дефицита гормона роста у взрослых
Дефицит соматотропного гормона может быть вызван такими нарушениями:
Не исключаются наследственные предрасположенности к небольшой выработке гормона роста по той или иной причине.
Сколько живут люди с дефицитом гормона роста сложно сказать, так как все зависит от причины дефицита и его характера.
Причины развития дефицита гормона роста у ребенка
Имеются случаи, когда организм ребенка не вырабатывает достаточное количество соматотропина, а это значит, что не будет роста и развития. Обычно это обусловлено генетическими факторами: наследственность или мутация генов. Реже встречаются у детей опухоли в гипофизе и вирусные инфекции, приводящие к недостатку гормона роста.
Гормон роста у детей может перестать вырабатывать в нужном количестве в любом возрасте, если его причиной не является генетический фактор. Если же проблема в генах, то в первые годы жизни это будет заметно.
Родителям необходимо внимательно следить за состоянием своего ребенка. При рождении может не возникнуть мысли в каких-либо патологиях, обычно такие дети рождаются нормальными и растут как все в первые месяцы, однако дальше можно заметить, что рост костей не соответствует норме. Половые признаки могут развиваться очень медленно или не развиваться вообще, из-за чего в подростковом возрасте возникает масса проблем: не приходят менструации, у мальчика недостаточно развит половой орган и другое.
Умственные отклонения не являются ярко выраженными для такого рода заболевания, ребенок может ходить в обычную школу, нормально общаться со сверстниками, однако изучение нового материала, его усвоение будет даваться очень тяжело.
Лечение детей с такой дисфункцией заключается во введении синтетического гормона роста. Инъекции необходимо делать постоянно для нормального развития и последующей жизни ребенка.
Если патология была выявлена рано, то медикаментозное лечение будет крайне успешным, в то время как обнаружение проблемы в позднем возрасте, после 8 лет и начатая гормонзаместительная терапия может не дать серьезных результатов.
Принципы лечения недостатка гормона роста
Лечение пациентов с подтвержденным диагнозом будет сформировано, опираясь на причины, вызвавшие дефицит СТГ.
Если виной диагноза послужила опухоль, то по возможности ее удаляют (это может быть сделано, как инвазивными, так и не инвазивными методами, в зависимости от места расположения образования, его размера и степени развития). Основным же пунктом лечения для большинства людей с недостатком гормона роста является заместительная гормональная терапия. В некоторых случаях необходимо дополнительное введение самого соматотропина в тело человека, в других случаях вводят гормоны, которые будут стимулировать естественную выработку гормона роста.
Так как чаще всего опухоль при данном отклонении развивается в гипофизе, то ее удаление хирургическим путем затруднено, а ребенок после такой операции может остаться с частично поврежденным гипофизом.
К какому врачу обратиться
При нарушенной работе гормональной системы человеку необходимо обратиться в первую очередь к врачу-эндокринологу. Врачи данной специальности смогут разобраться в проблеме, будут сделаны соответствующие диагностические процедуры, поставлен диагноз и назначено лечение. Нельзя самостоятельно ставить себе диагноз, опираясь на форумы и тем более назначать лечение.
Я, Романов Георгий Никитич, являюсь опытным врачом-эндокринологом, владею современными методиками лечения. В числе моих пациентов за более чем 20 лет работы, были случаи дефицита гормона роста, мы выявляли первопричины и успешно проводили их устранение. Сейчас я веду приема в платной клинике в г.Гомеле, а также провожу онлайн консультации на удобных для пациента платформах. В рамках платной онлайн консультации я могу изучить симптоматику, порекомендовать необходимые методы диагностики, помочь с расшифровкой анализов и проводить корректировку лечения. Для записи на прием необходимо написать в мой личный профиль в одном из представленных мессенджеров: ВКонтакте, instagram, WhatsApp, skype, Viber.
Синдром высокорослости: дифференциальная диагностика
Описаны закономерности роста ребенка, рассмотрены аспекты генетической и гормональной регуляция роста, методы оценки роста ребенка и диагностика высокорослости и ее причины.
Consistent patterns of child growth are studied, the aspects of genetic and the hormonal control of growth, evaluation methods of the child growthand diagnostics of excessive height and its reasons were also studied.
Рост — это генетически запрограммированный процесс, который проявляется в увеличении линейных размеров организма и его органов при наличии оптимальных средовых факторов существования. Он носит ступенчатый характер: периоды ускорения сменяются периодами снижения темпов, а скорости линейного и объемного роста всего тела и его частей не совпадают по времени.
При рождении длина тела ребенка колеблется в пределах от 46 до 55 см. После рождения рост неуклонно увеличивается. На первом году жизни прибавка в росте составляет около 25 см, достигая к году в среднем 75 см. За второй год рост увеличивается на 12–13 см. Возраст от 2 лет до начала полового созревания является самым длинным периодом роста ребенка и в наибольшей степени определяет окончательный рост индивидуума. Пубертатный период характеризуется скачком роста (10–15 см в год) и обусловлен влиянием соматотропного гормона гипофиза (СТГ), а также повышением продукции половых гормонов (андрогенов и эстрогенов).
Одним из основных проявлений СТГ, его физиологического действия является рост эпифизарного хряща. Действие СТГ на процессы роста осуществляется путем прямого воздействия на зону роста, через увеличенную выработку инсулинового фактора роста-1 (ИФР-1), синтезируемого в печени через местные ростовые факторы в эпифизарной зоне роста.
Половые стероиды оказывают непосредственное воздействие на ростовые зоны. Кроме того, они способствуют повышению амплитуды секреции СТГ.
Рост ребенка подчиняется определенным законам [1]:
Закон неуклонного торможения энергии роста. Наиболее высока скорость роста с 8-й по 25-ю неделю внутриутробного периода. С 34-й недели гестационного периода происходит замедление роста на фоне существенных нарастаний массы тела. К рождению ребенка малые прибавки в длине и массе его тела объясняют феноменом «объемного торможения» вследствие ограниченного объема полости матки. Торможение энергии роста хорошо прослеживается в первые два года жизни ребенка. В последующем падение скорости роста носит прерывистый характер.
Закон неравномерности изменений скорости роста. Характеризуется чередованием направлений роста: фазы максимальной интенсивности деления клеток и фазы их дифференцировки не совпадают во времени. Каждая кость в организме человека и весь скелет в целом растут последовательно, сменяя фазы роста в длину и толщину. В периоды снижения скорости роста костной ткани в организме ребенка преобладает прибавка массы тела. Так, с 1-го по 4-й и с 8-го по 10-й годы преобладает нарастание массы тела, а годы с 4-го по 7-й и с 10-го по 12-й у девочек и с 13-го по 16-й у мальчиков характеризуется преобладанием роста длины тела по сравнению с его массой. Окончание роста у девушек приходится на 16–17 лет, а у юношей на 18–19 лет. Неравномерность роста прослеживается в зависимости от времени суток и сезона. Темпы роста выше в ночные часы и летние месяцы.
Закон аллометрического роста. Детям свойствен аллометрический темп роста, то есть непропорциональность роста отдельных частей тела и внутренних органов. Проявлением этого феномена является закон краниокаудального градиента роста: во внутриутробный период, в силу особенностей кровообращения плода, отмечается преимущественный рост частей тела, расположенных ближе к голове и прежде всего самой головы. После рождения, наоборот, наиболее интенсивно растут части тела, расположенные дистально. За период роста ребенка длина нижних конечностей увеличивается в 5 раз, верхних — в 4 раза, туловища — в 3 раза, высота головы — в 2 раза. Благодаря этому у ребенка с возрастом происходят изменения пропорций тела и внешнего облика, которые постепенно приближаются к таковым у взрослого. Так, средняя точка тела от пупка у доношенного новорожденного ребенка смещается. У некоторых людей она может опускаться ниже симфиза, проецируясь на бедро. Соотношение верхнего и нижнего сегментов тела, составляющее на первом году жизни 1,75–1,5, у подростков и взрослых приближается к единице.
После 7 лет начинает сказываться влияние половой принадлежности, а в пубертатном возрасте начинает проявляться тип конституции. При оценке пропорций телосложения необходимо учитывать также наследственные факторы, национальность, расово-этнические особенности ребенка.
Закон половой специфичности роста. Проявляется в том, что мальчики имеют более высокие показатели конечного роста, хотя девочки относительно раньше (на 1–2 года) вступают в период пубертатного «вытяжения». Тем не менее, скорость созревания скелета после 2–3 лет у девочек больше. Это является отражением более быстрого биологического развития девочек, которое прослеживается по всем органам и системам.
Генная и гормональная регуляция роста
Взаимодействие генетических, нейроэндокринных и средовых факторов определяет индивидуальный рост человека. Множество генов ответственны за синтез костных и соединительнотканных белков, костных структур, синтез фактора контроля скорости роста, эпидермального фактора роста, фактора роста нейронов, темпы дифференцировки тканей, изменения активности ферментов, синтез гормонов и чувствительность клеточных рецепторов к гормонам и факторам роста.
Это гомеобокс-гены, локализованые на 7-й и 17-й хромосомах, протоонкогены и антионкогены, гены «переключения», гены апоптоза, гены, контролирующие синтез гормонов и пептидых факторов роста, гены, контролирующие синтез белков, связывающих гормоны, и др.
Генетическая программа роста в постнатальной жизни реализуется не сразу после рождения, а в основном в два периода, когда корреляции между ростом родителей и детей наиболее значимы, — от 2 до 9 лет и от 13 до 18 лет. Наследственные факторы определяют главным образом темпы роста, окончательные размеры тела, его частей, внутренних органов, некоторые конечные особенности телосложения, время и темпы пубертатных изменений. Во внутриутробном периоде большую роль в процессах роста играют плацентарные гормоны беременной. Плацентарный лактоген обладает высокой степенью сходства молекулярной структуры с гормоном роста (ГР) человека и оказывает общее влияние на метаболизм клеток, их митотическую активность. Среди тканевых регуляторов роста ведущую роль отводят инсулину, эпидермальному фактору роста, тироксину.
Гипоталамо-гипофизарная система плода не оказывает существенного влияния на ростовые процессы. После рождения ведущими факторами, оказывающими влияние на рост является нейроэндокринная регуляция с участием гипоталамо-гипофизарной системы, на которую могут оказывать существенное воздействие питание и патологические факторы.
В первые пять лет жизни ребенка проявляется наибольший ростовой эффект тиреоидных гормонов. В дальнейшем роль тироксина сводится к участию в синтезе инсулиноподобных факторов роста (ИФР-1, ИФР-2), являющихся «посредниками» в реализации действия соматотропного гормона, повышению чувствительности рецепторов к гормону роста [2].
После двух лет усиливается активность передней доли гипофиза, повышается выделение соматотропного гормона, который с 5 лет становится определяющим в стимуляции хондрогенеза и линейного роста кости. Доказано, что ГР синтезируется не только в передней доле гипофиза, но и в Т-лимфоцитах.
Гормон роста производит два различных воздействия на клетки организма. Первое — непосредственное — действие состоит в том, что в клетках усиливается распад накопленных ранее запасов углеводов и жиров, их мобилизация для нужд энергетического и пластического обмена. Второе — опосредованное — действие осуществляется с участием печени. В ее клетках под воздействием гормона роста вырабатываются вещества-посредники — ИФР, которые уже воздействуют на все клетки тела. Под влиянием ИФР усиливается рост костей, синтез белка и деление клеток. В костной ткани СТГ воздействует на проксимальную область «ростовой зоны», а ИФР-1 на дистальную, более высокодифференцированную.
В пубертатном периоде доминирующее влияние на процессы роста начинают выполнять половые гормоны, которые увеличивают спонтанную и стимулируемую секрецию СТГ. В этом решающую роль играют эстрогены у детей обоего пола. В физиологических дозах эстрогены ускоряют рост в пубертатном периоде, в больших количествах усиливают кальцификацию матрикса, повышают плотность кости, стимулируют активность остеобластов, что приводит к торможению и прекращению линейного роста. Окончательный рост, которого достигает человек, зависит от размеров длинных трубчатых костей (голени и бедра). Андрогены способствуют закрытию эпифизарных зон роста и, таким образом, прекращают рост.
На скорость роста скелета, процессы оссификации хрящей влияют половые Х- и Y-хромосомы. Согласно J. Tanner, Y-хромосома задерживает созревание скелета, обусловливает более позднее наступление пубертатного периода у мальчиков и определяет половые различия конечного роста. Несколько генных локусов Х-хромосом девочек контролируют секрецию гормонов роста. Доказательством тому является дополнительная Х-хромосома у больных с синдромом Клайнфельтера, обуславливая у них высокий рост, а отсутствие одной Х-хромосомы у детей с синдромом Шерешевского–Тернера вызывает низкорослость [3].
Оценка роста ребенка
Индивидуальная оценка физического развития ребенка проводится путем сравнения величин его роста, массы, окружности головы и груди с величинами стандартов для соответствующего возраста и пола.
Оценка роста со стандартами проводится следующими способами:
1) по центильным таблицам;
2) по сигмальным таблицам;
3) по ориентировочным эмпирическим формулам.
Все перечисленные методы используются в мировой практике, однако самое широкое распространение получила оценка по таблицам стандартов центильного типа. В повседневной практике оценка роста по эмпирическим формулам также не потеряла своего значения, особенно при исследовании детей раннего возраста [4].
Нормальный (средний) рост: показатели роста отклоняются от средних величин не более ± 15 и входят в интервал 25–75 центилей. Данный рост наблюдается у 50% здоровых детей данного пола и возраста.
Область величин выше среднего (75–90 центилей) и ниже среднего (10–25 центилей) имеют соответственно 15% детей данного пола и возраста.
Большой рост, макросомия, укладывается в 90–97 центилей.
Очень высокий рост — гигантизм: показатели роста выше 97 центилей.
Расчет сpеднего ожидаемого окончательного pоста
Имеется несколько способов прогнозирования приблизительного окончательного роста детей. Наиболее простой способ используют для расчета окончательного pоста здоpовых детей, имеющих «костный» возраст, соответствующий или близкий к «паспоpтному». Поскольку имеется высокая положительная корреляция между ростом детей и родителей, предложены формулы для расчета роста детей в зависимости от роста родителей.
Высокорослость диагностируют при превышении длины тела на 2 и более стандартных отклонений (SD) роста для данного пола и хронологического возраста. Высокорослость является меньшей проблемой для ребенка, чем низкорослость, и даже считается преимуществом. Но дети с чрезмерно высоким ростом могут встретиться с социальными и психологическими проблемами. Это неадекватное отношение окружающих к себе, проблемы с выбором профессии. Обычно чрезмерный рост у детей заставляет родителей обращаться к врачу в случаях сопутствующих симптомов в виде утомляемости, частых заболеваний, нарушений осанки, полового развития и др. При их отсутствии ускоренный рост редко является причиной для беспокойства. В то же время известно, что у подростков с высоким ростом в пубертатный период может формироваться функционально неполноценное сердце, что объясняется отставанием структурно-морфологического развития сердечной мышцы от скорости роста костей. Также установлено, что при ускоренных темпах роста тела в длину наблюдается отставание в формировании сосудистой системы, в результате чего создаются предпосылки для нарушения регуляции тонуса сосудов, повышения артериального давления, нарушения адаптации сердца к физической нагрузке [5].
Было доказано, что высокорослость юношей и девушек сочеталась с относительным (на кг массы тела) снижением становой мышечной силы. Это связано по всей вероятности с отставанием роста скелетной мускулатуры от темпов роста тела в длину.
Изучение гемодинамических показателей в покое и при выполнении функциональной пробы со стандартной физической нагрузкой позволило отметить у высокорослых юношей и девушек более высокие значения частоты сердечных сокращений в покое, при дозированной физической нагрузке, более продолжительный восстановительный период, тенденцию к повышению артериального давления по сравнению со средними значениями в популяции. Полученные данные свидетельствуют о менее совершенных механизмах регуляции сердечно-сосудистой системы, снижении экономичности функционирования системы кровообращения у людей с высоким ростом.
Основные причины высокорослости:
1) конституционально-наследственная;
2) эндокринные — связаны с избытком СТГ в детском и подростковом возрасте и некоторыми вариантами гипогонадизма у подростков;
3) хромосомно-генетические;
4) преждевременное половое развитие у детей раннего возраста.
Конституционально-наследственная, или семейная, высокорослость обусловленна генетическими факторами. Она является вариантом нормы и встречается чаще у лиц мужского пола. Семейная высокорослость характеризуется высокими темпами роста, пропорциональным ростом и телосложением, нормальным ростом и массой тела при рождении, костный возраст соответствует хронологическому, умственное развитие в норме.
При лабораторном исследовании у детей с конституциональной высокорослостью уровни базального СТГ, ИФР-1 и ИФР связывающего белка (ИФРСБ-3) в крови — в пределах возрастной нормы. При проведении супрессивного теста — секреция СТГ ингибируется в ответ на введение глюкозы или тиролиберина.
Диагноз не представляет затруднений. О данном виде высокорослости свидетельствует большая длина и масса тела при рождении, ускоренный рост во все возрастные периоды, нормальное физическое и половое созревание, отсутствие каких-либо патологических симптомов центральной нервной системы и желез внутренней секреции, высокий рост родителей или других ближайших родственников. Дифференцировка костей скелета соответствует паспортному возрасту или несколько опережает его. Лечения обычно не требуется.
Высокорослость, связанная с эндокринной патологией
Гипоталамо-гипофизарный гигантизм
Заболевание возникает при аденоме передней доли гипофиза и связано с избыточной продукцией соматотрофами гормона роста. Основным эффектом ГР у детей и подростков является стимуляция продольного роста костей: преимущественно это касается длинных трубчатых и в меньшей степени — губчатых (позвонков). Гигантизм развивается у детей с незавершенными процессами окостенения, проявляется чаще в возрасте 9–14 лет и прогрессирует до закрытия зон роста. ГР активирует обмен костной ткани, вызывая усиление остеообразования. Это отмечено у больных акромегалией (избыточная секреция ГР).
При гипоталамо-гипофизарном гигантизме скорость роста ребенка повышена с момента заболевания. У детей и подростков пропорциональная высокорослость может быть основным и единственным обращающим на себя внимание симптомом. Конечный рост у женщин превышает 190 см, у мужчин 200 см. Родители имеют обычно нормальный рост.
Чаще у больных обнаруживают СТГ-секретирующую аденому гипофиза, и только в редких случаях имеется избыточная секреция соматолиберина гипоталамусом или некоторыми опухолями, приводящая к гиперплазии гипофиза. У 40% больных имеется смешанная аденома, секретирующая помимо СТГ пролактин (ПРЛ). Акромегалия или парциальный гигантизм в результате повышенной чувствительности отдельных частей тела к СТГ у детей встречается крайне редко. Однако известны случаи эктопированной секреции соматолиберина опухолями легких, желудочно-кишечного тракта, надпочечников, поджелудочной железы. Повышенная секреция гормона роста может провоцироваться интоксикацией, нейроинфекцией, черепно-мозговыми травмами.
Различают две формы гипоталамо-гипофизарных заболеваний, характеризующихся избыточной продукцией соматотропного гормона: гигантизм и акромегалию. Гигантизм характеризуется высокорослостью с пропорциональным увеличением всех частей тела, а акромегалия — непропорциональным увеличением отдельных частей тела на фоне высокого или среднего роста. Развитие гигантизма типично для детей и подростков, не закончивших рост, а акромегалии — для взрослых, у которых происходит преимущественный рост костей лицевого черепа, реже дистальных отделов конечностей.
Основным клиническим симптомом высокорослости является ускорение темпов роста с момента заболевания и высокий рост (SDS — коэффициент стандартного отклонения — составляет +3 и более). Пропорции тела сохранены, но кисти и стопы растут относительно быстрее, огрубляются черты лица, увеличиваются промежутки между зубами, половое развитие задержано. Как правило, имеется повышенная потливость, вторичный деформирующий остеоартроз крупных суставов, артериальная гипертензия, а при сопутствующей гиперпролактинемии — ожирение, гинекомастия и галакторея. Типичны повышенная утомляемость, слабость, головокружения, нарушения зрения (в первую очередь сужение полей зрения), общемозговая симптоматика, обусловленная опухолью.
Гигантизм может сопровождаться гормональными нарушениями. У женщин развивается первичная аменорея, бесплодие, у мужчин — гипогонадизм. Супрагипоталамический тип локализации опухоли при гигантизме может вызывать синдром несахарного диабета, гипо- и гипертиреоз.
Главным лабораторным подтверждением диагноза является повышение уровней СТГ выше 10 нг/мл в нескольких произвольно взятых пробах крови или повышение экскреции СТГ с мочой. При исследовании крови обычно обнаруживают гипергликемию натощак или в ходе пробы на толерантность к углеводам и гиперкальцийурию. Уровень пролактина в крови повышен. Дифференциальный диагноз с другими формами высокорослости проводят при помощи одного из самых надежных диагностических тестов — теста угнетения СТГ глюкозой. После подтверждения диагноза обязательная программа обследования включает магнитно-резонансную томографию (МРТ) или КТ (компьютерную томографию) головного мозга. Костный возраст (рентгенограмма кистей рук) отстает от паспортного на 1,5–2,0 SD. Обследование глазного дна выявляет сужение полей зрения и отечность сетчатки.
Лечение зависит от причины гигантизма. Это противоопухолевая, противовоспалительная, рассасывающая терапия. Для снижения секреции гормона роста применяется соматостатин, а половые гормоны — для ускорения закрытия зон роста [6].
Синдром Вермера (множественная эндокринная неоплазия I типа — МЭН-I)
Это генетически детерминированное заболевание, обусловленное мутацией гена супрессии опухолей (11q13). В основе патогенеза лежит гиперплазия или опухолевая трансформация эндокринных желез. Для синдрома Вермера характерно поражение околощитовидных желез, островковых клеток поджелудочной железы, гипофиза, коры надпочечников.
Выделяют наследственные и спорадические формы МЭН-I. Чаще всего клиника проявляется симптомами гиперпаратиреоза, который в большинстве случаев отличается длительным латентным периодом с минимальной клинической симптоматикой. Поражения почек и костей наблюдаются не всегда. Пик заболеваемости приходится на возраст 20–40 лет, но иногда может проявляется и у детей. Если обнаружен гиперпаратиреоз, следует исключить данное заболевание. При установлении диагноза МЭН-I следует обязательно обследовать членов семьи больного.
Опухоли аденогипофиза в половине случаев отличаются достаточно быстрым или умеренным ростом. Обычно эти опухоли не секретируют гормоны. Активно растущие злокачественные опухоли сдавливают и разрушают гипофиз и приводят к гипопитуитаризму. Реже встречаются аденомы, секретирующие пролактин, СТГ или адренокортикотропный гормон (АКТГ). Такие аденомы вызывают, соответственно, галакторею и аменорею, у детей высокорослость или акромегалию у взрослых. Небольшие гормонально-неактивные опухоли обычно выявляются лишь с помощью КТ и МРТ при подозрении на МЭН-I.
Гиперплазия соматотропных клеток или СТГ-секретирующая аденома могут быть вызваны эктопической продукцией соматолиберина опухолями островковых клеток, надпочечников или злокачественными опухолями, происходящими из других клеток системы АПУД.
При подозрении на синдром Вермера следует исследовать уровень кальция, пролактина, глюкозы. Визуализация поджелудочной железы малоинформативна, поскольку не позволяет выявлять опухоли из островковых клеток на ранних стадиях развития. Поэтому показаны гормонально-метаболические исследования, в том числе измерение базального уровня инсулина, глюкагона, панкреатического полипептида, соматостатина и гастрина, а также оценка секреции этих гормонов после приема пищи. Проведение КТ и МРТ обязательно для исключения объемных образований центральной нервной системы [7].
Синдром Карнея
Редкое наследственное заболевание с аутосомно-доминантным типом наследования. Характеризуется образованием у детей множественных опухолей (СТГ-секретирующие аденомы гипофиза, миксомы сердца, пигментные опухоли кожи, пигментная узловая гиперплазия надпочечников, фиброаденомы молочных желез, опухоли яичек). Картирован ген PRKAR1-α на 17q24 хромосоме, мутации которого способствуют развитию симтомокомплекса.
Симптомы зависят от размера, подвижности и расположения опухоли. Пятнистая пигментация кожи чаще всего встречается на лице, особенно на губах, веках, конъюнктиве и слизистой оболочке полости рта. Миксома сердца может привести к тромбоэмболии, сердечной недостаточности и может проявляться лихорадкой, болью в суставах, одышкой, диастолическим шумом. Миксома может развиться вне сердца, как правило, на коже и в груди. Клинически эндокринные опухоли могут проявляться в виде расстройств, характерных для синдрома Кушинга.
Гипогонадизм
Другой распространенной причиной высокорослости является гипогонадизм. Дети с гипогонадизмом до 13–14 лет растут, как и их сверстники, только позже, при отсутствии пубертатного «ростового скачка», скорость роста несколько снижается. Но конечный рост у них чаще превышает расчетный генетический рост, так как зоны роста долго остаются открытыми и способность к линейному росту сохраняется до 20 лет и более. Отсутствие половых гормонов в период пубертата приводит главным образом к росту конечностей, соотношение верхнего и нижнего сегмента тела снижается, формируется евнухоидные пропорции тела. С 13–14 лет намечается отставание костного возраста.
Причиной гипогонадизма могут быть врожденные или приобретенные опухоли ЦНС, гипоталамо-гипофизарных структур, а также врожденные аномалии половой дифференцировки, обусловленные как патологией формирования гонады, так и врожденными дефектами биосинтеза половых стероидов или нарушениями их клеточного метаболизма [7].
Для таких подростков характерны евнухоидные пропорции тела. Высокий рост, относительно длинные конечности, высокая талия, бедра относительно шире пояса верхних конечностей, отложение жира в областе сосков, на животе, у гребешков подвзошных костей. Мышцы дряблые, голос высокий детский. Недоразвитие половых органов, слабо выраженные вторичные половые органы, скудная растительность на лице.
Хромосомно-генетические причины
Синдром Сотоса, или синдром церебрального гигантизма, впервые описан американским педиатром J. Sotos в 1964 г. Частота патологии не установлена. Среди больных преобладают мальчики.
Заболевание наследуется по аутосомно-доминантному типу. Поскольку большинство описанных случаев носит спорадический характер, ранее многие из них расценивались как пример аутосомно-рецессивного наследования синдрома Сотоса. Однако в настоящее время эти данные рассматриваются в качестве примеров неполной пенетрантности патологического гена, гонадного мозаицизма или генетической гетерогенности болезни. Относительно недавно появились сообщения о возможной локализации гена синдрома Сотоса на коротком плече хромосомы 3, в регионе р21.
Заболевание манифестирует с рождения. Обращают на себя внимание крупные размеры новорожденного ребенка. Средняя длина тела составляет 55 см, масса — 3900 г. В первые 3–4 года жизни отмечается интенсивное увеличение роста. Типичны и черепно-лицевые дисморфии: макродолихоцефалия, выступающие лобные бугры, грубые черты лица с гипертелоризмом, страбизм, антимонголоидный разрез глаз, выступающая нижняя челюсть (прогнатизм), макроглоссия и высокое небо. Костные изменения проявляются следующими особенностями: большие кисти и стопы, кифосколиоз, синдактилия стоп. Со стороны внутренних органов иногда выявляется висцеромегалия. Возможны пороки развития — сердца, почек, центральной нервной системы. В отдельных случаях наблюдаются судороги и нарушение координации. Степень умственной отсталости варьирует, но, как правило, бывает умеренно выраженной.
Рентгенофункциональные методы исследования выявляют опережение костного возраста, неспецифические изменения на ЭКГ, расширение желудочков мозга. Показана магнитно-резонансная томография. При лечении синдрома Сотоса рекомендуется применение сосудистых средств, ноотропов, витаминов.
Синдром Клайнфельтера. Генетическое заболевание, которое встречается у новорожденных мальчиков с частотой от 1:300 до 1:1000. Генетической особенностью этого синдрома является разнообразие цитогенетических вариантов и их сочетаний (мозаицизм). Наиболее типичным вариантом заболевания является дополнительная Х-хромосома (47ХХУ).
Классическими клиническими симптомами синдрома Клайнфельтера является высокий рост, гинекомастия, уменьшение тестикул. К моменту начала пубертата костный возраст соответствует паспортному, но позже дифференциация костей задерживается из-за недостаточной секреции тестостерона. Рост конечностей продолжается до 18–20 лет, что и приводит к высокорослости и формированию евнухоидных пропорций тела (длинные конечности, относительно укороченное туловище, слабое развитие скелетной мускулатуры, отложение подкожно-жировой клетчатки по женскому типу, голос высокий, оволосение лица и подмышек скудные). Нарушение развития яичек выявляется в пубертатном периоде. Тестикулы увеличиваются незначительно (не более 8 мл), имеют плотную консистенцию. Количество клеток Лейдига может быть нормальным, но с возрастом уменьшается. Герминативный эпителий атрофирован, клеток Сертоли мало, это обуславливает формирование в пубертатном периоде гипергонадотропного гипоганадизма. Лишняя Х-хромосома обусловливает различные нарушения психики. Больные очень внушаемы, вялы, апатичны, безынициативны, у них часто отмечается умственная отсталость (обычно дебильность). Нередко возникают параноидные, галлюцинаторно-параноидные, депрессивные психозы и навязчивые состояния, иногда наблюдаются антисоциальное поведение и алкоголизм.
Единственным методом лечения является назначение заместительной терапии препаратами тестостерона. Данная терапия у таких пациентов проводится пожизненно. Начинать заместительную терапию следует с 13–14 лет, чтобы предотвратить появление симптомов и тяжелых последствий недостатка тестостерона, таких, например, как остеопороз. Гормональная терапия предотвращает развитие евнухоидизма, улучшает адаптацию и повышает интеллект больного. Лечение бесплодия при этом синдроме не разработано.
Cиндром Марфана относят к наследственным болезням соединительной ткани (аутосомно-доминантный тип наследования с полной пенетрантностью), когда нарушается синтез коллагена и эластина из-за повреждения гена FBN1 15-й пары хромосом. Ген FBN1 отвечает за продукцию фибриллина — белка, являющегося важным компонентом соединительной ткани, формирующим ее эластичность и сократимость. Фибриллина много в стенке аорты, связочном аппарате различных органов. При синдроме Марфана чаще всего поражается восходящая часть аорты, что нередко является причиной внезапной смерти взрослых от разрыва аорты, когда они даже не подозревали о своей болезни. Частота встречаемости синдрома Марфана 1:5000–50000 человек.
Внешний вид больных с синдромом Марфана очень характерен: высокий рост с относительно коротким туловищем, длинными паукообразными пальцами (арахнодактилия), «птичье лицо» (большой нос и мало выраженный подбородок), кифосколиоз, переразгибание в суставах, патология опорно-двигательного аппарата, чрезмерная растяжимость кожи. Могут отмечаться различные нарушения зрения (подвывих хрусталика, миопия и сходящееся косоглазие). Нарушения сердечно-сосудистой системы включают поражение клапанного аппарата сердца и аневризму аорты. Из-за высокого роста некоторые становятся спортсменами, что чревато тяжелыми сосудистыми осложнениями.
Для этого синдрома характерен избыточный выброс адреналина, который приводит к постоянному нервному возбуждению и гиперактивности. Она-то часто и выливается в неординарные способности. Поэтому нередко эту болезнь называют «синдромом гениев»; она может протекать как ярко, так и скрыто.
На сегодняшний день установлено два типа синдрома Марфана: с ярко выраженными проявлениями и с симптомами, которые внешне проявляются слабо. Второй случай более опасен, т. к. его сложно диагностировать. Японскими учеными в 2008 г. было установлено, что второй тип этого синдрома развивается из-за аномалии гена TGFBR-2, расположенного в 3-й паре хромосом. Считается, что в его функции также входит сдерживание развития злокачественных опухолей [8].
Гомоцистинурия — наследственное заболевание, связанное с дефицитом фермента, вызванного избыточным содержанием гомоцистеина (промежуточного вещества, образующегося в ходе синтеза аминокислоты цистеина) в крови и наличием гомоцистина (окисленной формы цистеина) в моче. Встречается с частотой 1:50 000–250 000.
Тип наследования — аутосомно-рецессивный. Ген локализован на 21q22.3. Заболевание проявляется не сразу, но имеет прогрессирующий характер. Больные имеют высокий рост и строение, напоминающее синдром Марфана (длинные тонкие конечности, удлинение пальцев кистей и стоп, искривление позвоночника). Для них характерны поражения глаз в виде подвывиха хрусталика. Поражение сердечно-сосудистой системы с развитием тромбоэмболии.
Диагноз подтверждается обнаружением большого количества в крови и моче аминокислоты метионина и вещества гомоцистеина и значительного снижения в крови аминокислоты цистеина. В процессе лечения человек должен придерживаться строгой диеты с низким содержанием метионина.
Болезнь Пайла это семейная множественная метафизарная дисплазия с аутосомно-рецессивным типом наследования. Характеризуется высокорослостью с рождения, преимущественно за счет непропорционального удлинения нижних конечностей. Типичны ограничение разгибания в локтевых суставах, деформации коленных суставов, сколиоз, мышечная слабость, артралгия, склонность к переломам длинных трубчатых костей. Утолщены позвонки, ребра, кости таза. Резкие изменения имеют место в метафизах плечевых и бедренных костей. У больных своеобразное лицо с широким плоским носом, гипертелоризмом, прогнатией, брахиоцефалией. Часто наблюдается атрофия зрительного нерва, снижение слуха.
Преждевременное половое развитие у детей раннего возраста
Появление вторичных половых признаков у девочек до 8 лет и у мальчиков до 9 лет характеризуется как преждевременное половое развитие (ППР). Эти больные могут быть высокими для своего возраста, но во взрослом состоянии они остаются низкорослыми, так как у них рано закрываются зоны роста и рост прекращается. При ППР пубертат наступает рано, но, как и при естественном течении, происходит ускорение соматического роста. Повышение секреции половых стероидов, главным образом эстрогенов, играет решающую роль в стимуляции СТГ-секреции у детей обоего пола. Эффекты андрогенов опосредованы их периферической конверсией в эстрогены.
Повышение секреции стероидов гонадами может быть связано с поражением в одном из звеньев в системе гипоталамус/гипофиз/гонады/надпочечники. Истинная форма ППР обусловлена импульсной секрецией гипоталамического пульсового генератора — лютеинизирующего рилизинг-гормона (ЛГ-РГ), который повышает секрецию гонадотропных гормонов (ГТГ). У подавляющего числа детей с истинным ППР выявляются нарушения ЦНС. Наиболее частыми являются посттравматические, воспалительные или врожденные изменения ЦНС, приводящие к повышению внутричерепного давления. Опухоли и доброкачественные новообразования ЦНС в последнее время стали чаще диагностировать в связи с проведением КТ и МРТ головного мозга. Опухоли ЦНС, сопровождающиеся ППР, чаще локализуются в области заднего гипоталамуса, дна третьего желудочка, серого бугра.
Ложные формы преждевременного полового развития обусловлены преждевременной секрецией половых гормонов половыми железами или надпочечниками. Причинами могут быть гормонально активные опухоли или врожденная дисфункция коры надпочечников (ВДКН). К этой группе относятся также опухоли, секретирующие хорионический гонадотропин: хорионэпителиомы, гепатомы, тератомы.
Наиболее частой причиной ложного ППР является ВДКН, приводящая к повышению уровня надпочечниковых андрогенов, вследствие ферментативного дефекта синтеза кортизола. Заболевание обусловлено мутациями в генах, кодирующих эти ферменты, — CY21, CY11B1. Стероидсекретирующие опухоли гонад — редкая причина ППР у детей. У мальчиков среди гормонально активных опухолей чаще встречаются лейдигомы и сертолиомы. У девочек — выявляют гранулезоклеточные опухоли яичников.
У детей с ППР скорость роста составляет 10–15 см в год, что типично для пубертатного «ростового скачка». Причем это ускорение предшествует 6–12 месяцам до появления вторичных половых признаков. Одновременно ранняя избыточная секреция половых стероидов способствует преждевременному закрытию зон роста [3].
Итак, при проведении дифференциальной диагностики высокорослости следует учитывать особенности клиники, сроки манифестации, интенсивность и характер прогрессирования вторичных половых признаков, особенности стероидной секреции. Целью диагностического поиска у пациентов с высокорослостью является прежде всего выявление характера ускорения роста, имеющего либо конституциональную особенность, либо органическую. Знание причины высокорослости в конечном итоге определяет терапевтическую тактику.
При сборе анамнеза следует обратить внимание на рост родителей и их родственников. Нужно оценить половое развитие по шкале Таннер, обратить внимание на возможность истинной гинекомастии с задержкой пубертата. В плане обследования включить определение костного возраста, компьютерную и магнитно-резонансную томографию ЦНС. Обязательно провести офтальмологическое обследование (осмотр глазного дна), ультразвуковое исследование органов малого таза для оценки гонад. Определение кариотипа показано при подозрении на генетические синдромы, протекающие с высокорослостью. Определенную ценность представляет определение уровня ЛГ и ФСГ, которые резко повышаются при тестикулярной или оварильной недостаточности. Лечение органической высокорослости зависит от причины заболевания.
Литература
В. В. Смирнов, доктор медицинских наук, профессор
О. Ф. Выхристюк, доктор медицинских наук, профессор
А. Е. Гаврилова
Д. Е. Березина
ГБОУ ВПО РНИМУ им. Н. И. Пирогова Минздравсоцразвития России, Москва