Слабый дискариоз что это такое
Что такое дисплазия шейки матки? Причины возникновения, диагностику и методы лечения разберем в статье доктора Игнатенко Т. А., гинеколога со стажем в 13 лет.
Определение болезни. Причины заболевания
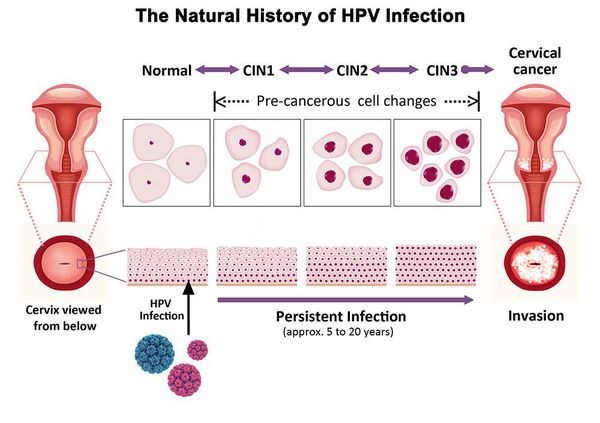
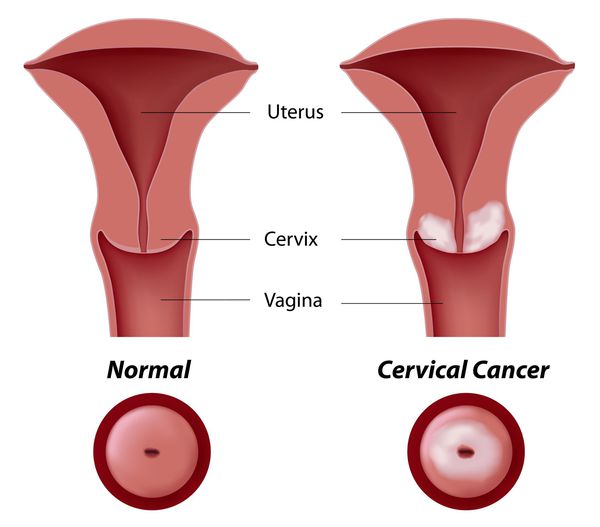
Дисплазия шейки матки, или цервикальная интраэпителиальная неоплазия (ЦИН), или Cervical Intraepithelial neoplasia (CIN) — это патологический процесс, при котором в толще клеток, покрывающих шейку матки, появляются клетки с различной степенью атипии (неправильного строения, размера, формы).
Основной фактор развития дисплазии и рака шейки матки — папилломавирусная инфекция (ПВИ), причем длительное персистирование именно ВПЧ высокого канцерогенного риска. У женщин с риском развития цервикальной неоплазии распространенность онкогенных типов ВПЧ чрезвычайно велика. ВПЧ становится причиной CIN 2-3 и рака шейки матки в 91,8% и 94,5% случаев соответственно. [1]
Риск цервикальной CIN 2 особенно высок у женщин, которые до этого имели опыт пересадки органов, у них выявлена ВИЧ-инфекция или они принимают иммунодепрессанты. [2]
Кроме того, была выявлена связь между пассивным курением среди некурящих и повышенным риском возникновения CIN 1. [3]
Симптомы дисплазии шейки матки
Дисплазия шейки матки, как правило, имеет бессимптомное течение, поэтому пациентки не предъявляют никаких специфических жалоб.
Патогенез дисплазии шейки матки
Критический фактор развития цервикальной интраэпителиальной неоплазии — инфицирование вирусом папилломы человека. Во многих случаях цервикальная интраэпителиальная неоплазия легкой степени отражает временную реакцию организма на папиломавирусную инфекцию и без лечения исчезает в течение полугода-года наблюдения. При цервикальной интраэпителиальной неоплазии умеренной и тяжелой степени высока вероятность встраивания вируса папилломы человека в клеточный геном. Инфицированные клетки начинают продуцировать вирусные белки E6 и Е7, которые продлевают жизнь клетки, сохраняя ее способность к неограниченному делению. Неизбежно формирующиеся на этом фоне мутации клеток ведут к формированию предрака (дисплазии) и рака шейки матки, влагалища и вульвы.
Онкогенные белки ВПЧ (Е6, Е7) взаимодействуют с регуляторными белками клеток шейки матки, приводя к повышению активности онкомаркера p16INK4A, что свидетельствует о неконтролируемом размножении клеток шейки матки. Таким образом, сверхэкспрессия p16INK4A, определяемая в материале шейки матки, который получают при биопсии, является биомаркером интеграции вируса папилломы человека высокого риска в геном и трансформации эпителиальных клеток под действием вируса, что делает эту информацию полезной при оценке прогноза развития предраковых и злокачественных поражений, связанных с инфицированием генитального тракта вирусом папилломы человека. [5]
Классификация и стадии развития дисплазии шейки матки
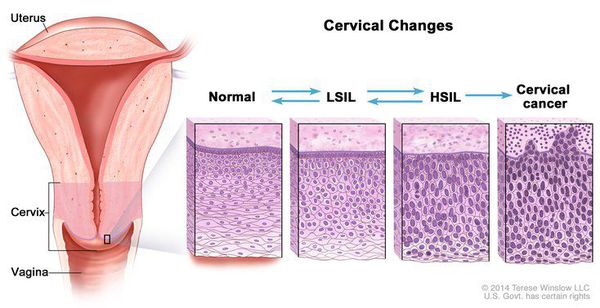
Для постановки цитологического диагноза (по результатам цитологического исследования соскобов шейки матки и цервикального канала с окрашиванием по Папаниколау (Рар-тест) или жидкостной цитологии) используется классификация Бетесда (The Bethesda System, 2014), основанная на термине SIL (Squamous Intraepithelial Lesion) – плоскоклеточное интраэпителиальное поражение. [10]
Выделяют три вида результатов соскобов с поверхности шейки матки (экзоцервикса):
Классификация Папаниколау
Существуют также гистологические классификации для оценки материала, полученного при биопсии.
По классификации R. M. Richart (1968) в зависимости от глубины поражения поверхностного клеточного слоя шейки матки выделяют:
В приведенной ниже таблице даны соотношения классификаций предраковых поражений шейки матки. [9]
Осложнения дисплазии шейки матки
Основное и самое опасное осложнение цервикальной интраэпителиальной неоплазии заключается в развитии рака шейки матки, любой случай развития которого — результат упущенных возможностей диагностики и лечения дисплазии шейки матки. [7]
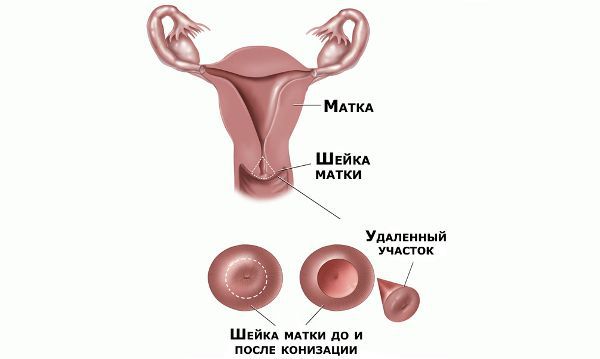
Проводились длительные, систематические исследования риска рака шейки матки у женщин с диагнозом цервикальной интраэпителиальной неоплазии 3 степени (CIN3) по сравнению с женщинами, у которых были нормальные цитологические результаты. Согласно полученным данным, долгосрочный относительный риск развития рака шейки матки зависит от различных гистологических типов CIN3 и выше всего он для аденокарциномы in situ. Даже через 25 и более лет после конизации (хирургического иссечения патологических тканей шейки матки) риск злокачественного перерождения клеток был значительным. [4]
Диагностика дисплазии шейки матки
Для ранней диагностики предраковых поражений шейки матки во многих странах мира существует система цервикального скрининга.
В России данная система включает последовательность действий:
При кольпоскопии должна быть тщательно оценена зона трансформации (переходная зона стыка двух видов покровного эпителия шейки матки).
Влагалищная часть шейки матки (экзоцервикс) покрыта многослойным плоским эпителием. В канале шейки матки (цервикальном канале, эндоцервиксе) — цилиндрический эпителий. Место перехода цилиндрического эпителия цервикального канала в многослойный плоский эпителий поверхности шейки матки носит название зоны трансформации. Эта область имеет большое клиническое значение, поскольку именно в ней возникает более 80% случаев дисплазии и рака шейки матки.
Лечение дисплазии шейки матки
Динамическому наблюдению подлежат молодые пациентки (до 35 лет) с LSIL (ВПЧ, ЦИН 1, ЦИН 2, если при биопсии не обнаружен белок р16, являющийся признаком проникновения ВПЧ высокого риска в геном и трансформации опухолевых клеток под действием вируса). Наблюдать возможно пациенток только с 1 и 2 кольпоскопическим типом зоны трансформации.
Контрольные осмотры, цитологическое и ВПЧ-тестирование показаны через 6 и 12 месяцев после первичного обнаружения патологии. При выявлении HSIL (ЦИН 2 c обнаружением белка р16 при биопсии, ЦИН 3) неизбежно хирургическое лечение в виде абляции («прижигания») или эксцизии (удаления) поврежденной ткани. Для абляции используют электро-/радио-, крио- и лазерные воздействия. Эксцизия возможна электро-/радиоволновая или ножевая.
Немаловажно, что при выявлении по кольпоскопии 3 типа зоны трансформации на фоне положительного РАР-теста гинеколог обязан провести выскабливание слизистой канала шейки матки и/или широкую эксцизионную биопсию (конизацию шейки матки) для исключения опухолевого процесса, потенциально располагающегося вне зоны кольпоскопического обзора. Немаловажно наблюдение после операции через 6 и 12 месяцев с выполнением цитологического соскоба и ВПЧ-теста.
Следует отметить, что процедура хирургического иссечения патологических тканей на шейке матки увеличивает риск преждевременных родов. А сама по себе цервикальная интраэпителиальная неоплазия первой степени на течении беременности и родов никак не отражается и зачастую опасности не представляет. [12]
Средний возраст женщин, когда может потребоваться хирургическая коррекция цервикальной внутриэпителиальной неоплазии — около 30 лет. Хирургическое лечение нередко ассоциировано с неблагоприятным течением последующей беременности. Частота и тяжесть неблагоприятных осложнений возрастают с увеличением глубины иссекаемых тканей. [13]
Прогноз. Профилактика
При своевременном выявлении и лечении дисплазии шейки матки прогноз благоприятный. Основным фактором развития и прогрессирования дисплазии шейки матки является длительное инфицирование канцерогенными типами ВПЧ. Для предупреждения заражения ВПЧ существуют профилактические вакцины «Церварикс» (защита от 16, 18 типов ВПЧ), «Гардасил» (профилактика инфицирования 6, 11, 16, 18 типами вируса), в декабре 2014 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов одобрило использование вакцины «Гардасил9», защищающей от инфицирования 9 типами ВПЧ (6, 11, 16, 18, 31, 33, 45, 52, 58). Однако на российском рынке данный продукт ещё не доступен. «Церварикс» зарегистрирована для вакцинации женщин от 10 до 25 лет; «Гардасил» показана к применению детям и подросткам в возрасте от 9 до 15 лет и женщинам от 16 до 45 лет.
Дополнительными факторами риска прогрессирования ПВИ с формированием предраковой патологии являются:
Устранение и профилактика данных факторов способны снизить вероятность развития предраковой патологии шейки матки.
Рак шейки матки поражает преимущественно женщин репродуктивного возраста. Скрининг является важной стратегией вторичной профилактики. Длительный процесс канцерогенной трансформации от появления в организме вируса папилломы человека (ВПЧ) до инвазивного рака дает широкие возможности для выявления заболевания на стадии, когда лечение высокоэффективно. Подходящими скрининговыми тестами в мире признаны цитологическое исследование, визуальный осмотр после применения уксусной кислоты и тесты на выявление ВПЧ. Всемирная организация здравоохранения рекомендует проводить скрининг женщин по крайней мере один раз в жизни в возрасте от 30 до 49 лет. [14]
Согласно приказу Министерства здравоохранения РФ от 03.02.2015. N36ан «Об утверждении порядка проведения диспансеризации определенных групп взрослого населения», осмотр со взятием мазка (соскоба) с поверхности шейки матки и цервикального канала на цитологическое исследование производится 1 раза в 3 года для женщин в возрасте от 21 года до 69 лет включительно.
Дисплазия шейки матки и влагалища — патологии, которые молчат
» data-image-caption=»» data-medium-file=»https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2017/10/Displaziya-sheyki-matki.png?fit=450%2C300&ssl=1″ data-large-file=»https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2017/10/Displaziya-sheyki-matki.png?fit=824%2C550&ssl=1″ />
При этом заболевании на слизистой нижней части матки и влагалища образуются участки измененных клеток плоского эпителия (покрывающего слоя). Обычно дисплазия поражает вагинальную область и шейку матки одновременно, что осложняет ситуацию. Дисплазию эпителия относят к предраковым патологиям.
Что такое дисплазия
В интернете эту болезнь часто описывают, как аномальный рост клеток. На самом деле, патология гораздо серьезнее, чем это примитивное описание. Дисплазию эпителия ВОЗ характеризует как комплекс нарушений, включающий:
Дисплазия шейки матки и влагалища
» data-image-caption=»» data-medium-file=»https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2017/10/Displaziya-sheyki-matki.png?fit=450%2C300&ssl=1″ data-large-file=»https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2017/10/Displaziya-sheyki-matki.png?fit=824%2C550&ssl=1″ loading=»lazy» src=»https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2017/10/Displaziya-sheyki-matki.png?resize=896%2C598″ alt=»Дисплазия» width=»896″ height=»598″ srcset=»https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2017/10/Displaziya-sheyki-matki.png?w=896&ssl=1 896w, https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2017/10/Displaziya-sheyki-matki.png?resize=450%2C300&ssl=1 450w, https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2017/10/Displaziya-sheyki-matki.png?resize=824%2C550&ssl=1 824w, https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2017/10/Displaziya-sheyki-matki.png?resize=768%2C513&ssl=1 768w» sizes=»(max-width: 896px) 100vw, 896px» data-recalc-dims=»1″ />
Дисплазия — это не только клеточная атипия, это отклонения во всем тканевом комплексе.
Из-за бессимптомности заболевания на первых стадиях, лечение дисплазии влагалища часто начинается поздно, когда патологический процесс охватывает большую часть площади слизистой шейки матки и влагалища. Диагностируется ранняя дисплазия влагалища обычно на плановом приеме у гинеколога или во время осмотра, связанного с другой патологией.
Причины развития дисплазии влагалища
Развитие дисплазии ускоряют:
В группе риска женщины с вредными привычками — курящие, употребляющие фастфуд и алкоголь и проживающие в районах с плохим экологическим профилем.
Причины дисплазии шейки матки
Самая частая причина диспластических изменений шейки – инфицирование папилломавирусом. Типы ВПЧ 16 и 18 обнаруживаются в 98 % случаев дисплазии.
Заболевание провоцируют:
При дисплазии нарушается структура эпителия, а слизистая не выполняет защитные функции. При выраженных диспластических изменениях женщину направляют на консультацию к онкологу.
Стадии развития дисплазии
Диспластический процесс — продолжение гиперплазии — увеличения количества клеток, вызванного хроническим воспалением и перерождением. Часто к гиперплазии и дисплазии присоединяется атрофия (отмирание) тканей, так как эти процессы имеют общие генетические механизмы.
Различают три степени дисплазии:
Определяющий критерий степени дисплазии — выраженность клеточной атипии. Чем тяжелее степень, тем больше размер, гиперхромность и полиморфизм клеточных ядер. Дисплазия эпителия может регрессировать (обратный процесс), быть стабильной или прогрессировать. Как быстро пойдет процесс озлокачествления зависит от степени выраженности и длительности заболевания. Чем значительнее дисплазия, тем меньше вероятность регрессии.
Дисплазия тяжелой степени расценивается гинекологами как облигатный предрак, гарантирующий развитие рака. Поэтому больные облигатным предраком ставятся на учет к онкологу.
Симптомы дисплазии влагалища
По мере развития патологии появляются:
При тяжелой дисплазии возникают боли в крестце, отеки ног. Во время ходьбы ощущается дискомфорт в области влагалища.
Гинеколог проводя осмотр с помощью кольпоскопа (оптического прибора) видит изменения слизистой оболочки влагалища в виде выступающих красноватых или светлых пятен с неровными очертаниями. Дисплазийные участки бывают большими и затрагивают шейку матки. Для уточнения диагноза, слизистую смазывают растворами уксуса или Люголя (расширенная кольпоскопия). При запущенной дисплазии видны мозаичность слизистой и сосочковые разрастания.
Окончательный диагноз ставится после проведения биопсии подозрительных участков, при которой гинеколог берет часть клеток на анализ.
Симптомы дисплазии шейки матки
Для подтверждения диагноза проводится кольпоскопия со взятием мазка из шейки и цервикального канала на гистологическое и цитологическое обследование. При дисплазии на шейке виден измененный участок, а в шеечной слизи обнаруживаются диспластичные клетки.
Как вылечить дисплазию влагалища
Из-за термина «предраковое состояние» пациентки, столкнувшись с дисплазией влагалища или шейки матки, погружаются в депрессию. Но на деле все не так страшно!
Лечение зависит от степени дисплазии:
Лечение дисплазии шейки матки
Лечение зависит от тяжести дисплазии. При поражении слизистой первой степени применяют выжидательную тактику, особенно у нерожавших. Каждые полгода проводится плановое обследование, и, если заболевание не прогрессирует, рекомендуется профилактическое посещение гинеколога.
В более тяжелых случаях применяется оперативное лечение. Наиболее эффективные методы:
Для борьбы с вирусом папилломы (ВПЧ) применяют противовирусные препараты и средства для стимуляции иммунитета. Параллельно проводят лечение сопутствующих патологий.
Что нужно знать о лечении дисплазии: 5 шагов к выздоровлению
Лечение дисплазии женских органов, вопреки распространенным заблуждениям, эффективно и безопасно, при этом женщина получает возможность предотвратить онкологию и сохранить нормальную сексуальную активность
Профилактика онкологических заболеваний влагалища и шейки матки
Профилактика болезни заключается в своевременном лечении ИППП (половых инфекций), воспалений и гормональных нарушений. Девочкам рекомендуется вакцинация против вируса папилломы вакциной Гардасил.
Где лечат дисплазию влагалища и шейки матки в СПБ
Лечение дисплазии требует серьезного подхода, так как болезнь считается опасным предраковым состоянием. Гинекологи медицинского центра Диана в Санкт-Петербурге обладают многолетним опытом лечения дисплазии эпителия, что позволило нам разработать эффективный и безопасный подход к лечению этой патологии.
Типичные признаки дисплазии шейки матки
Дисплазия шейки матки — болезнь, которая имеет несколько стадий и почти всегда приводит к раку шейки матки. Только первая стадия у молодых женщин, которая обозначается латинскими буквами LSIL, может пройти сама по себе, во всех остальных случаях пациентке требуется наблюдение, а иногда и оперативное лечение.
Дисплазия — состояние, при котором клетки шейки матки изменили свое строение. Поэтому основной и иногда единственный симптом — плохие результаты анализа на онкоцитологию.
Лечение прижиганием или замораживанием актуально только на ранних стадиях, потом нужно удалять часть органа, чтобы не пропустить и не «запечатать» атипию.
Симптомы дисплазии шейки матки
К сожалению, большинство женщин вообще не испытывают никаких симптомов при дисплазии шейки матки, особенно на ранних стадиях. Могут возникать следующие признаки, характерные в целом для гинекологических патологий:
Но все эти симптомы неспецифичны, только анализ дает возможность поставить диагноз. Признак дисплазии — атипичные изменения в строении клеток шейки матки.
Признаки дисплазии шейки матки
Основа для постановки диагноза — лабораторное исследование мазка. Вот что могут увидеть специалисты, изучая материал:
Во время кольпоскопического обследования врач может заметить следующие изменения на шейке матки:
Иногда требуется биопсия, чтобы точно определить, нет ли у женщины дисплазии. Например, анализ на цитологию хороший, но врач видит какие-то изменения на шейке. Так как любой анализ имеет погрешности, женщине могут предложить биопсию сомнительного участка. Чтобы точно знать, что вашему здоровью ничего не угрожает и что с шейкой матки у вас все в порядке, обратитесь в клинику Dr. AkNer.
Главные знания о дисплазии шейки матки
В связи с развитием новых методов диагностики и лечения предраковых и раковых заболеваний шейки матки (ШМ) уровень смертности больных злокачественными новообразованиями данной локализации в последнее время значительно снизился практически во всех странах мира. Лечение предраковых состояний и начальных стадий злокачественного процесса дает благоприятный прогностический эффект: улучшается общее состояние и здоровье больных, увеличивается продолжительность их жизни. Однако среди врачей существует немало разногласий и ошибочных мнений по поводу диагностики и лечения некоторых предраковых состояний ШМ и влагалища.
Для успешного лечения заболеваний ШМ очень важно определить вид и причину заболевания, выбрать необходимый метод лечения с учетом состояния репродуктивной системы женщины, возраста, ее желания сохранить фертильность, а также необходимы профессиональная подготовка и определенные навыки врача, наличие соответствующего оборудования в лечебном учреждении.
Понятие дисплазии. Виды дисплазий
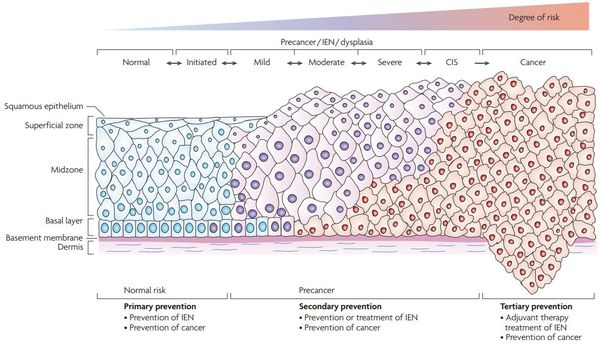
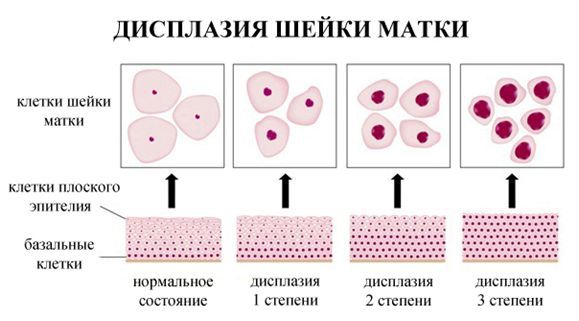
Дисплазия – это нарушение пролиферации и дифференцировки малодифференцированных исходных клеток с развитием клеточной и ядерной атипии (клеточный полиморфизм, увеличение размеров и изменение формы ядер, их гиперхромия, повышение количества митозов, появление патологических митозов) и нарушение гистоархитектоники (потеря полярности расположения эпителия, а также черт, характерных для данной ткани). Именно поэтому дисплазию также называют дискариозом. Однако эти изменения не распространяются за пределы базальной мембраны. 
Классификация дисплазий характеризует глубину поражения многослойного плоского эпителия.
Слабо выраженная дисплазия (легкая) – в пределах 1/3 толщи многослойного плоского эпителия – может сочетаться с отеком и вакуолизацией клеток промежуточного слоя.
Умеренно выраженная дисплазия (средняя) – от 1/3 до 2/3 толщи – кроме вышеуказанных симптомов, наблюдается нарушение полярности расположения эпителия.
Выраженная дисплазия (тяжелая) – поражение всей толщи – деление многослойного плоского эпителия на слои отсутствует, клетки базального и парабазального типов с явлениями выраженного клеточного и ядерного атипизма.
Симптоматика и диагностика дисплазий
В большинстве случаев дисплазии протекают бессимптомно. При инфекционном процессе во влагалище предраковые заболевания ШМ могут сопровождаться увеличением количества влагалищных выделений в виде слизи или кровянистой «мазни», особенно после травм гигиеническими тампонами, наконечниками для спринцевания, после коитуса. И при этом женщина очень редко испытывает боль или дискомфорт в малом тазу.
Цитологическое исследование мазков
Джон Вильямс в 80-х годах XIX века и Т.С. Коллен в 1900 г. высказали предположение, что предраковые состояния ШМ предшествуют злокачественному процессу, однако идею о том, что инвазивный рак ШМ развивается на основе предраковых состояний эпителия, сформулировал Курман только в 1993 г.
Специфическую медицинскую терминологию для цитологических мазков разработали ученые Папаниколау и Траут в 1954 г. (PAP – smear test). Цитологическое исследование позволило существенно снизить уровень развития рака ШМ, особенно в развитых странах. Классификация цитологического исследования шеечных мазков по Папаниколау включает пять классов. Первый международный конгресс эксфолиативной цитологии, состоявшийся в начале 60-х годов прошлого века, положил начало цитологическим обследованиям женщин в повседневной практике врачей.
В 1978 г. была принята новая терминология в классификации патологии эпителия ШМ и влагалища. Термин «дисплазия» был заменен термином «неоплазия», цервикальную интраэпителиальную неоплазию 1, 2 и 3-й степени (CIN 1, 2, 3) не считали злокачественными процессами ШМ.
В 1988 г. была создана системная классификация, которой с 1991 г. пользуются врачи большинства развитых стран. В 2001 г. она была пересмотрена и дополнена, и сейчас этой системой классификации цитологических мазков руководствуются медицинские учреждения и лаборатории многих стран мира.
Рак ШМ – это чаще всего плоскоклеточный эпителиальный рак, однако классификация Bethesda включает описание изменений и для железистого эпителия ШМ, на фоне которого развиваются аденокарциномы, а также рак железистого эпителия эндометрия.
Несмотря на наличие современной цитологической классификации фоновых, предраковых и раковых состояний ШМ, улучшить качество диагностики, а также ведение больных в настоящее время почти не удается. В первую очередь, это происходит из-за несерьезного отношения к Bethesda system многих практикующих врачей и персонала лабораторий, которые наряду с новой терминологией пользуются старой в виде дополнения, что, в свою очередь, порождает неточность в постановке диагноза.
Факторы риска развития предраковых и раковых состояний ШМ:
Существуют и другие факторы риска, а также ряд предположений, которые требуют дальнейшего исследования.
По данным Национальной программы США по раннему выявлению рака молочной железы и ШМ, отклонения от нормы в цитологических мазках встречаются в 3,8% случаев (легкая дисплазия – в 2,9%, умеренная и тяжелая – в 0,8%, сквамозная карцинома – в 0,1%).
Гормональная терапия и риск развития предраковых и раковых состояний ШМ
Комбинированные оральные контрацептивы (КОК)
Существует связь между длительностью приема КОК (более 5 лет) и частотой возникновения рака ШМ. Многие исследователи столкнулись с тем, что у лиц, принимающих гормональные контрацептивы, есть несколько дополнительных факторов риска возникновения предраковых и раковых состояний ШМ: такие женщины ведут более активную половую жизнь, чаще меняют партнеров, являются носителями возбудителей, передающихся половым путем, курят. Если эти факторы не принимать во внимание, то можно предположить, что КОК увеличивают риск возникновения плоскоклеточной карциномы и других видов карцином в два раза.
Гормональные контрацептивы, содержащие только прогестины Эти гормональные контрацептивы не повышают риск возникновения предраковых и раковых заболеваний ШМ.
Заместительная гормональная терапия (ЗГТ)
Точных данных, подтверждающих связь между комбинированными эстрогенными/прогестероновыми гормональными препаратами, которые используются в качестве ЗГТ, и риском возникновения дисплазий и рака ШМ, нет. Большинство врачей согласны с тем, что ЗГТ – вполне безопасный метод лечения, так как доза синтетических гормонов в этих препаратах в несколько раз ниже, чем в КОК.
Многие врачи считают, что женщина может продолжать прием КОК и ЗГТ при лечении дисплазий ШМ. Гормональные препараты также назначают после лечения дисплазий, плоскоклеточного эпителиального рака ШМ, но с осторожностью – после лечения аденокарцином.
Роль инфекционных возбудителей в возникновении предраковых и раковых состояний ШМ
Исследователи Великобритании и других стран мира изучали влияние ряда инфекционных возбудителей на возникновение шеечных интраэпителиальных неоплазий. Поскольку многие микроорганизмы являются причиной повреждения клеток эпителия ШМ и влагалища из-за выработки веществ, которые стимулируют пролиферацию клеток, то предполагалось, что воспалительный процесс, вызванный ими, может провоцировать перерождение предракового состояния эпителия ШМ в раковое. Однако связи между дисплазиями и наличием вируса простого герпеса, цитомегаловируса, вируса Эпштейна-Барр, герпес-вируса человека (типы 6 и 8), диплококка (возбудителя гонореи) и хламидии не найдено.
У женщин со смешанной инфекцией, вызванной ВПЧ и герпес-вирусом (тип 7), чаще наблюдались умеренные и тяжелые виды дисплазий.
Риск перехода доброкачественного процесса в злокачественный
Так как дисплазия считается предраковым состоянием ШМ, важно вовремя оценить уровень риска перехода разных видов дисплазий в рак ШМ, в первую очередь для выбора правильного лечения и тактики наблюдения пациентки.
Во многолетних исследованиях ученых многих стран, включающих длительное наблюдение (20 лет) большого количества женщин, обнаружены дисплазии разной степени. У этих пациенток проводили биопсию пораженных участков эпителия с гистологическим исследованием препарата. Данные одного из таких исследований (А. Остор и др., 1993) представлены в таблице 2.
Большинство врачей согласны с тем, что легкие дисплазии можно не лечить, однако существует немало споров по поводу лечения умеренной дисплазии. Исследования показали, что в большинстве случаев (70%) умеренные дисплазии регрессируют самопроизвольно в течение одного-двух лет, поэтому таких пациенток необходимо наблюдать в течение 6-12 мес без проведения хирургического вмешательства.
Рак ШМ считается вторым лидирующим злокачественным заболеванием у женского населения во всем мире, однако изменения в виде дисплазий разной степени в цитологических мазках находят только у 1,5-6% пациенток, у которых проводили забор цитологического мазка. Лечить и наблюдать женщин с дисплазиями нужно с учетом не только степени поражения шеечного эпителия, но и наличия индивидуальных факторов риска.
Возникновение рака ШМ
В 1995 г. доктор Майкл Поликар предложил теорию «сорняка» для объяснения патогенеза возникновения рака ШМ. Согласно этой теории, шеечная ткань (эпителий) – это почва. Семенами, которые могут вызвать злокачественное перерождение клеток, являются ВПЧ. Удобрением, помогающим росту злокачественных клеток, становятся другие факторы риска, например курение. Эта теория требует более детального исследования, так как патогенез возникновения рака ШМ до конца не изучен.
Процесс возникновения рака ШМ длится медленно, в среднем 13-15 лет – от момента появления признаков легкой дисплазии до развития карциномы, поэтому поспешное оперативное лечение больных с легкими и умеренными дисплазиями, особенно нерожавших, часто без тщательного обследования, основано на неграмотности врачей, отсутствии знаний о природе возникновения и развития предраковых и раковых состояний эпителия ШМ.
Современные методы обследования женщин
Для обследования пациенток применяют следующие методы:
Общее лечение
Существует так называемая ортомолекурная терапия дисплазий ШМ, которая включает несколько групп препаратов, влияющих на восстановление нормального эпителия ШМ. Обнаружена прямая связь между дефицитом витаминов А, C и возникновением дисплазий ШМ, поэтому очень важно рекомендовать эти витамины женщинам не только для лечения, но и для профилактики изменений эпителия ШМ. Важную роль в восстановлении эпителия играют такие витамины, как E, В6, В12, β-каротин, биофлавоноиды, особенно олигомерные проатоцианидины (ОРС), и фолиевая кислота.
Не менее важны в лечении дисплазий селен, полиненасыщенная жирная кислота омега-3, пробиотики и пребиотики, клетчатка и ряд ферментов (панкреатин, бромелайн). Доказано, что дефицит этих биологических веществ наблюдается у 67% пациенток с дисплазией. Очень важно придерживаться рационального питания, консультируясь, по возможности, с диетологом или нутрициологом. Из лекарственных растений положительно влияет на регенерацию эпителия ШМ зеленый чай.
Метод химической коагуляции (солкогин, ваготид и другие) очень популярен в ряде стран, в том числе и в Украине. Относительно удовлетворительные результаты применения этого метода могут быть получены только при лечении небольших по площади и глубине поражений в основном легкой дисплазии. При умеренной и тяжелой дисплазиях этот вид лечения не эффективен. Эффективность применения данного метода значительно выше при лечении эктопии цилиндрического эпителия, нежели дисплазий плоского эпителия.
Хирургическое лечение
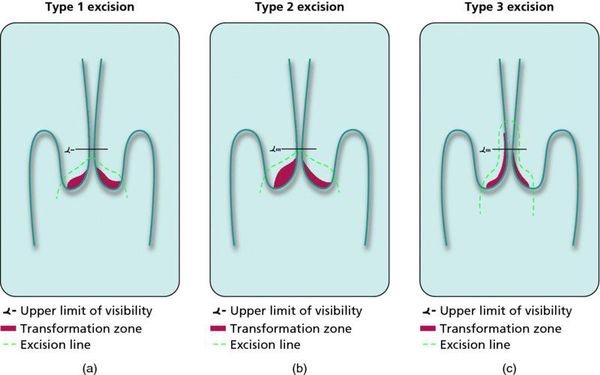
Современное хирургическое (оперативное) лечение предраковых состояний ШМ составляют пять основных методов.
Хирургическое лечение ШМ лучше проводить в первую (фолликулярную) фазу менструального цикла. В этот период под влиянием повышающегося уровня эстрогенов происходит пролиферация эпителия ШМ, что способствует процессу регенерации.
При наличии персистентной ВПЧ-инфекции лучшие результаты лечения наблюдаются при использовании лазерной вапоризации и диатермокоагуляции.
Хирургическое лечение можно проводить при местном обезболивании (лидокаин с эпинефрином) или без него, в редких случаях – при общей анестезии кратковременного действия. Седативные средства применяют по желанию пациентки и/или врача.
Диатермокоагуляция
Этот метод хирургического лечения, который в народе называют прижиганием ШМ, весьма популярен из-за технической простоты выполнения операции. Его применяют практически во всех странах мира в течение последних 25-30 лет. Электрическую эксцизию проводят двумя видами петель – электродов – маленькой или большой, в зависимости от размера и глубины поражения, с помощью электрического тока низкого напряжения, который приводит к водному дисбалансу клеток эпителия и таким образом разрушает их.
При ДЭК трудно регулировать глубину коагуляции биотканей – в этом состоит главный недостаток этого лечения. После первого контакта электрода с поверхностью ШМ на ней образуется коагуляционная пленка, которая не позволяет врачу определить, на какую глубину распространяется электрическая энергия. Если в непосредственной близости от места коагуляции располагается кровеносный или лимфатический сосуд, то высока вероятность получения глубоких некрозов тканей, расположенных по ходу сосудов, что в дальнейшем способствует образованию рубцов ШМ. Такой вид осложнений называется синдромом коагулированной ШМ и требует дополнительных хирургических методов лечения. После ДЭК чаще чем после других видов лечения возникает эндометриоз.
Криохирургия (холодовая деструкция)
Пионерами в применении жидкого азота в холодовой хирургии пораженных дисплазией участков ШМ были Крисп и Остергард в 1971 г. Как и при ДЭК, регулирование глубины промерзания тканей с высокой точностью провести невозможно. Колликвационный струп по своей структуре, в отличие от коагуляционного, довольно рыхлый, поэтому женщин дольше беспокоят выделения, которые на самом деле являются лимфореей из зияющих после отторжения струпа лимфатических сосудов. Для проведения холодовой деструкции дисплазий очень важно учитывать такой показатель, как результат эндоцервикального кюретажа (ЭЦК), который позволяет провести гистологическое исследование эпителия канала ШМ для исключения или подтверждения злокачественного процесса цилиндрического эпителия, а также для уточнения распространения интраэпителиальной неоплазии, особенно за пределы влагалищной порции ШМ внутрь шеечного канала.
Холодовая деструкция, как и ДЭК, не должна проводиться у пациенток с подтвержденным в результате ЭЦК злокачественным процессом, с железистой дисплазией цервикального канала; в этих случаях данный вид лечения не эффективен. У некоторых женщин возникает анафилактический шок как результат аллергической реакции на холод. При соблюдении правил проведения холодовой деструкции ШМ и правильного подбора больных успех лечения составляет от 88 до 94%, при лечении тяжелой дисплазии в 7,1-39% случаев патологический процесс возникает повторно.
Лазерное лечение
Лазерное хирургическое лечение ШМ развивается в двух направлениях: с использованием лазерного излучения большой мощности и низкоинтенсивного лазерного излучения, что позволяет проводить лазерную вапоризацию (выпаривание) или лазерную конизацию ШМ.
Первые СО2 лазерные вапоризации провели Дорси в 1979 г., Джордан и Коллинс в 1985 г. В те годы лазерное лечение дисплазий было одним из самых популярных методов лечения в развитых странах мира. Со временем этим методом стали пользоваться реже из-за дороговизны технического оборудования, а также из-за того, что лазерное лечение необходимо проводить в операционных условиях с применением общей анестезии. СО2-лазер – это луч невидимого инфракрасного света, для которого мишенью действия становятся клетки, содержащие большое количество воды. Они могут максимально адсорбировать энергию лазера, что и приводит к выпариванию ткани. От величины мощности излучения зависят толщина лазерного луча и его действие. Для вапоризации тканей можно применять низкоинтенсивные лучи; основные побочные эффекты при таком виде лечения – перегрев и ожог тканей. После вапоризации не остается тканевого материала для гистологического исследования. Коагулирующий эффект лазера используется также для остановки кровотечения, которое может возникнуть при проведении процедуры.
Действие лучей высокой интенсивности похоже на действие острого скальпеля и используется для лазерной конизации ШМ, сопровождается меньшим кровотечением, чем при проведении холодно-ножевой конизации. При этом виде лечения нужна хорошая иммобилизация пациентки для предупреждения серьезных повреждений соседних тканей ШМ, влагалища, а также промежности, поэтому процедуру рекомендуют проводить под общим кратковременным наркозом. При лазерном лечении сохраняются участки иссеченных тканей, которые можно исследовать гистологически.
Женщины испытывают более сильные болевые ощущения при лазерной вапоризации, чем при холодовой деструкции ШМ, легкое кровотечение может возникать на 4-10-й день после операции.
Ножевая конизация ШМ
Почти два столетия назад проведена первая попытка удаления опухоли ШМ с помощью скальпеля, которая стала началом хирургического лечения предраковых и раковых состояний ШМ. До появления ДЭК и криодеструкции этот метод был самым распространенным в лечении некоторых заболеваний ШМ, но чаще им пользовались с диагностической целью для проведения конусовидной биопсии ШМ. В настоящее время ножевое конусовидное иссечение проводят у пациенток с дисплазиями цилиндрического эпителия, аденокарциномами in situ, при больших старых разрывах ШМ и с патологическими эктропионами. Недостатками холодно-ножевой конизации ШМ являются обильное кровотечение, большая травматизация ШМ и, следовательно, длительное заживление, а также стеноз цервикального канала из-за разрушения большого количества эндоцервикальных желез.
Ампутация ШМ
Этот вид лечения представляет собой высокое конусовидное иссечение тканей ШМ и выполняется только в условиях операционной, нередко с использованием эпидуральной или внутривенной анестезии. Ножевая ампутация – это органосохраняющая операция, которая успешно применяется при начальных стадиях рака.
В 1992 г. в гинекологической клинике Московского научно-исследовательского онкологического института имени П.А. Герцена разработали операцию по удалению пораженного участка ШМ с использованием ультразвукового скальпеля по специальной методике. Частота стеноза шеечного канала при таком оперативном лечении намного ниже, чем при других видах хирургического лечения.
Показания для оперативного лечения дисплазий ШМ:
Ведение пациенток в послеоперационном периоде
Женщине, которой проведено оперативное лечение, необходимо знать, какие неприятные симптомы она может испытывать после лечения: тянущая боль внизу живота в первые дни после процедуры, влагалищные выделения с запахом или без в течение 2-4 нед. Для устранения боли применяют ибупрофен, ацетоминофен, другие обезболивающие препараты.
В течение всего периода выздоровления (минимум 4 нед) пациентка не должна поднимать тяжести, пользоваться тампонами, спринцеваться, жить половой жизнью, так как все это провоцирует травматизацию с последующим кровотечением, инфекционные процессы ШМ.
Профилактическое применение антибиотиков не обоснованно. Некоторые врачи назначают гормональные контрацептивы для искусственной задержки менструации, что якобы является профилактикой эндометриоза ШМ, однако исследования показали, что такой вид профилактики не эффективен.
Если после лечения у женщины повышается температура тела (>38 °С) и/или возникает обильное или длительное влагалищное кровотечение, и/или боль усиливается и не устраняется обезболивающими препаратами, необходимо как можно быстрее обратиться к лечащему врачу.
Нормальная гистологическая картина шеечного эпителия восстанавливается у 60% женщин через 6 нед после лечения, у 90% – через 10 нед. Цитологический мазок необходимо повторять не раньше чем через 3-4 мес после лечения, затем каждые 3-4 мес в течение года.
Процесс заживления ШМ после оперативного лечения порой длится до 6 мес, поэтому раннее кольпоскопическое или цитологическое обследование иногда приводит к ложноположительным результатам и необоснованному подозрению на наличие остаточных явлений цервикальной интраэпителиальной неоплазии.
Осложнения после хирургического лечения:
Профилактика:
Выводы
Литература
1. Brechin S., Cameron S.T., Paterson A.M. et al. Intrauterine polyps – a cause of unscheduled bleeding in women using the levonorgestrel intrauterine system. Hum Reprod 2000; 15: 650-2.
2. Casper G.R., Ostor A.G., Quinn M.A. A clinicopathologic study of glandular dysplasia of the cervix. Gynec Oncol 1997; 64 (1): 166-70.
3. Cirizano F.D. Management of pre-invasive diseade of the cervix. Semin Surg Oncol 1999; 16 (3): 222-7.
4. Crisp W.E. Cryosurgical treatment of neoplasia of uterine cervix. Obstet Gynecol 1972; 39 (4): 495-9.
5. Ferenczy A., Coutlee F., Franco E., Hankins C. Human papillomavirus and HIV coinfection and the risk of neoplasias of the lower genital tract: a review of recent developments. CMAJ 2003; 169 (5): 431-4.
6. Franco E.L., Duarte-Franco E., Ferenczy. Cervical cancer: epidemiology, prevention and the role of human papillomavirus infection. CMAJ 2001; 164 (7): 1017-25.
7. Hanna L. Women and AIDS: Cervical Intraepithelial Neoplasia. Bulletin of Experimental Treatments for AIDS, San Francisco AIDS Foundation 1996.
8. Josefson D. Mild cervical dysplasia often reverts to normal. BMJ 1999; 318: 420.
9. Lanham S., Herbert A., Basarab A., Watt P. Detection of cervical infections in colposcopy clinic patients. J Clin Micro Biol 2001; 2946-50.
10. Meijer C.J.L.M., Snijders P.J.F., van den Brude A.J.C. Screening for cervical cancer: Should we test for infection with high-resk HPV? CMAJ 2000; 163 (5): 535-8.
11. Muderspach L., Wilczynski S., Roman L. et al. A phase 1 trial of a human papillomavirus (HVP) peptide vaccine for women with high-grade cervical and vulvar intraepithelial neoplasia who are HPV 16 positive. Clinical Cancer Research 2000; 6: 3406-3416.
12. Ostor A.G. Natural history of cervical intraepithelial neoplasia: a critical review. Int J Gynecol Pathol 1993; 12 (2): 186-92.
13. Ostor A.G., Mulvany N. The pathology of cervical neoplasia. Current Opinion Obstet & Gynecol 1996; 8 (1): 69-73.
14. Parazzini F., La Vecchia C. et al. Case-control study of oestrogen replacement therapy and risk of cervical cancer. BM J 1997; 315: 85-8.
15. Pinto A.P., Crum C.P. Natural history of cervical neoplasia: defining progression and its consequence. Clin Obstet Gynecol 2000; 43 (2): 352-62.
16. Raffle A.E., Alden B., Quinn M. et al. Outcomes of screening to prevent cancer: analysis of cumulative incidence of cervical abnormality and modeling of cases and deaths prevented. BMJ 2003; 326: 901-12.
17. Sadler L., Saftlas A., Wang W. et al. Treatment for cervical intraepithelial neoplasia and risk of preterm delivery. JAMA 2004; 291: 2100-6.
18. Saha A., Maresh M. Women are often followed up too soon after treatment for cervical intraepithelial neoplasia. BMJ 1996; 312: 640.
19. Schlecht N.F., Kulaga S., Robitaille J. et al. Persistent Human Papillomavirus Infection as a Predictor of Cervical Intraepithelial Neoplasia. JAMA 2001; 286 (24): 3179-80.
20. Schwartz S.M., Daling J.R., Shera K.A. et al. Human Papillomavirus and prognosis of invasive cervical cancer: a population-based study. J Clin Oncol 2001; 19 (7): 1906-15.
21. Sellors J.W., Karwalajtys T.L., Kaczorowski J. et al. Incidence, clearance and predictors of human papillomavirus infection in women. CMAJ 2003; 168 (4): 421-5.
22. Shlay J.C., Dunn T., Byers T et al. Prediction of cervical intraepithelial Neoplasia grade 2-3 using risk assessment and human papillomavirus testing in women with atypia on Papanicolaou smears. Obstet Gynecol 2000; 96: 410-16.
23. Wright T.C. Jr., Cox J.T., Massad L.S. et al. 2001 Consensus Guidelines for the Management of Women with Cervical Cytological Abnormalities. JAMA 2002: 287 (16): 2120-9.
Cтатья была создана и впервые опубликована в проекте Health-ua.org: https://www.health-ua.org/faq/akusherstvo-ginekologiya-reproduktivnaya-medicina/926.html