можно ли лечить фиброматоз
Лечение контрактуры Дюпюитрена
Что такое контрактура Дюпюитрена
Контрактура Дюпюитрена (другое название – ладонный фиброматоз) представляет собой заболевание кистей рук невоспалительного характера. Для патологии характерно разрастание соединительной ткани, при этом нарушается сгибательная функция пальцев. В месте поражения возникают плотные узелки, которые ограничивают подвижность пальцев. При отсутствии лечения болезнь прогрессирует, что приводит к тугоподвижности и полной неподвижности поврежденных пальцев. Чаще всего контрактура поражает безымянный палец и мизинец, в некоторых случаях патология развивается на обеих руках.
Основные причины ладонного фиброматоза
На сегодняшний день не выявлено специфических причин, развития ладонного фиброматоза. Существуют факторы риска, которые определяют предрасположенность к патологии:
Заболевание в большей степени поражает мужчин, чем женщин, в возрасте 40-45 лет. С возрастом увеличивается вероятность появления контрактуры.
Клинические признаки контрактуры Дюпюитрена
Патология развивается постепенно и проявляется следующими симптомами:
На ладони возле безымянного пальца или мизинца прощупываются узелки. Они могут быть болезненными или практически не ощущаться. Это первый характерный симптом ладонного фиброматоза.
Образуются путем слияния узелков в одну полоску. Тяжи можно увидеть невооруженным глазом, они хорошо пальпируются через кожу.
Чаще всего патология захватывает безымянный палец и мизинец, которые подгибаются в сторону ладони. Чем серьезнее стадия, тем хуже разгибаются пальцы. Контрактуры мешает брать в руку мелкие предметы. При отсутствии грамотного лечения патология может привести к полной неподвижности пальцев.
Заболевание прогрессирует, поэтому крайне важно вовремя начать лечение, чтобы быстрее вернуться к полноценной жизни.
Степени заболевания
В зависимости от сложности течения и проявления клинических признаков существует четыре стадии ладонного фиброматоза:
Можно обнаружить небольшие безболезненные уплотнения под кожей ладони. При этом пациент не испытывает болезненных ощущений и дискомфорта. Пальцы свободно сгибаются и разгибаются. Патология может оставаться на этой стадии несколько лет прежде чем начнет прогрессировать. Лечение заболевания первой степени проводится без хирургического вмешательства.
Наблюдается затруднение в разгибании пальцев, дефицит разгибания составляет от 45° до 90° Проведение апоневрэктомии помогает вернуть полную подвижность пальцев и избежать дальнейших осложнений.
Нарушена подвижность пальца, дефицит разгибания – 90° до 135°. На этой стадии наиболее эффективным методом лечения является ладонная капсулотомия.
Дефицит разгибания пальца больше 136°, при этом поражаются сухожилия и суставы. Наблюдается существенное ограничение функций кисти вплоть до полной неподвижности пальцев.
Диагностика
Постановкой диагноза занимается врач ортопед-травматолог. Диагностика включает следующие этапы:
Как проходит лечение
Если отмечается затрудненное разгибание пальцев, требуется оперативное вмешательство. Какое лечение применяется:
Благодаря оперативному вмешательству можно вернуть подвижность пальцев.
Полное иссечение пораженного участка. Применяется при серьезной степени поражения. Участок апоневроза удаляется полностью, что позволяет избежать рецидива.
Методика позволяет восстановить функции сухожилий ладони. В ее основе – особая хирургическая техника, а также специальные физические упражнения. Методика подразумевает малоинвазивные воздействия на кисть, что способствует эффективному лечению и быстрому выздоровлению.
Профилактика заболевания
Если вы обнаружили первые симптомы контрактуры Дюпюитрена, чтобы не допустить развития патологического процесса, можно применять физиопроцедуры:
Врач также дополнительно назначает физические упражнения для тренировки сгибания и разгибания пальцев.
Почему стоит обратиться в Медицинский центр Елены Малышевой
В клинике работают узконаправленные специалисты, которые имеют большой практический опыт. Врачи проходят практику за рубежом, занимаются научной деятельностью, применяют новейшие методики.
В медицинском центре установлено новейшее оснащение для диагностики, есть собственная лаборатория, что позволяет быстро поставить диагноз и назначить эффективное лечение.
Пациент попадает в комфортную обстановку, где ему всегда могут предоставить качественную помощь и внимание.
Кто проводит лечение
Кандидат медицинских наук
Врач – травматолог-ортопед, кистевой хирург
Жигало Андрей Вячеславович
Специалист с 16-летним опытом.
Применяет малоинвазивные методы лечения заболеваний кисти.
Занимается научной деятельностью, разрабатывает новые методики лечения кистевых патологий.
Часто задаваемые вопросы
Отзывы наших пациентов
ОСТАВЬТЕ ЗАЯВКУ И ПОЛУЧИТЕ 50% СКИДКУ
НА ПРИЕМ ТРАВМАТОЛОГА-ОРТОПЕДА ПРИ ВЫПОЛНЕНИИ МАНИПУЛЯЦИИ
Заявка отправлена! Скоро с вами свяжется специалист и ответит на все вопросы Вернуться на главную страницу
Современное лечение десмоидной фибромы
1. Что такое десмоидная фиброма?
2. Симптомы десмоидной фибромы
3. Как диагностируют фиброматоз десмоидного типа
4. Лечение десмоидного фиброматоза
5. Прогноз при десмоидной фиброме
6. История пациента с фиброматозом десмоидного типа
7. Где за рубежом лечат десмоид?
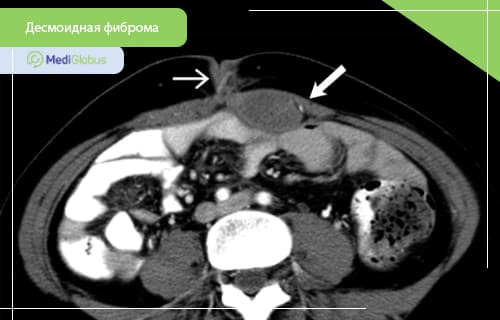
Десмоидная фиброма – это редкая доброкачественная опухоль соединительной ткани. Ежегодно болезнь встречается у 4-6 человек на миллион.
Если фиброматоз десмоидного типа мягких тканей требует хирургического лечения, рекомендуется обращаться в клиники, специализирующиеся по лечению сарком. Оба заболевания требуют высокого уровня подготовки со стороны хирурга для избежания риска рецидива.
Из этой статьи вы узнаете подробнее о симптомах и диагностике десмоидного фиброматоза, вариантах лечения за рубежом и ТОП клиниках, куда мы рекомендуем обратиться нашим пациентам.
Что такое десмоидная фиброма?
Десмоидная фиброма, также известная как десмоидный фиброматоз или фиброматоз десмоидного типа – это доброкачественная опухоль, образующаяся из фибробластов соединительной ткани. Это заболевание не является раком, так как оно не образовывает метастазы. Однако, крупные быстрорастущие фибромы могут нести опасность здоровью и жизни пациента. Десмоидная фиброма остается серьезным заболеванием, требующим лечения в специализированных медучреждениях.
Чаще всего заболевание обнаруживают у людей в возрасте от 15 до 60 лет. У женщин такие опухоли встречаются чаще, чем у мужчин.
До 10% случаев десмоидной фибросаркомы связаны с генетической предрасположенностью. В группу риска входят люди с синдромом Гарднера и семейным аденоматозным полипозом. У 89% пациентов обнаруживают мутации генов CTNNB1 и APC. Пациентов с десмоидной фибромой обычно отправляют на генетическую диагностику с целью поиска предшествующих заболеваний. К факторам риска также относятся травмы, беременность и прием оральных контрацептивов.
Оптимальный план лечения десмоидных фибром обычно требует участия мультидисциплинарных команд, в которые входят хирурги-саркоматологи, хирурги ЖКТ, онкологи и лучевые терапевты. Такие специалисты работают в иностранных онкоцентрах. Они имеют достаточный опыт хирургического лечения проблемно расположенных опухолей и знакомы с передовыми протоколами лечения фиброматоза десмоидного типа. Если вы ищете такие медцентры, обратитесь к специалистам MediGlobus, нажав на кнопку в верхней части сайта. Мы бесплатно проконсультируем вас относительно лечения за рубежом и поможем подобрать клинику, а также организовать поездку.
Симптомы десмоидной фибромы
Десмоидные опухоли могут возникнуть в любом участке тела. Обычно они образовываются внутри живота, на плечах, руках и бедрах. Распространенные места для опухолей – шрамы от кесаревого сечения или операций.
У ⅔ пациентов опухоли не вызывают боли. Такие образования менее опасные, и если они не продолжают расти, обычно не требуют хирургического вмешательства. Их могут обнаружить во время чек-апа или диагностики других заболеваний.
К симптомам, с которыми пациенты обращаются к врачам, относятся:
Боль;
Опухлость в области новообразования;
Бессонница;
Трудности при передвижении;
Кишечная непроходимость;
Гидронефроз;
Редко – перфорация кишечника.
Как диагностируют фиброматоз десмоидного типа
Ультразвуковое исследование используется для определения размера и расположения десмоидных фибром, в особенности – локализованных в передней брюшной стенке, руках и ногах.
КТ часто используется во время диагностики десмоидных фибром. Метод особенно полезен при внутрибрюшных поражениях. Опухоли, возникающие в брюшной полости, чаще всего вовлекают брыжейку, хотя могут поражаться и другие участки. КТ может предоставить важную информацию, необходимую для планирования операции, такую как расположение соседствующих сосудов и органов. Такие осложнения, как кишечная непроходимость, ишемия кишечника и гидронефроз, также легко выявляются на КТ.
Благодаря высокому качеству снимков мягких тканей МРТ отлично подходит для диагностики десмоидных фибром. Исследование часто назначают для диагностики опухолей, расположенных в области рук, ног, головы, шеи, брюшной полости и грудной стенки. МРТ также могут назначить вместо КТ пациентам с аллергией на йодированные контрастные вещества, а также детям, которым желательно снизить количество облучения.
Чтобы проверить, является ли новообразование десмоидной опухолью, врач проведет биопсию, взяв иглой небольшое количество ткани. Патологоанатом изучит клетки под микроскопом, чтобы определить, что это за опухоль. При некоторых трудно расположенных образованиях провести это исследование может быть проблематично.
Диагностика опухолей за рубежом
У 10%-62% пациентов, которые обращаются в иностранные клиники, обнаруживают неверно поставленный первичный диагноз. В случае редких заболеваний, таких как десмоидная фиброма, риск врачебной ошибки выше. Вы можете обратиться за квалифицированной консультацией иностранного онколога через международную медицинскую платформу MediGlobus. Оставьте заявку на сайте, и мы перезвоним вам в ближайшее время.
Лечение десмоидного фиброматоза
В прошлом основным методом лечения десмоидных фибром была хирургия. Современные протоколы лечения заболевания изменили подход, и сейчас практикуется более консервативный подход к терапии.
При бессимптомной десмоидной фиброме, врачи часто рекомендуют держать опухоль под активным наблюдением. В 50% случаев заболевание не прогрессирует, и пациенты могут избежать операции.
При возможности, хирург попытается удалить десмоидную фиброму во время операции. В случае, если ее удастся полностью вырезать, у болезни есть позитивный прогноз. Однако, новообразования часто формируются рядом с важными органами, сосудами или нервами. Хирургическое вмешательство в этой области может быть проблемным и опасным. Часто вместо этого врачи предлагают другие методы лечения. Однако, в каждом случае решение о необходимости проведения операции проводится индивидуально.
Резекция десмоидной фибромы обычно обширная. Хирургическое лечение внутрибрюшной десмоидной фибромы может потребовать обширной операции. Это включает в себя удаление участков кишечника, сосудистых структур и прилегающих органов брюшной полости.
Лучевая терапия – это метод лечения опухолей с помощью контролированного радиационного облучения. Современная аппаратура, которая используется в иностранных клиниках, позволяет точно доставлять лучи к опухоли, не задевая здоровые ткани. Это позволяет снизить вред от терапии и уменьшить количество побочных эффектов.
Радиотерапия используется для лечения неоперабельных десмоидных фибром, а также опухолей в стадии рецидива. Лечение назначается после операции в случаях, если новообразование не удалось полностью вырезать. Это позволяет снизить риск рецидива.
Для лечения десмоидного фиброматоза применяются различные группы препаратов:
Некоторые из этих препаратов могут вызывать серьезные побочные эффекты, поэтому их прием проводится строго под контролем лечащего врача.
Некоторые медицинские центры применяют радиочастотную абляцию для лечения десмоидных фибром. Это – минимально инвазивная процедура, которая уменьшает опухоли, используя высокие температуры.
Прогноз при десмоидной фиброме
Прогноз лечения пациентов в иностранных клиниках оптимистичный. В зависимости от размера и расположения опухоли, от 76% до 99% пациентов проживает более 5 лет.
В 20-30% случаев десмоидная фиброма рецидивирует. Среди факторов риска повторного возникновения заболевания:
Десмоидные опухоли обычно рецидивируют через 4-5 лет после операции. Они могут быть опасными и тяжелее поддаются лечению. 10-летняя выживаемость пациентов с рецидивом заболевания составляет 63%.
История пациента с десмоидной опухолью
У жителя Нью-Йорка Керта Робинсона обнаружили десмоидную фиброму на 43 году жизни. Она представляла собой болезненное образование в области шеи. Боль была такой сильной, что мужчина не мог повернуть голову или самостоятельно надеть футболку. Спустя несколько месяцев он обратился к врачам, которые провели биопсию и диагностировали десмоидный фиброматоз.
Сразу после подтверждения диагноза Керта направили к хирургу. К сожалению, опухоль выявилась неоперабельной. Из-за близкого расположения сосудов и нервов операция была бы слишком опасной. Однако, доктор рекомендовал Керту принять участь в исследовании препарата, который на тот момент еще не входил в протокол лечения десмоидной фибромы. Сейчас таргетная терапия доступна в профильных медцентрах для терапии этого заболевания. Препарат был разработан для помощи пациентам с раком почек, но его начали применять при десмоиде, когда оказалось, что эффект от лечения в 7 раз сильнее чем при стандартной терапии. В случае Керта, рост опухоли удалось полностью остановить на два года.
Мужчине удалось избежать опасного хирургического лечения и вернуться к нормальной жизни. После курса физиотерапии для восстановления полной подвижности руки и кисти, он больше не испытывает боли и снова может спокойно спать.
НЕЙРОФИБРОМАТОЗ I ТИПА. Проблемы диагностики и лечения
Каковы диагностические критерии нейрофиброматоза? Что является особенностью нейрофиброматоза и затрудняет диагностику? На чем основывается терапия нейрофиброматоза? Нейрофиброматоз I типа (классический, периферический, собственно болезнь Реклингха
Каковы диагностические критерии нейрофиброматоза?
Что является особенностью нейрофиброматоза и затрудняет диагностику?
На чем основывается терапия нейрофиброматоза?
Заболевание характеризуется выраженным клиническим полиморфизмом, прогрессирующим течением, полиорганностью поражений и высокой частотой осложнений, в том числе приводящих к летальному исходу (развитие сердечно-легочной недостаточности вследствие выраженных скелетных аномалий, злокачественное перерождение нейрофибром и др.).
Механизм развития клинических проявлений неизвестен. Существует предположение, что ген «нф 1» входит в группу генов, подавляющих рост опухолей. Снижение или отсутствие выработки продукта гена — нейрофибромина приводит к диспластической или неопластической пролиферации клеток.
Клиническая диагностика нейрофиброматоза I типа основывается на обнаружении диагностических критериев, рекомендованных Международным комитетом экспертов по нейрофиброматозу. Диагноз может быть поставлен при наличии у больного по крайней мере двух из перечисленных ниже признаков: не менее пяти пятен цвета «кофе с молоком» диаметром более 5 мм у детей препубертатного возраста и не менее шести таких пятен диаметром более 15 мм в постпубертатном периоде; две и более нейрофибромы любого типа или одна плексиформная нейрофиброма; множественные мелкие пигментные пятна типа веснушек, локализованные в крупных кожных складках (подмышечных и/или паховых); глиома зрительного нерва; два и более узелков Лиша на радужной оболочке, обнаруживаемых при исследовании с помощью щелевой лампы; дисплазия крыла клиновидной кости или врожденное истончение кортикального слоя длинных трубчатых костей с наличием псевдоартроза или без него; наличие у родственников первой степени родства нейрофиброматоза I типа по тем же критериям.
 |
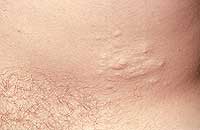
| Рисунок 1. Множественные нейрофибромы |
Особенностью заболевания является специфическая последовательность проявления симптомов в зависимости от возраста пациента, что затрудняет клиническую диагностику нейрофиброматоза I типа в раннем детском возрасте. Таким образом, с рождения или первых лет жизни могут существовать лишь некоторые признаки нейрофиброматоза I типа, такие как крупные пигментные пятна, плексиформные нейрофибромы, скелетные дисплазии. Другие симптомы могут проявиться значительно позднее (к 5–15 годам). При этом степень выраженности клинических проявлений, течение и быстрота прогрессирования нейрофиброматоза I типа у разных больных неодинаковы и колеблются в широких пределах. В настоящее время не установлено, чем обусловлены такие различия.
Нейрофибромы (дермальные, гиподермальные, плексиформные) представляют собой наиболее выраженное проявление болезни Реклингхаузена, их количество иногда достигает нескольких тысяч; плексиформные нейрофибромы могут быть гигантскими, массой более 10 кг. Эти косметические дефекты, как правило, больше всего беспокоят пациентов, даже имеющих системные заболевания. Кроме того, нейрофибромы, особенно плексиформные, связаны с повышенным риском озлокачествления (в 20% случаев, по нашим данным). При локализации в средостении, в брюшной полости, в глазнице они приводят к нарушению функций прилегающих органов. Например, в сентябре 2000 года в отделении наследственных заболеваний кожи ЦНИКВИ был консультирован больной мальчик 8 лет, прибывший из Брянской области в Москву для оперативного лечения по жизненным показаниям; гигантская плексиформная нейрофиброма располагалась в верхнем средостении, деформировала нижнюю 1/3 шеи и являлась причиной затрудненного дыхания и пароксизмальной тахиаритмии.
О развитии нейрофибром известно немногое. Время от времени растет их количество и размеры в ответ на различные стимулы, среди которых ведущее место занимают гормональная перестройка организма: пубертатный возраст, период беременности или после родов, а также перенесенные травмы или тяжелые соматические заболевания. С расширением спектра предлагаемых коммерческих медицинских и косметических услуг значительно увеличилось число обращений больных, указывающих на появление новых опухолей (нейрофибром, неврином, шванном) после ятрогенных вмешательств. Речь идет об удалении опухолей с диагностической или лечебной целью различными методами, в том числе с помощью хирургического иссечения. К ятрогенным осложнениям также приводит назначение физиотерапевтических процедур при лечении различных соматических заболеваний, коррекции скелетных нарушений (всевозможных видов сколиоза, переломов) и нервно-мышечных расстройств (очень часто массаж по различным поводам назначается детям грудного возраста, когда диагностика нейрофиброматоза I типа зачастую невозможна из-за недостаточности клинических проявлений). Но часто заболевание прогрессирует и на фоне кажущегося благополучия. Положение осложняется тем, что у врачей нет возможностей приостановить развитие болезни.
Основной задачей научных исследований представляется разработка методов патогенетического лечения нейрофиброматоза I типа, позволяющих сдерживать появление новых и рост уже имеющихся опухолей, а также предотвращать развитие осложнений.
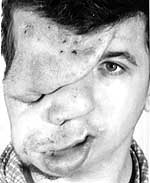 |
| Рисунок 2. Плексиформная нейрофиброма |
В настоящее время для лечения этого заболевания как за рубежом, так и в России используются методы симптоматической терапии, как, например, хирургическое удаление опухолей, коррекция кифосколиоза или лучевая терапия нейрофибром внутренних органов. Кроме того, ученые на Западе сконцентрировались на возможности этиологического лечения, то есть генной инженерии. Особенно далеко это направление продвинулось со времени открытия мутантного гена и расшифровки его первичного продукта — нейрофибромина в 1990 году; на научные изыскания, связанные с этой проблемой, ежегодно выделяются огромные средства.
Первая попытка патогенетического подхода к лечению была сделана V. Riccardi в 1987 г., когда он предложил длительное использование кетотифена (в дозе 2-4 мг в течение 1,5-3 лет) для стабилизации мембран тучных клеток, полагая, что именно дегрануляция этих клеток стимулирует рост опухолей. Однако лечение одним кетотифеном не принесло желаемых результатов: уменьшались субъективные ощущения болезненности и зуда в области нейрофибром, но какого-либо влияния на рост опухолей отмечено не было. Кроме того, при продолжительном приеме препарата наблюдалось снижение количества иммунокомпетентных клеток в периферической крови и ухудшение показателей иммунитета. Существуют различные точки зрения на роль тканевых базофилов в развитии нейрофибром. По мнению некоторых авторов, тучные клетки представляют собой эффекторные клетки противоопухолевого иммунитета. С помощью обычной и электронной микроскопии было показано, что большое количество тканевых базофилов с их активной внеклеточной дегрануляцией наблюдается только на ранней стадии развития нейрофибром. На поздней же стадии, при длительности существования нейрофибром не менее пяти лет, в клеточном матриксе опухолей тучных клеток значительно меньше, дегрануляция их преимущественно внутриклеточная и не сопровождается разрушением клеток.
На основании данных многочисленных исследований нами впервые разработана комплексная методика патогенетической терапии с использованием препаратов из разных групп лекарственных средств. Учитывая то, что клеточный состав нейрофибром в основном представлен шванновскими клетками, фибробластами, тучными клетками и лимфоцитами, а межклеточное вещество в активно растущих, особенно плексиформных, — кислыми мукополисахаридами, для лечения нейрофиброматоза I типа мы выбрали следующие препараты. Стабилизатор мембран тучных клеток, кетотифен, мы назначали по 2-4 мг короткими курсами по два месяца. Чтобы избежать осложнений, в первые две недели приема препарата использовался фенкарол по 10-25 мг три раза в день. В качестве антипролиферативного препарата применялись тигазон в дозе не менее 1 мг на килограмм массы тела или аевит до 600 000 МЕ с учетом переносимости. Также курсами применялась лидаза (мукополисахаридаза) в дозе 32-64 Ед в зависимости от возраста внутримышечно, через день, на курс 30 инъекций.
Вышеуказанные препараты использовались комплексно в различных сочетаниях или в виде монотерапии в зависимости от формы нейрофиброматоза I типа, жалоб, течения, а также возраста и пола больных. Обязательно лечение проводилось в периоды прогрессирования заболевания, то есть при появлении новых опухолей и/или росте уже имеющихся, как правило сопровождающемся зудом или ощущением болезненности в их проекции, а также с целью предотвращения активизации заболевания во время планируемых операций на опухолях. Повторные курсы лечения с интервалами в два месяца назначались при наличии у больных крупных плексиформных нейрофибром или болезненных неврином. При этом, как правило, курсовое применение тигазона (или аевита) в виде монотерапии чередовалось с сочетанным применением стабилизаторов мембран тучных клеток и инъекций лидазы. Предлагаемое лечение хорошо переносилось больными.
В единичных случаях наблюдались незначительное повышение уровней печеночных показателей в повторных биохимических анализах крови при приеме тигазона (у одной больной) и очаговая аллергическая реакция на введение лидазы (у двух пациентов из 60), которая проявлялась воспалением тканей в месте инъекций. В этих случаях препараты отменялись, назначалось симптоматическое лечение.
В результате проводимой терапии нам, как правило, удавалось приостановить прогрессирование заболевания; наблюдалось уменьшение (сморщивание) нейрофибром и неврином вплоть до полного исчезновения некоторых опухолей (особенно активно уменьшаются плексиформные нейрофибромы — на ранней стадии своего развития — и невриномы).
Полученные результаты удовлетворяют исследователей и позволяют рекомендовать вышеуказанную методику патогенетического лечения нейрофиброматоза I типа для повсеместного применения. Разработанная нами комплексная методика патогенетического лечения впервые дает возможность оказать больным медикаментозную помощь.