можно ли колоть гормон роста внутримышечно
Как колоть гормон роста
Необходимые инструменты
Переходим от слов к делу, нам понадобятся:
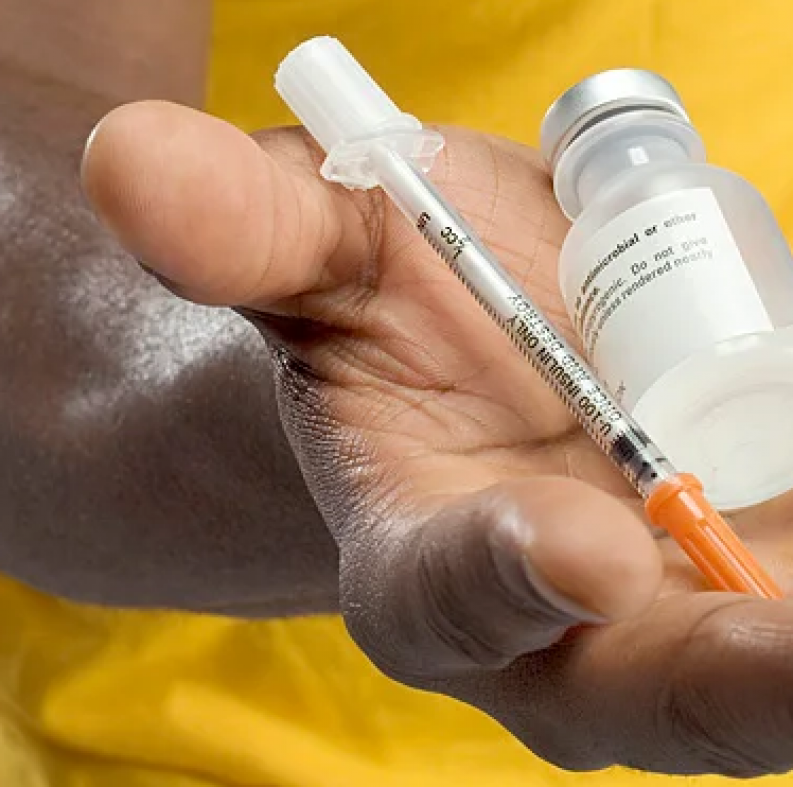
Еще одним весомым преимуществом инсулиновых шприцов с интегрированными иглами является то, что они полностью выдавливают жидкость из баяна шприца. Чего нельзя сказать о шприцах со съемной иглой, у которых присутствует «носик» на конце пластикового стержня, роль которого заключается в удержании иглы, и в этом самом основании порой остается весьма солидная порция драгоценного гормона роста.
Кроме того, у инсулиновых шприцов с интегрированной иглой поршень прорезиненный, и следовательно процесс хода ручки более плавный и мягкий. Это делает укол приятной церемонией.
Стерильную воду для инъекций, как и бактерицидные салфетки, следует покупать в аптеках. Отдавайте предпочтение медикаментам в полимерной таре, потому что их производство находится на более высоком уровне, и соответствует современным стандартам.
Медицинский спирт или спиртовые салфетки необходимы для дезинфекции предполагаемого места инъекции.
Как делается инъекция
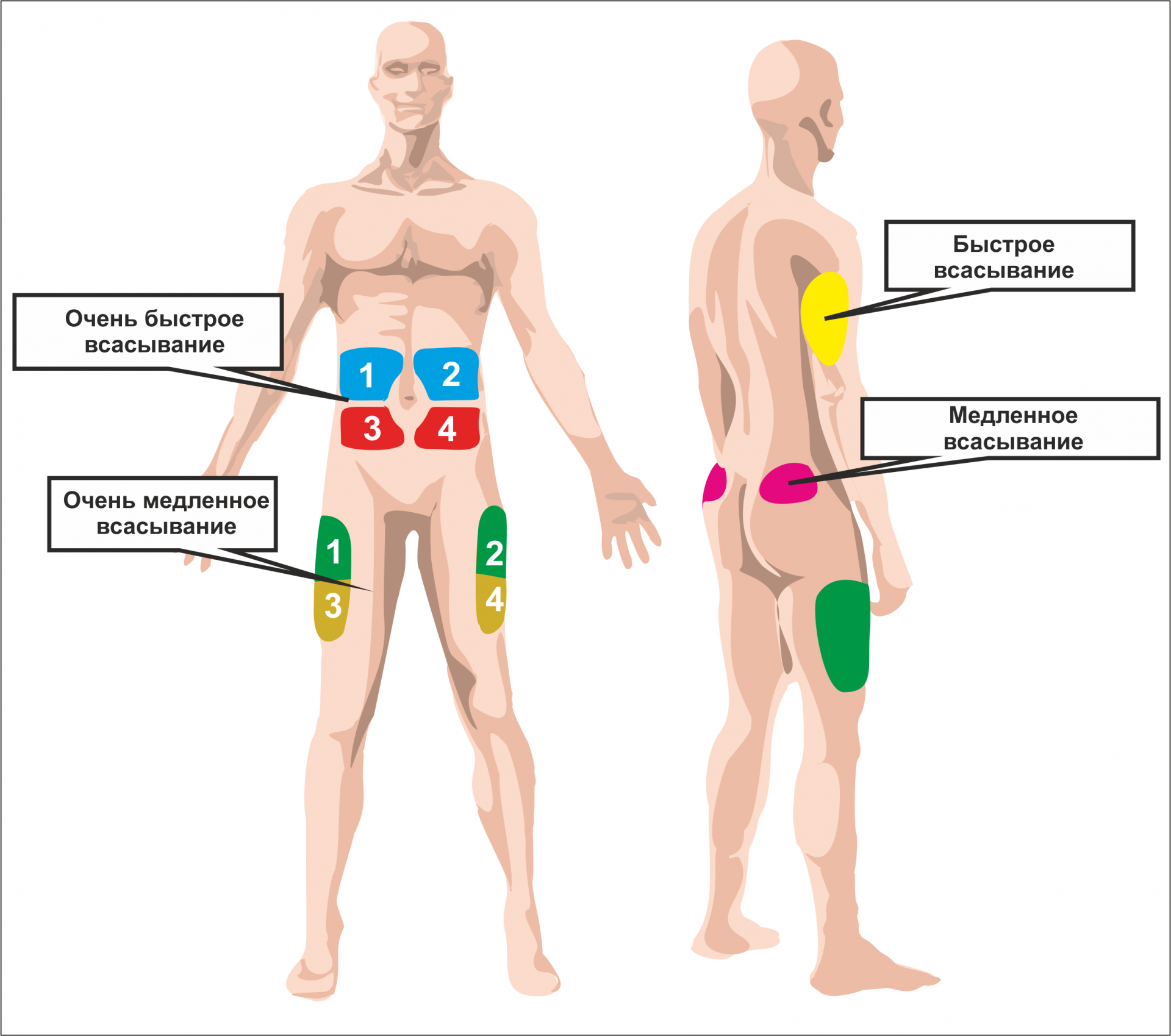
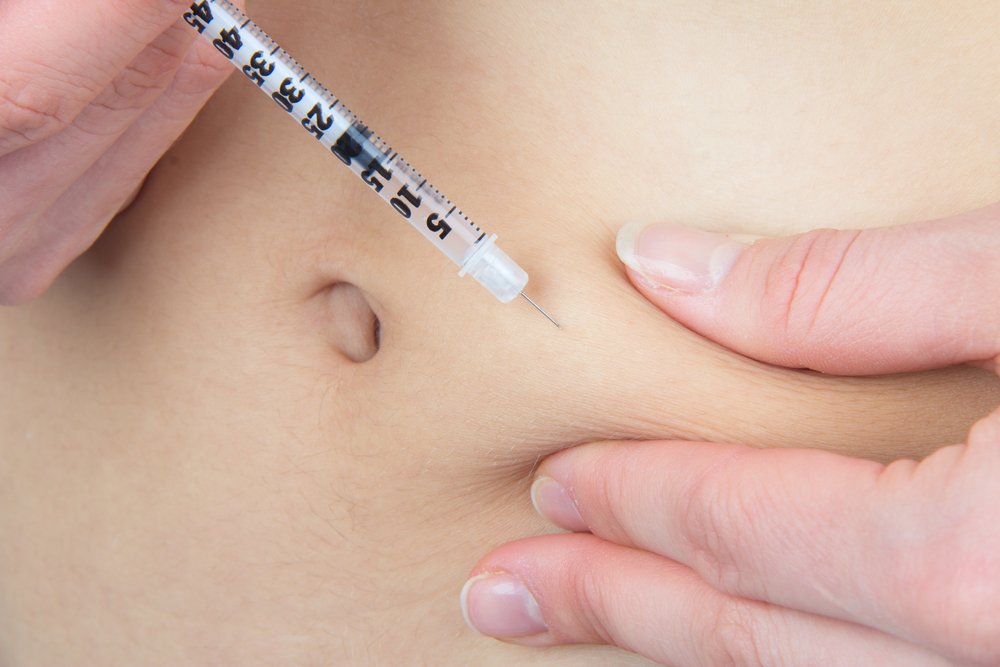
Вводится гормон роста как подкожно так и внутримышечно. Место для инъекции находится очень просто, если это жировая ткань, то лучше всего подойдет складка на животе. Если вы желаете сделать укол прямо в мышцу, то выбирайте точку с небольшим количеством мелких сосудов (к примеру плечо).
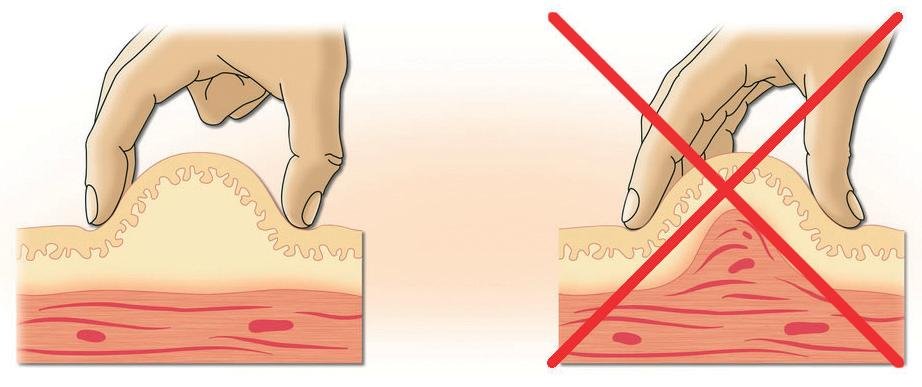
Допустим мы определились с тем что первую инъекцию делаем в жировую складку. Нащупываем область вокруг пупка, в диаметре 8-9 сантиметров от него, она считается наиболее удобной и безболезненной. Берем одной рукой заправленный шприц, другой рукой делаем складку двумя пальцами руки, и под углом 45 градусов плавно вводим иглу почти на полную глубину, затем отдергиваем немного назад, на 3-5 мм. Если пошла кровь, значит вы попали в капилляр и следует поменять место для введения. Если ни каких следов крови нет, значит можно начинать ввод препарата. В случае с жировой тканью появление кровоподтеков практически исключено.
Каждая последующая инъекция должна быть введена в новое место, чтобы избежать появления шишкования (скопление жидкости в месте укола) и отечности.
Приготовление раствора
Лиофилизат гормона роста (порошковую субстанцию) следует разводить стерильной водой для инъекции, раствором натрия хлорида, лидокаином или витамином B6. Для смешивания гормона роста и растворителя понадобится отдельный шприц (подойдет любой инсулиновый, но лучше делать выбор в пользу интегрированной иглы). Вода набирается из флакона и аккуратно вводится в ампулу с гормоном роста. Не рекомендуется трясти и болтать флакон для более быстрого размешивания порошка. Данное действие может навредить активности раствора. На 1 ампулу соматотропина лучше добавлять 1 мл растворителя.
Раствор готового препарата можно хранить не более 48 часов.
Полезные советы
Осталось лишь отметить самые важные нюансы, которые касаются непосредственно самого процесса инъекции.
Правильное администрирование гормона роста позволит добиться максимального эффекта от применения препарата и принесет вам не только удовольствие от процесса, но и прекрасный результат в будущем.
Внимание! Вся информаци я выше дана лишь для общего ознакомления, и не является рабочим пособием по применению. Перед применением любых фармацевтических препаратов обязательна консультация с врачом.
Как колоть гормон роста: куда и в какое время (+дозировки и подробная инструкция)
Соматотропин (гормон роста) уже давно используется спортсменами как средство для прироста мышц и сжигания лишнего жира (сушки). В отличие от стероидов, после курса такого препарата объемы увеличившихся мышц сохраняются. Гормон роста колется курсами, дозы и способ применения зависят от цели. Рассмотрим подробнее, когда и сколько ставить препарата с гормоном роста для ускорения прироста мышц и сжигания жировых отложений.
Какие дозировки гормона роста безопасны
Суточную дозу делят на несколько частей, поскольку гормон роста обладает краткосрочным действием. После введения эффект сохраняется на протяжении 4 часов. Рекомендованные дозы:
Лучше начинать с небольших доз и увеличить их постепенно по следующей схеме:
Женщинам нужно использовать такую же схему, только со своей дозировкой, которая в 2 раза меньше, чем у мужчин. Далее нужно мягко отменять препарат:
Допустимы следующие схемы применения соматотропина:
Максимальная длительность курса – 6 месяцев. В таком случае подходят обе схемы: первые 2 месяца – ежедневно, а далее – по графику 5/2.
Противопоказания к применению:
Куда колоть гормон роста
Соматотропин вводят в организм путем инъекций:
Когда лучше ставить гормон роста
Главное правило в курсе соматотропина – инъекции должны делаться на голодный желудок. Это связано с тем, что после еды в организме начинает вырабатываться инсулин – антагонист, т. е. вещество с противоположным действием. Инсулин помешает выработке.
Исходя из этих условий, специалисты определили, в какое время колоть гормон роста:
Это связано с тем, что до приема пищи еще не начал вырабатываться инсулин, а собственный соматотропин еще продолжает синтезироваться. Кроме того, с утра самая высокая концентрация тестостерона, и с помощью гормона роста можно усилить его анаболический эффект. Также в это время соматотропин поможет подавить катаболизм.
Для набора мышечной массы не менее важен утренний прием пищи, поскольку при голодании уровень гормона стресса (кортизола) находится на пике, а он разрушает белок в мышцах. Из-за этого утром они особенно нуждаются в аминокислотах. Поэтому спустя полчаса-час после инъекции стоит сразу позавтракать.
Вторую инъекцию делают перед обедом. Хорошо, если через 1-2 часа после завтрака была тренировка с ощутимой физической нагрузкой. Примерно через 30 минут после инъекции можно принять протеин или белковую пищу.
Инъекцию перед сном делают только при курсе для сушки, т. е. для сжигания жира. В таком случае введенный соматотропин вступает в реакцию в соматотропином, вырабатываемым в организме. При стремлении набрать мышечную массу лучше не ставить гормон роста на ночь, а ограничиться инъекцией утром и после тренировки.
Как ставить гормон роста
Инъекции в живот необходимо делать в разные места, чтобы избежать неравномерного рассасывания жировой ткани в месте введения. Чаще всего выбирают зону в области пупка как наименее чувствительную. Оптимальный вариант – в диаметре 8-9 см вокруг пупка.
Что необходимо для инъекции:
Во многие комплекты препарата гормона роста производитель уже включает все необходимое: порошок, воду для раствора, шприцы и спиртовые салфетки. Инсулиновые шприцы удобнее по той причине, что имеют интегрированную иглу. Она более тонкая и острая, а поэтому укол практически не ощущается и после инъекции на коже не остается шрамов и гематом. Кроме того, у них более плавный ход поршня, и они полностью выдавливают жидкость.
Инструкция, как колоть гормон роста:
Разводить раствор нужно непосредственно в день использования. При введении только части раствора оставшееся количество нужно отправить на хранение в холодильник на верхнюю полку или отсек на стенке (хранится не более 72 часов). При хранении раствора более 24 часов стоит для разведения использовать бактерицидную воду.
В дополнение к инъекциям гормона роста рекомендуют прием Тироксина. Этот препарат необходим для поддержки щитовидной железы, поскольку соматотропин препятствует выполнению ее функций. Прием Тироксина повысит безопасность гормона роста, а также усилит жиросжигание.
Вопросы эффективности и безопасности применения препаратов гормона роста в педиатрической практике
В настоящее время препараты гормона роста широко применяются в практике детского эндокринолога. Доказана эффективность гормона роста в лечении низкорослости при использовании препаратов с заместительной целью. Однако прогнозирование эффективности терапии
Currently, growth hormone preparations are widely used in practice of child’s endocrinologist. The efficiency of growth hormone in using its preparations with the purpose of substitution for treatment of stunting was proven. However, forecasting of the therapeutic efficiency remains the issue which requires detailed study.
Применение препаратов гормона роста (ГР) в терапевтических алгоритмах заболеваний, сопровождающихся нарушениями динамики ростовых показателей, сегодня обусловлено широкой доступностью несмотря на высокую стоимость. Рекомбинантный человеческий ГР, полученный биосинтетическим путем, используют в педиатрической практике как средство стимуляции роста, так и как метаболический регулятор нарушенных обменных процессов начиная с 1985 г. Вместе с тем препараты соматропина (МНН препаратов гормона роста) имеют определенные показания с доказанной эффективностью. Основным показанием к назначению соматропина является гипопитуитаризм. Именно лечение недостаточности ГР при гипопитуитаризме препаратами соматропина является патогенетически обоснованным и проводится с заместительной целью.
Применение ГР при других вариантах низкорослости возможно, но прогностически непредсказуемо. К настоящему времени имеются данные об эффективности лечения ГР детей с внутриутробной задержкой роста, семейной низкорослостью, синдромами Шерешевского–Тернера, Прадера–Вилли, Рассела–Сильвера, анемией Фанкони, гликогенозом, хронической почечной недостаточностью, скелетными дисплазиями, муковисцидозом [1].
С 2003 г. в США используют биосинтетический ГР для лечения детей с идиопатической низкорослостью. Возраст в начале терапии ГР и ответ на терапию ГР в первый год лечения являются основными факторами, определяющими конечный рост при идиопатической низкорослости. Предполагалось, что дети с хорошим ростовым ответом в первый год лечения ГР при идиопатической низкорослости скорее всего будут иметь хороший конечный рост при использовании даже низких доз ГР [2]. Однако результаты наблюдения показали, что индивидуальный эффект терапии остается сложным для предсказания. Большая вариабельность ауксиологических данных, возраст, показатели роста и костного возраста на момент начала терапии, скорость роста в первый год лечения определяют многофакторный анализ, сложный для прогнозирования.
Достаточно сложно прогнозировать ответ на лечение ГР также и при заместительной терапии. Оценка эффективности лечения ГР при соматотропной недостаточности по ауксиологическим параметрам показала, что ростовой ответ является переменным и различен в каждом конкретном случае [3]. Характерной особенностью терапии соматотропной недостаточности является то, что по данным наблюдений за терапией пациентов результат первого года лечения выше, чем в последующие годы. При этом отмечено, что единственным клинически значимым предиктором ответа роста на начало лечения в первый год является возраст начала терапии. Тогда как ни пик ГР при проведении стимуляционных тестов, ни пол, ни рост на момент начала терапии, индекс массы тела (ИМТ), костный возраст, доза ГР не влияют на скорость роста в первый год терапии. Более ранняя диагностика и лечение ГР позволяют достичь лучшего конечного роста в тяжелых случаях недостаточности ГР. Показано, что лучший ответ на лечение отмечался у детей с тяжелой степенью недостаточности ГР [4]. Но, по другим данным, конечный рост не имеет существенных различий у пациентов с тяжелым дефицитом ГР и пациентов с парциальным дефицитом ГР [5].
Рядом исследований было показано, что рост родителей является одним из показателей, который позволяет прогнозировать конечный рост у пациентов с дефицитом ГР, получающих заместительную терапию ГР. Было отмечено, что лечение ГР имеет лучшую эффективность у пациентов, в семьях которых не было родственников с низкорослостью [6].
Хотя лечение препаратами ГР не всегда сопровождается достижением генетически детерминированного роста, увеличение роста в первый год лечения в возрасте до начала полового развития коррелирует с общей прибавкой в росте при терапии. Это подтверждает важность начала лечения до начала пубертата [7].
В настоящее время ведется ряд исследований, с помощью которых подбирается необходимое сочетание лекарственных препаратов, комбинация с которыми ГР улучшит результаты лечения. Так, было показано, что одновременное назначение при врожденном дефиците ГР заместительной терапии ГР и агониста гонадолиберина с целью торможения инициации полового развития не имеет преимуществ перед назначением только ГР [8].
Ростовые эффекты ГР при соматотропной недостаточности у пациентов и с изолированным дефицитом ГР, и у пациентов с множественной недостаточностью гормонов гипофиза выражены с одинаковой степенью: 89% пациентов с изолированной недостаточностью ГР и 81% пациентов при множественном дефиците гормонов гипофиза достигают прогнозируемого роста. Причем бо?льшая прибавка в росте наблюдается в возрасте до начала пубертата [9].
Многолетний опыт лечения препаратами ГР показал, что лечение детей с низкорослостью с использованием дозы соматропина, рассчитанной на массу тела ребенка, сопровождается большой вариабельностью в ростовом ответе на терапию ГР. Вопрос, почему дети с недостаточностью ГР, терапия которых направлена на простое замещение недостающего ГР, имеют такие различные клинические исходы, до настоящего времени не решен.
Ведутся исследования, направленные на поиск фармакогеномных маркеров с прогностической значимостью чувствительности клеток к ГР.
Изучено изменение уровня инсулиноподобного фактора роста 1 (ИФР-1) после 1 месяца лечения ГР у детей с недостаточностью ГР и доказано, что имеется зависимость между полиморфизмом клеточного регулятора CDK4 и степенью изменения концентрации ИФР-1. Дальнейшее изучение взаимосвязи геномных маркеров и ранних изменений уровня ИФР-1 может позволить разработать стратегию быстрого индивидуального подбора дозы ГР при врожденной соматотропной недостаточности [10].
Также на конечный рост пациентов, получающих лечение ГР, оказывает влияние наличие или отсутствие полиморфизма SOCS2 (rs3782415). Полиморфизм, выявляемый в GHR, IGFBP3 и SOCS2 локусах, влияет на результаты роста пациентов с врожденной соматотропной недостаточностью, получающих ГР. Использование этих генетических маркеров может определить пациентов, генетически предрасположенных к менее результативному лечению [11].
Конечным результатом подобных исследований должно стать признание важности индивидуального дозирования ГР для каждого пациента на основе конкретных индивидуальных геномных характеристик. Это позволит значительно улучшить терапию, которая в течение долгих лет базируется на принципе «одна дозировка подходит всем».
Насколько терапевтическая эффективность соматропина сопоставима с его безопасностью — вопрос, требующий глубокого детального анализа, решение которого возможно путем накопления опыта применения ГР при лечении различных форм низкорослости.
Безопасность во время лечения и неблагоприятные эффекты лечения ГР тщательно отслеживаются и описываются у детей с дефицитом ГР (как с изолированной, так и с множественной недостаточностью гормонов аденогипофиза) и у детей с идиопатической низкорослостью [12]. Согласно имеющейся информации, полученной в основном из постмаркетинговых исследований, поддерживаемых производителями препаратов ГР, имеется низкая частота (менее 3% пролеченных детей) побочных эффектов и увеличение благоприятного профиля безопасности ГР. Тем не менее, полный спектр потенциальных побочных эффектов ГР не точно диагностируется при помощи постмаркетинговых исследований. Это связано с достаточно длительным сроком лечения, меняющимися в динамике характеристиками больного и невозможностью отследить нежелательные явления после окончания лечения пациента [13–15].
Редко возникающим нежелательным явлением при лечении ГР является внутричерепная гипертензия. Более высокий риск ее развития отмечен в группах больных с хронической почечной недостаточностью, синдромом Шерешевского–Тернера и с органическими причинами дефицита ГР. Внутричерепная гипертензия обычно развивается в начальном периоде лечения или при увеличении дозы препаратов соматропина, прекращается с окончанием терапии ГР. Показанием для проведения фундоскопии офтальмологом являются симптомы, указывающие на внутричерепную гипертензию, такие как сильная головная боль, двоение/нечеткое зрение и рвота. Лечение часто может быть возобновлено при более низких дозах ГР без возврата симптомов.
К осложнениям терапии соматропином относят изменения в костной системе — эпифизеолиз и сколиоз. Эпифизеолиз диагностируется с частотой 73 на 100 000 лет лечения и встречается реже у больных с изолированным дефицитом ГР и идиопатической низкорослостью по сравнению с теми пациентами, у которых дефицит ГР наблюдается вследствие внутричерепных новообразований, краниофарингеомы [16]. Средняя продолжительность от начала терапии ГР до появления эпифизеолиза колеблется от 0,4 до 2,5 лет. Рекомендовано регулярное наблюдение за появлением соответствующих симптомов, таких как боли в бедре и/или боли в колене, изменения в походке, в случае положительного результата — тщательное обследование и консультация ортопеда. Эпифизеолиз требует хирургического вмешательства на эпифизе бедренной кости.
Сколиоз прогрессирует во время лечения ГР из-за быстрого роста, а не является прямым побочным эффектом ГР. Наиболее часто сколиоз развивается при лечении синдромальных форм низкорослости (например, при синдроме Шерешевского–Тернера и синдроме Прадера–Вилли) [17]. У 0,2% детей с идиопатической низкорослостью или с изолированным дефицитом ГР, получавших ГР, отмечено прогрессирование сколиоза [18]. Регулярное обследование на предмет наличия или прогрессирования сколиоза рекомендуется всем пациентам, получающим препараты ГР.
Данные научных публикаций и собственный практический клинический опыт свидетельствуют о необходимости мониторинга показателей метаболизма глюкозы у пациентов, получающих ГР. Это связано с доказанным фактом наличия резистентности к инсулину при лечении препаратами соматропина. Заболеваемость сахарным диабетом (СД) 1-го типа не увеличивается при терапии ГР. Вместе с тем известно, что больные с синдромом Шерешевского–Тернера, Прадера–Вилли имеют высокий риск развития неиммунных форм сахарного диабета. Снижение чувствительности к инсулину и компенсаторное увеличение секреции инсулина с обеспечением эугликемии сопровождается нарушением толерантности к глюкозе и требует коррекции метаболических нарушений, а в ряде случаев отмены препаратов ГР [19]. Мониторинг потенциального развития сахарного диабета с тестированием крови на уровень глюкозы и/или HbA1c должен быть включен в алгоритм наблюдения за всеми пациентами, получающими препараты ГР.
Патофизиологические и эпидемиологические наблюдения позволяют выразить опасение, что ГР может увеличить риск развития злокачественной опухоли во время или после терапии. Известно, что реализация ростового эффекта ГР опосредована соматомединами, один из которых ИФР-1. ИФР-1 и ГР относятся к веществам с митогенной и антиапоптозной активностью, и их рецепторы обнаружены в опухолях. Состояния нарушенной и избыточной секреции/действия ГР ассоциированы со снижением и повышением риска злокачественности соответственно. Снижение ИФР-1 через ограничение калорийности индуцирует апоптоз и предотвращает или замедляет рост опухоли [20–22]. Некоторые немногочисленные эпидемиологические исследования соотносят увеличение ГР и уровни ИФР-1 с опухолями толстой кишки, молочной железы, щитовидной железы и раком предстательной железы у взрослых [23]. В целом данные литературы указывают на разрешающую/факультативную, а не причинную роль ГР в онкогенезе.
Заболеваемость впервые выявленными во время лечения лейкемией или злокачественными новообразованиями в целом после лечения у детей без сопутствующих факторов риска не увеличивается по сравнению с таковой в общей популяции. Несмотря на данные об отсутствии влияния ГР на появление второго новообразования у детей, в анамнезе которых была неоплазия [24, 25], пункт о повышенном риске развития второго новообразования у пациентов, получавших ГР, в настоящее время присутствует в инструкции по применению на всех препаратах ГР в США. Отсутствуют данные относительно эффектов ГР на риск развития неоплазии у больных с заболеваниями, которые сами отнесены в группу повышенного риска возникновения новообразований. Риск новообразований у пациентов, получающих лечение ГР, был рассмотрен Комитетом по лекарственным средствам и терапии Общества детских эндокринологов, и ключевой рекомендацией является необходимость продолжающегося наблюдения всех пациентов, получавших лечение ГР, и это имеет первостепенное значение [26].
Перед началом терапии ребенка препаратами гормона роста его родители должны быть информированы о неопределенности в отношении долгосрочной безопасности (о неблагоприятных эффектах после терапии в зрелом возрасте).
Долгосрочные исследования (в среднем 17 лет) по наблюдению 6928 детей с изолированной соматотропной недостаточностью идиопатической низкорослостью, или низким гестационным возрастом, которые начали лечение ГР в период между 1985 и 1996 гг., во Франции показали 30%-й рост общей смертности по сравнению с населением в целом [27]. Все виды смертности, связанной с раком, не были увеличены, но стандартизованные показатели смертности были повышены в группах больных с опухолями костной системы, больных с нарушениями в системе кровообращения и больных с кровоизлиянием в мозг. Применение дозы препаратов ГР более 50 мкг/кг/день не рекомендовано. Полученные из той же базы данные в недавнем исследовании показали значительно более высокий риск развития инсульта (особенно геморрагического инсульта) среди пациентов, получавших ГР в детстве [28]. В противоположность этому последующее наблюдение 2543 пациентов с изолированной соматотропной недостаточностью, идиопатической низкорослостью или низким гестационным возрастом из других европейских стран не выявили никакого эффекта воздействия ГР и/или дозы на смертность или частоту развития сердечно-сосудистых событий [29].
Таким образом, имеющиеся данные относительно безопасности терапии ГР для детей с различными формами низкорослости определяют необходимость формирования персонализированного алгоритма диспансерного наблюдения пациента и должны включать информирование родителей ребенка об имеющихся сегодня сведениях о нежелательных явлениях как во время лечения, так и в отдаленные периоды жизни.
Применение высоких доз препаратов гормона роста при синдромальных формах низкорослости должно иметь взвешенный подход к сопоставлению показателей эффективности и безопасности лечения. Увеличение дозы ГР определяет рост шансов, отдаленных метаболических или злокачественных рисков, не обнаруженных в ходе проведенных на сегодняшний день исследований. Изменение характеристик пациентов, этнических особенностей и рост уровня ожирения в детстве может увеличить риск развития СД 2-го типа у получающих ГР.
Определенные побочные эффекты препаратов ГР, связанные с ускоренным ростом (прогрессирование сколиоза и эпифизеолиз) и другими неизвестными механизмами (внутричерепная гипертензия), встречаются редко, однако требуют упреждающего разъяснения и тщательного контроля.
Кроме того, следует помнить об отдаленных последствиях гормонального лечения. Поскольку исследования населения, не получающего ГР, свидетельствуют о том, что высокие нормальные уровни свободного ИФР-1 (часто выявляемые у детей, получавших ГР) могут увеличить риски онкологических заболеваний, потенциальные связи между воздействием ГР и будущими рисками возникновения неоплазии требуют постоянного контроля. И, наконец, соответствующий уровень допустимого риска для новейшей и потенциально самой большой группы пациентов, получавших ГР, — практически здоровых, но низкорослых детей — еще предстоит определить [30].
Литературы
Е. Б. Башнина, доктор медицинских наук, профессор
О. С. Берсенева 1
ФГБОУ ВО СЗГМУ им. И. И. Мечникова МЗ РФ, Санкт-Петербург