Что обуславливает в мире высокое поверхностное натяжение воды
Поверхностное натяжение воды
Поверхностное натяжение воды – одно из самых интересных свойств воды.
Примеры поверхностного натяжение воды
Для лучшего понимания поверхностного натяжения воды приведем несколько его проявлений в реальной жизни:
Поверхностное натяжение — несколько точных определений
Большая медицинская энциклопедия
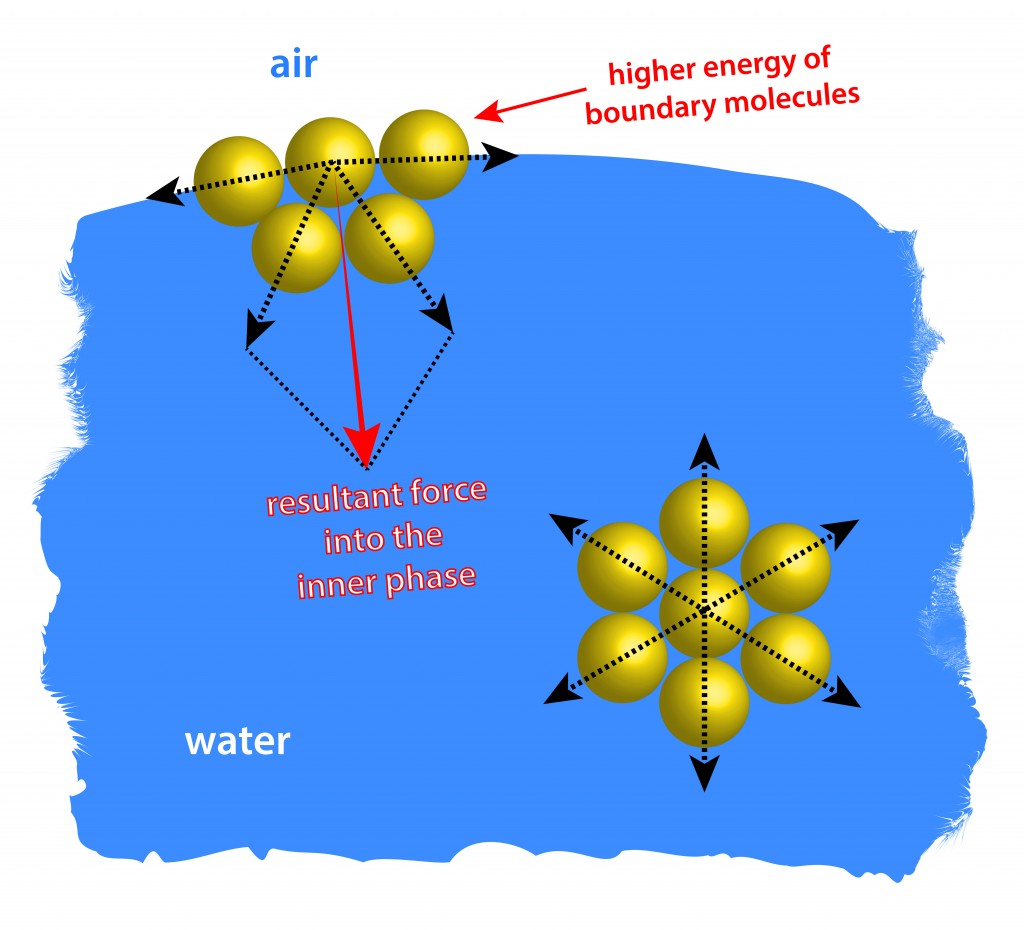
Поверхностное натяжение (П. н.) — это сила притяжения, с которой каждый участок поверхностной пленки (свободной поверхности жидкости или же любой поверхности раздела двух фаз) действует на смежные части поверхности. Внутреннее давление и П. н. Поверхностный слой жидкости ведет себя, как эластическая растянутая мембрана. Согласно представлению, развитому гл. обр. Лапласом (Laplace), это свойство жидких поверхностей зависит от «молекулярных сил притяжения, быстро убывающих с расстоянием. Внутри однородной жидкости силы, действующие на каждую молекулу со стороны молекул, ее окружающих, взаимно уравновешиваются. Но вблизи поверхности равнодействующая сил молекулярного притяжения направлена внутрь; она стремится втянуть поверхностные молекулы в толщу жидкости. Вследствие этого весь поверхностный слой подобно упругой растянутой пленке оказывает на внутреннюю массу жидкости в направлении, нормальном к поверхности, весьма значительное давление. По подсчетам это «внутреннее давление», под которым находится вся масса жидкости, достигает нескольких тысяч атмосфер. Оно возрастает на выпуклой поверхности и убывает на вогнутой. В силу стремления свободной энергии к минимуму всякая жидкость стремится принять форму, при к-рой ее поверхность — место действия поверхностных сил — имеет наименьшую возможную величину. Чем больше поверхность жидкости, тем большую площадь занимает ее поверхностная пленка, тем значительнее запас свободной поверхностной энергии, освобождающейся при ее сокращении. Натяжение, с которым каждый участок сокращающейся поверхностной пленки действует на смежные части (в направлении, параллельном свободной поверхности), называется П. н. В отличие от эластического напряжения упругого растянутого тела, П. н. не ослабевает по мере сжатия поверхностной пленки. … Поверхностное натяжение равняется работе, которую нужно совершить, чтобы увеличить свободную поверхность жидкости на единицу. П. н. наблюдается на границе жидкости с газом (также и с собственным паром), с другой несмешивающейся жидкостью или же с твердым телом. Точно так же и твердое тело имеет П. н. на границе с газами и жидкостями. В отличие от П. н., к-рое жидкость (или твердое тело) имеет на своей свободной поверхности, граничащей с газообразной средой, натяжение на внутренней границе двух жидких (или жидкой и твердой) фаз удобно обозначить специальным термином—принятым в немецкой литературе, термином «пограничное натяжение» (Grenzflachenspannung). Если в жидкости растворено вещество, понижающее ее П. н., то свободная энергия уменьшается не только путём уменьшения величины пограничной поверхности, но и посредством адсорпции: поверхностно активное (или капилярноактивное) вещество собирается в повышенной концентрации в поверхностном слое …
…
Большая медицинская энциклопедия. 1970
Подытожить все вышесказанное можно таким образом – молекулы, которые находятся на поверхности какой либо жидкости, в том числе и воды, притягиваются остальными молекулами внутрь жидкости, вследствие чего и возникает поверхностное натяжение. Подчеркнем, что это упрощенное понимание этого свойства.
Коэффициент поверхностного натяжения — определение
Политехнический терминологический толковый словарь
Коэффициент поверхностного натяжения — линейная плотность силы поверхностного натяжения на поверхности жидкости или на границе раздела двух несмешивающихся жидкостей.
Политехнический терминологический толковый словарь. Составление: В. Бутаков, И. Фаградянц. 2014
Ниже мы приведем значения коэффициента поверхностного натяжения (К. п. н.) для различных жидкостей при температуре 20°C:
Коэффициенты поверхностного натяжения воды
Коэффициент поверхностного натяжения зависит от температуры жидкости. Приведем его значения при различных температурах воды.
Что такое поверхностное натяжение?
Это нисходящее притяжение молекул поверхностного уровня заставляет их плотнее притягиваться друг к другу, сжимаясь в более устойчивое, выровненное расположение. Этот более плотный ряд поверхностных молекул образует нечто вроде упругой мембраны на поверхности жидкости. Молекулы расположены более плотно и плавно выстроены рядом друг с другом, в отличие от более хаотических молекулярных схем ниже.
Почему поверхностное натяжение так важно?
Хотя это свойство жидкостей, безусловно, интересно, оно, похоже, не играет большой роли в нашей повседневной жизни, но именно здесь вы ошибаетесь. Помимо просмотра крутых видеороликов об идеально круглых каплях воды, падающих в замедленном режиме (еще один пример поверхностного натяжения) или водомерки, которые двигаются со скоростью 2 метра в секунду, скользя по поверхности озера, почему поверхностное натяжение имеет значение?
В некоторых отраслях поверхностное натяжение является более простым показателем загрязнения продуктов. Поскольку поверхностное натяжение определяется на молекулярном уровне, любое изменение компонентов жидкости, поверхностно-активных веществ, топлива или соединений в жидкости может привести к изменению поверхностного натяжения.
Если известно поверхностное натяжение совершенно чистого состава, любое отклонение от этого выявит некоторый уровень загрязнения. Это может показаться абстрактным приложением поверхностного натяжения, но оно показывает, как даже самые простые вещи могут оказать наибольшее влияние в науке.
Как упоминалось ранее, поверхностное натяжение важно для водомерок, одного из немногих существ, которые могут перемещаться по поверхности воды, не падая внутрь. Это явление происходит потому, что ноги водомерки «не смачиваются», то есть ноги водомерки отталкивают воду и захватывать воздух, позволяя им существенно вдавливать поверхность воды, не нарушая ее. Волосы также увеличивают площадь поверхности водяных струй, что означает, что на поверхность воды воздействует меньшее усилие. Это ошеломляющее сочетание тонкой силы и идеальной адаптации.
Однако, что наиболее важно, и то, что мало кто осознает, поверхностное натяжение позволяет вещам плавать, от листьев и семян до молекул и белков. Когда вы опускаетесь до микроскопического масштаба, поверхность любого водоема очень жива и поддерживается поверхностным натяжением молекул воды. Наши экосистемы не смогут выжить или даже развиваться без воздействия поверхностного натяжения, а сам состав воды будет менее стабильным, постоянно поступая и выходя из газообразного состояния.
Пять стихий: вода
Неожиданные свойства самой распространенной жидкости на Земле
О необычных, а порой и «волшебных», свойствах воды нам рассказывают в школе, в институте, в электричках и на сайтах, где продают флаконы «живой воды». Кроме шуток, у самой распространенной жидкости на Земле действительно хватает необычных характеристик, чтобы их изучению посвящались тысячи научных работ. В рамках проекта «Пять стихий», который N+1 осуществляет совместно с НИТУ «МИСиС», мы расскажем о том, насколько жидкая стихия поддается укрощению, то есть можно ли с помощью современной физики вывернуть все необычные свойства воды наизнанку, как это сделать, а главное — зачем.
О главном
Принципиальный вопрос: откуда у вещества с такой простой формулой (H2O, как все помнят) берется такой набор необычных, местами парадоксальных свойств. Оказывается, что из этой самой формулы и берется. Молекулы воды устроены просто, но очень хитро: в них атом кислорода находится в середине воображаемого тетраэдра, а две неподеленных электронных пары и два атома водорода размещены в его вершинах. Такая конструкция позволяет представить весь объем воды как массив упорядоченных тетраэдров, причем атомы водорода оказываются удобно зажаты между «собственным» кислородом и кислородом соседа. Такая дополнительная связь между соседними молекулами называется водородной, и хотя она на порядок слабее внутримолекулярной ковалентной связи, в масштабах всего вещества она является дополнительным связывающим фактором. Кстати, когда мы сказали «массив упорядоченных тетраэдров», любители теорий о «структуре» и «памяти» воды рановато обрадовались: это упорядочивание действительно есть, но благодаря тепловому движению сетка водородных связей все время разрушается и создается заново, таким образом «помнить» вода ничего не может, но ей и не надо.
Из наличия водородных связей вытекает, пожалуй, самая главная характеристика воды — огромная энергия когезии молекул, которая удерживает их вместе и отвечает за то, что вода остается жидкой при комнатной температуре. У ближайших соседей — сероводорода (H2S), аммиака (NH3), галогеноводородов (HF, HCl и пр.) — водородные связи тоже могут образоваться, но все эти вещества при комнатной температуре — газы, что еще раз подтверждает необычный статус воды. Но это еще далеко не все. Мы выбрали пять характерных явлений, связанных с водой, которые и предлагаем рассмотреть по порядку.
Когезия: теплоемкость
Давайте вспомним, как на молекулярном уровне определяется агрегатное состояние вещества: если энергия теплового движения совсем мала, атомы будут выстраиваться в наиболее выгодное пространственное положение, как правило — очень симметричное. Такое состояние мы называем «твердым». Если температуру (а вместе с ней и тепловую энергию) системы повысить, атомы и молекулы смогут вырваться из кристаллической решетки, но им все еще не будет хватать прыти, чтобы разлететься далеко друг от друга — в этом случае вещество будет жидким. Когда тепловой энергии окажется достаточно, чтобы пересилить все межмолекулярные взаимодействия, молекулы разлетятся подальше друг от друга, а вещество превратится в газ.
Как видно из нашей простой картинки, именно межмолекулярные взаимодействия определяют то, как много энергии готова впитать жидкость прежде, чем испариться. Этот параметр называется теплоемкостью и для воды он действительно велик: чтобы нагреть килограмм воды на один градус, требуется 4200 джоулей — в четыре раза выше, чем для материалов вроде дерева, камня и стекла, и в 10 раз выше, чем теплоемкость металлов.
Как «победить» столь высокую теплоемкость воды? Значительных успехов здесь добиться не удалось, однако метод предельно ясен: раз во всем виноваты упорядоченные водородные связи, надо их устранить. Для этого достаточно заставить молекулы воды структурироваться как-то по-другому, например, тянуться атомами кислорода к какому-то заряженному объекту. С этой ролью неплохо справляются белки: в достаточно концентрированных растворах они облепляются молекулами воды, которые больше не могут образовывать водородные связи. Теплоемкость в таком случае снижается почти в два раза и становится такой же, как у льда. Кстати, о льде.
Когезия: кристаллизация
Как мы уже знаем, молекулы воды любят упорядочиваться, однако за счет теплового движения их структура оказывается несколько разупорядоченной. Охлаждение способно внести порядок. «Если температуру понизить, водородные связи заставят молекулы воды практически замереть в наиболее удачном положении. Необычным фактом является то, что это для этого положения характерно сравнительно большое количество пустот между молекулами, поэтому лед занимает на 9 процентов больший объем, чем та же масса жидкой воды», — поясняет природу этого процесса профессор Юрий Николаевич Уткин, доктор химических наук, ведущий эксперт Центра энергоэффективности НИТУ «МИСиС». С одной стороны, такое свойство положительно сказывается на экосистеме: более легкий лед плавает на поверхности, а водоемы не промерзают до дна. С другой стороны, образование льда ставит под угрозу жизнь многих биологических систем, так как увеличившаяся в объеме вода может необратимо повредить клетки, которые уже не смогут восстановиться после разморозки. Из-за этого продукты из морозилки уже не настолько хороши, как в свежем виде — кристаллы льда вредят внутренней структуре тканей.
Пагубное влияние льда, к счастью, оказалось несложно победить. Причем на этой почве преуспели и природные системы, и синтетические. Первые научились создавать специальные структуры, чаще всего белковые, которые называют «антифризами». Эти крупные молекулы хитро связываются с зародышами кристаллов льда, препятствуя их дальнейшему росту. Таким образом вместо крупных кристаллов с большим объемом в системе образуется кашица из мелких кристалликов льда, которая практически не повреждает клетку. Живые организмы, использующие белковые антифризы, выживают при температурах до −30 градусов Цельсия, а жуки Upis Ceramboides и вовсе выдерживают морозы до −60 градусов благодаря небелковым антифризам.
В промышленности же с замерзанием воды борются проще — добавляя в систему так называемые криопротекторы, образующие водородные связи с водой и препятствующие ее замерзанию. К этим веществам относятся глицерин, этанол, полиэтиленгликоль и другие. Эти же агенты используют и при исследовании биологических препаратов, которые требуется заморозить, но сохранить при этом в максимально близком к «живому» состоянию виде. Недавно оказалось, что и красители могут служить в качестве криопротекторов. Например, хорошо известный сафранин О по своим свойствам схож с белковыми антифризами, хотя и имеет значительно меньший размер молекул.
Когезия: вязкость
Продолжая наблюдать за необычными свойствами, следующими из сильной когезии молекул воды, надо упомянуть и вязкость. Этот параметр, свойственный любым жидкостям и газам, отвечает за то, насколько сильно слои одного и того же вещества «трутся» друг о друга. Если точнее, вязкость определяет интенсивность обмена импульсом между молекулами. Сильно вязкие системы — мед, или кетчуп, например — текут медленно и неохотно, тогда как вещества с малой вязкостью — бензин или ацетон — растекаются быстро и при меньшем внешнем воздействии.
Значительная вязкость воды является главным виновником того, что под водой практически невозможно серьезно разогнаться, а для прокачки жидкости по трубам требуются мощные насосы. Самое обидное, что бороться с вязкостью путем устранения водородных связей не получается: когда молекулы воды упорядочиваются, их вязкость становится еще больше за счет тех же сил, что вызывают это упорядочение. Однако проблему вязкого сопротивления удалось вполне успешно атаковать не со стороны самой воды, а со стороны тела, движущегося сквозь нее. Для этого вспомним об адгезии и взаимодействии воды с другими телами.
Адгезия: прилипание
Если когезия — это притяжение молекул воды друг к другу, то адгезия — это их притяжение к сторонним телам, например, стенкам сосудов. Тут важно вспомнить, что вода ко всему прочему является полярной жидкостью, то есть каждая ее молекула представляет собой диполь — частицу, у которой один конец заряжен чуть более положительно, а другой — чуть более отрицательно. Благодаря такой структуре вода в целом остается электронейтральной, но ее молекулы способны взаимодействовать, например, со стенками сосуда. Объясняется это тем, что большинство поверхностей, погруженных в полярную жидкость, оказывается хоть немного, но заряженной.
Адгезия молекул воды к стенкам влечет за собой много последствий, одно из которых известно под названием «гидродинамическое условие прилипания». Оно выражается в том, что при течении воды вдоль большинства поверхностей ближайший к стенке слой «прилипает», поэтому скорость в нем нулевая. За счет вязкости этот слой сильно тормозит следующий и так далее. В итоге максимальная скорость будет наблюдаться в центре трубы или канала. Казалось бы, ничего страшного в этом нет, и это правда, пока речь идет о крупных трубах — водопроводных, например. Если же собрать устройство с каналами толщиной в несколько микрон, то в них вязкое сопротивление окажется настолько велико, что обычные насосы уже не смогут прокачать воду через тонкие трубки. Такая проблема существует в микрофлюидике — разделе науки о миниатюрных устройствах для управления жидкостями, пузырьками и каплями на микромасштабах. Специальные микрофлюидные приборы чем-то похожи на электронные чипы, только в них вместо проводов для электричества проложено множество каналов для жидкости. Такая «лаборатория-на-чипе» позволяет производить десяток биологических анализов в устройстве размером с наручные часы.
Очевидно, что миниатюризация в рамках микрофлюидики не предполагает наличие огромного насоса для прокачки жидкости, поэтому с вязким сопротивлением воды приходиться справляться. На данный момент существует два основных способа, как это сделать: во-первых, можно устранить прилипание воды на стенке, что существенно увеличит скорость течения. Для этого используют поверхность, которая слабо взаимодействует с молекулами воды, то есть гидрофобный материал. Однако первые же эксперименты показали, что обычная химическая гидрофобность дает лишь очень слабый эффект в снижение вязкого сопротивления. Следующим шагом стало изобретение супергидрофобных поверхностей, обладающих необычным рельефом и способностью удерживать в нем пузырьки воздуха. Поскольку на границе «жидкость-газ» прилипание отсутствует, вода очень быстро скользит вдоль таких поверхностей. Эффект особенно заметен в случае микроканалов, однако попытки сделать более крупное устройство с супергидрофобными стенками (подводную лодку, например) пока не увенчались особыми успехами.
Вторым способом устранения вязкого сопротивление является отказ от традиционных насосов для прокачки жидкости за счет перепада давления. Вместо этого можно заставить воду течь под действием электрического поля, правда, для этого необходимо добавить в систему электролит (например соль), а стенки — зарядить. Такое течение называется электроосмотическим и характеризуется тем, что профиль скорости жидкости оказывает плоским, без максимума в центре канала. Это очень удобно, если в системе есть требование к равномерной прокачке жидкости по микроканалу.
Адгезия: поверхностное натяжение
Раз мы вспомнили об адгезии воды и гидрофобных поверхностях, нельзя не упомянуть о смачивании и капиллярности. Эти свойства определяют, как ведет себя поверхность жидкости, а также ее капли и пленки на твердых телах, внутри капилляров, пор и так далее. Вода и здесь продолжает держать марку в качестве «самой-самой»: благодаря огромной энергии когезии велико и поверхностное натяжение, которое, например, отвечает за форму дождевых капель и позволяет водомеркам бегать по воде как по твердому основанию. Само натяжение возникает из-за того, что каждой молекуле воды выгоднее находиться в объеме, в окружении соседей, поэтому все молекулы одинаково стремятся покинуть поверхность, то есть максимально сократить ее площадь. Поэтому мы не видим капель в форме кубика: шар всегда имеет меньшую площадь при том же объеме.
Если добавить к поверхностному натяжению взаимодействие с твердыми телами, мы окунемся в богатый мир смачивания: здесь и идеально круглые капли на листке лотоса, и поднятие воды по тонким капиллярам, и пропитка пористых тел (мочалки, например). А еще интереснее посмотреть, как всеми этими эффектами можно управлять, так как поверхностное натяжение оказалось одним из самых «податливых» свойств воды. Самый известный бытовой пример — добавить к воде поверхностно-активное вещество, например мыло. В этом случае поверхность жидкости окажется стабилизирована, а натяжение значительно снизится. Попробуйте выдуть пузырь из чистой воды — не тут-то было, а из мыльной — пожалуйста: большая площадь поверхности уже не помеха. Можно провести другой эксперимент: посыпать воду молотым перцем и кинуть в нее кубик льда. За счет разницы температур возникнет перепад поверхностного натяжения, и перчинки поплывут в сторону кубика.
Снова вернемся к гидрофобным и супергидрофобным поверхностям: поскольку вода их очень не любит, она стремится максимально сократить площадь контакта с ними. Если каплю воды посадить на такую поверхность, мы увидим почти идеальный шар, который едва касается поверхности. Такие шарики очень легко заставить кататься, поэтому супергидрофобными поверхностями в основном интересуются для создания водоотталкивающих и антиобледенительных покрытий. Природа тоже давно их использует: лист лотоса, ножка водомерки, кожа акулы — вот лишь некоторые примеры. Гидрофобные поверхности оказались удачным решением и старых бытовых проблем: протекающего носика заварочного чайника, например. Если его снаружи покрыть гидрофобным материалом, заварка всегда будет литься только в чашку.
Встречаются и совсем необычные эффекты управления поверхностным натяжением и смачиванием, например капли Ляйденфроста. Они образуются, если воду накапать на очень сильно нагретую поверхность: в этом случае между каплей воды и твердым телом возникает прослойка пара, поэтому капля свободно летает над поверхностью. Кстати, аналогичный эффект очень вредит промышленным водонагревателям: если их мощность слишком велика, на поверхности нагревателя образуется прослойка пара, которая блокирует теплообмен и приводит к перегреву устройства. В качестве других примеров необычных капиллярных явлений можно назвать эффекты, возникающие в отсутствие гравитации (например на орбите). Именно ими объясняются огромные капли воды, которые нам показывают в видеорепортажах про жизнь космонавтов: без силы тяжести поверхностное натяжение остается единственным фактором, определяющим форму капли, поэтому независимо от объема жидкость стремится стать шариком. На Земле же максимальный размер идеально круглых капель — несколько миллиметров. Если размер больше, гравитация придаст капле форму лужи.
Мы вспомнили лишь некоторые из свойств воды, с которыми мы сталкиваемся в повседневной и научной жизни. Существуют и многие другие особенности и эффекты — сольватация, диэлектрическая проницаемость, осмотическое давление — которые остались за кадром. Вода была и остается одним из самых популярных объектов для изучение в современной физической химии и материаловедении и чуть ли не главным залогом существования живых организмов, и каждый из названных эффектов играет в этом свою роль.
Поверхностное натяжение
Молекулы жидкости испытывают силы взаимного притяжения — на самом деле, именно благодаря этому жидкость моментально не улетучивается. На молекулы внутри жидкости силы притяжения других молекул действуют со всех сторон и поэтому взаимно уравновешивают друг друга. Молекулы же на поверхности жидкости не имеют соседей снаружи, и результирующая сила притяжения направлена внутрь жидкости. В итоге вся поверхность воды стремится стянуться под воздействием этих сил. По совокупности этот эффект приводит к формированию так называемой силы поверхностного натяжения, которая действует вдоль поверхности жидкости и приводит к образованию на ней подобия невидимой, тонкой и упругой пленки.
Одним из следствий эффекта поверхностного натяжения является то, что для увеличения площади поверхности жидкости — ее растяжения — нужно проделать механическую работу по преодолению сил поверхностного натяжения. Следовательно, если жидкость оставить в покое, она стремится принять форму, при которой площадь ее поверхности окажется минимальной. Такой формой, естественно, является сфера — вот почему дождевые капли в полете принимают почти сферическую форму (я говорю «почти», потому что в полете капли слегка вытягиваются из-за сопротивления воздуха). По этой же причине капли воды на кузове покрытого свежим воском автомобиля собираются в бусинки.
Силы поверхностного натяжения используются в промышленности — в частности, при отливке сферических форм, например ружейной дроби. Каплям расплавленного металла просто дают застывать на лету при падении с достаточной для этого высоты, и они сами застывают в форме шариков, прежде чем упадут в приемный контейнер.
Можно привести много примеров сил поверхностного натяжения в действии из нашей будничной жизни. Под воздействием ветра на поверхности океанов, морей и озер образуется рябь, и эта рябь представляет собой волны, в которых действующая вверх сила внутреннего давления воды уравновешивается действующей вниз силой поверхностного натяжения. Две эти силы чередуются, и на воде образуется рябь, подобно тому как за счет попеременного растяжения и сжатия образуется волна в струне музыкального инструмента.
Будет жидкость собираться в «бусинки» или ровным слоем растекаться по твердой поверхности, зависит от соотношения сил межмолекулярного взаимодействия в жидкости, вызывающих поверхностное натяжение, и сил притяжения между молекулами жидкости и твердой поверхностью. В жидкой воде, например, силы поверхностного натяжения обусловлены водородными связями между молекулами (см. Химические связи). Поверхность стекла водой смачивается, поскольку в стекле содержится достаточно много атомов кислорода, и вода легко образует гидрогенные связи не только с другими молекулами воды, но и с атомами кислорода. Если же смазать поверхность стекла жиром, водородные связи с поверхностью образовываться не будут, и вода соберется в капельки под воздействием внутренних водородных связей, обусловливающих поверхностное натяжение.
В химической промышленности в воду часто добавляют специальные реагенты-смачиватели — сурфактанты, — не дающие воде собираться в капли на какой-либо поверхности. Их добавляют, например, в жидкие моющие средства для посудомоечных машин. Попадая в поверхностный слой воды, молекулы таких реагентов заметно ослабляют силы поверхностного натяжения, вода не собирается в капли и не оставляет на поверхности грязных крапин после высыхания (см. Подобное растворяется в подобном).