Слабый иммунный ответ при коронавирусе что это
Иммунитет к COVID-19: есть или нет?
По данным на 4 декабря в мире зарегистрировано более 65 миллионов случаев заражения COVID-19. По мере распространения вируса ученые узнают все больше о том, как наша иммунная система реагирует на него. Запоминает ли она вирус? Как быстро возникает такая память и как долго хранится? Можно ли заразиться повторно и к чему это приведет? Собрали информацию, известную на данный момент.
Как появляется иммунитет к вирусам?
Спойлер: Долговременную защиту создают потомки В- и Т-клеток, сумевших справиться с вирусом. Первые вырабатывают антитела, а вторые уничтожают клетки, в которые проник вирус.
За специфический иммунитет к вирусам отвечают защитные клетки крови – Т- и В-лимфоциты. Распознав вирус, они активируются и начинают с ним бороться. Т-лимфоциты убивают уже зараженные клетки, подавляя распространение вируса. В-лимфоциты производят антитела, которые нейтрализуют «свободно плавающие» в крови вирусы, не давая им прикрепиться к клеткам. После уничтожения вируса часть знакомых с ним лимфоцитов сохраняется, становясь клетками памяти. Если им снова встретится тот же вирус, иммунный ответ запустится быстрее. В результате инфекция пройдет легче или даже не вызовет симптомов.
Так возникает иммунитет к вирусам, хорошо известным человеку. Но SARS-CoV-2 с нами меньше года и пока неясно, у всех ли появляется иммунитет к вирусу. Также неизвестно, защитит ли иммунитет от повторного заражения, а если нет – будет ли болезнь протекать легче.
Спасут ли нас антитела к COVID-19?
Спойлер: У большинства переболевших людей вырабатываются антитела к вирусу. Но нет уверенности, что они защитят от повторного заражения.
Какую информацию дают тесты на антитела?
Всегда ли появляются антитела к COVID-19?
У большинства пациентов с COVID-19 независимо от наличия симптомов вырабатываются антитела, среди которых преобладают именно нейтрализующие. При этом у некоторых пациентов с легким течением инфекции таких антител может быть мало или совсем не быть. Как правило, выявить IgM в сыворотке можно, начиная с 5–7 дня после возникновения симптомов, а через 28 дней их уровень начинает падать. Обнаружить антитела IgG можно на 7–10 день, их количество начинает уменьшаться примерно через 49 дней. Падение уровня антител часто вызывает опасения, что защита ослабнет и иммунитет пропадет. Но после острой фазы инфекции антител всегда становится меньше, поскольку производящие их В-клетки живут недолго.
Как долго сохраняются нейтрализующие антитела?
Недавно ученые проанализировали данные 30 082 пациентов, переболевших COVID-19 в легкой и среднетяжелой форме. У большинства из них нейтрализующие антитела сохранялись в течение пяти месяцев. Но для получения более точной картины за пациентами нужно наблюдать и дальше – хотя бы в течение года.
Судя по единичным случаям повторного заражения, антитела не гарантируют пожизненного иммунитета к SARS-CoV-2. И это нормально для респираторных инфекций. Иммунитет к коронавирусам, вызывающим MERS и SARS, длится как минимум пару лет, а к коронавирусам, вызывающим простуду – не больше года. Однако наличие антител с большой вероятностью должно смягчить симптомы в случае реинфекции (повторного заражения).
А если антител мало?
Для защиты от SARS-CoV-2 важно не только количество, но и качество антител. Например, у многих выздоравливающих пациентов мало антител, зато они очень хорошо нейтрализуют вирус. Но определять качество антител сложнее и дольше, чем измерять их уровень, поэтому такой подход встречается редко.
Даже отсутствие антител еще не означает отсутствия иммунитета к вирусу. Защищать могут и выжившие В-клетки памяти. Уже на ранних этапах повторной инфекции они быстро размножаются, что приводит к росту уровня специфичных антител.
Главный вопрос – какой уровень антител необходим для защиты. Зная это, мы сможем проводить вакцинацию более эффективно.
Можно ли надеяться на Т-клетки?
Спойлер: Т-лимфоциты могут защитить от SARS-CoV-2, даже если в организме мало специфичных антител или они еще не появились. Именно Т-клетки, а не антитела, могут быть наиболее важными для возникновения стойкого иммунитета к вирусу.
Как меняется уровень Т-клеток при COVID-19?
Уровень Т-клеток повышается как у переболевших COVID-19, так и у получивших одну из экспериментальных вакцин. Специфичные Т-лимфоциты появляются уже в первую неделю после заражения, а Т-клетки памяти – через 2 недели и остаются в организме более 100 дней с начала наблюдения. Если человек перенес COVID-19 бессимптомно и не выработал антитела, единственный способ подтверждения болезни – определение уровня специфичных Т-лимфоцитов. Но оценивать их количество дольше и сложнее, чем измерять уровень антител, поэтому такой метод практически не используют.
Может ли Т-клеточный иммунитет к SARS-CoV-2 быть у тех, кто не болел?
Способные распознать SARS-CoV-2 Т-клетки есть у множества людей, никогда не встречавшихся с ним (судя по оценкам, у 20–50% популяции). Скорее всего, эти клетки возникают при заражении родственными коронавирусами – виновниками простуды. Структуры этих вирусов схожи, и Т-клетка, знакомая с одним из них, может распознать и другой – так возникает «перекрестная реактивность». При этом неизвестно, могут ли такие Т-клетки защитить от заражения SARS-CoV-2, повлиять на ход инфекции и ответ на вакцину. Нужно долго наблюдать за множеством добровольцев с предсуществующим иммунитетом, чтобы увидеть, кто из них заболеет и насколько серьезно.
Можно ли повторно заразиться COVID-19?
Спойлер: Подтвержденные случаи есть, но их мало, и они не позволяют прогнозировать течение заболевания. Скорее всего, случаев повторного заражения будет все больше.
Многие ли заболевают повторно?
Большинство людей до сих пор не заразилось COVID-19 в первый раз, не говоря о втором. Однако уже сейчас есть ограниченные, но убедительные данные о повторном заражении SARS-CoV-2 после выздоровления. Сообщения о таких случаях появлялись неоднократно с начала пандемии, но большая часть из них не была подтверждена. Важно различать настоящую реинфекцию и следы старого вируса, что не всегда просто из-за особенностей диагностики COVID-19.
Как подтвердить повторное заражение?
Стандартные тесты ищут в мазках и образцах слюны генетический материал SARS-CoV-2 – молекулу РНК. В отличие от самого вируса она может долго – до нескольких недель – сохраняться в организме и стать причиной ложноположительного результата теста. Может показаться, что человек снова заразился, и болезнь протекает бессимптомно, но на самом деле это не так. А бывает и ложноотрицательный результат, когда недостаточно чувствительные тесты не находят вирусную РНК, несмотря на присутствие вируса в организме.
Единственный надежный способ подтвердить реинфекцию – расшифровать вирусный геном. SARS-CoV-2 постепенно мутирует, в результате чего возникают его разновидности с небольшими отличиями в РНК – штаммы. Крайне маловероятно, что человек может снова заразиться тем же штаммом вируса. «Прочитав» РНК вируса из старых и новых образцов, а также оценив иммунный ответ в ходе инфекции, можно подтвердить повторное заражение.
Чего ждать при реинфекции COVID-19?
Повторное заболевание может быть как бессимптомным, так и протекать тяжелее, чем в первый раз. Легкое течение инфекции может быть обусловлено защитой Т-клеток, а осложненное – более агрессивным штаммом вируса, чувствительность которого к антителам уменьшилась из-за мутаций.
Когда у нас будет коллективный иммунитет?
Спойлер: Нескоро. Переболело слишком мало людей, и вакцины пока не появились в широком доступе.
Что такое коллективный иммунитет?
Согласно концепции коллективного иммунитета, распространение заболевания в популяции прекращается, когда большая ее часть приобретает устойчивость к возбудителю. У каждого заболевания свой порог защиты – доля людей, у которых должен выработаться иммунитет. Он может возникать естественным способом – после болезни, или искусственным – в результате вакцинации.
Правда ли, что всем нужно переболеть COVID-19?
Полагаться на возникновение группового иммунитета после свободного распространения SARS-CoV-2 – неэтичная и, возможно, неэффективная стратегия. По мнению ВОЗ, в большинстве стран вирусом инфицировано менее 10% населения – значит, до всеобщей устойчивости еще далеко. При летальности инфекции примерно 0,3–1,3%, цена достижения коллективного иммунитета естественным путем может быть слишком высока. Нельзя не учитывать и риск осложнений у пациентов с COVID-19, а также чрезмерную нагрузку на систему здравоохранения, возникающую при таком подходе. Кроме того, мы мало знаем о надежности естественной защиты: возможно, для возникновения стойкого иммунитета нужно будет переболеть несколько раз.
Последний факт может стать проблемой и для вакцинации – более безопасного способа добиться коллективного иммунитета. Если защитный эффект антител будет недолгим, а SARS-CoV-2 продолжит изменяться, нам придется постоянно модифицировать вакцины и прививаться с определенной периодичностью – как в случае с вирусом гриппа.
Пока никто не знает, как долго сохраняется иммунитет к SARS-CoV-2 и какой уровень антител и Т-клеток необходим для защиты. Но информация о новом коронавирусе постоянно обновляется, и со временем ученые найдут ответ на эти вопросы. Предварительные выводы делают на основе данных о родственных коронавирусах, а также исследований на животных и клинических испытаний вакцин, которые идут прямо сейчас. Кажется, что перенесенная инфекция в целом защищает от повторного заражения, подтвержденные случаи которого пока довольно редки. Но ситуация в любой момент может измениться – и к этому нужно быть готовым.
Благодарим врача-инфекциониста Оксану Станевич за помощь в подготовке текста
Иммунный ответ на коронавирус SARS-CoV‑2 у больных COVID‑19
Академик Российской академии наук, д.м. н., президент
ФБГУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России
В статье представлен анализ результатов исследований иммунного ответа и памяти к SARS-CoV‑2, включая все ветви адаптивного иммунитета, иммуноглобулины, В-клетки памяти, CD8+- и CD4+-T-клетки у больных в динамике в течение 6–8 месяцев после начала заболевания.
Гуморальное звено
Факт первичного иммунного ответа слизистых на COVID‑19 необычен и требует объяснения. Обсуждаются две гипотезы.
Первая: вирусы контаминируют слизистые дыхательных путей и ЖКТ за 7–14 дней до появления системного ответа и клинических проявлений инфекции, поражая клетки микробиоты — используют их для репродукции вируса.
Вторая: кросс-реактивная продукция антител, предпосылкой которой являются Spike-реактивные CD4+-Т-клетки, обнаруженные у большинства пациентов с COVID‑19 и более чем у 34 % неинфицированных людей. Это подтверждает существование общих эпитопов эндемичных коронавирусов, вызывающих банальные ОРВИ и COVID‑19.
Важно, что изотипы иммуноглобулинов (либо IgG, либо IgA) конкурировали за нейтрализующую активность по отношению к SARS-CoV‑2 в зависимости от локализации. Сывороточные антитела IgG сильно коррелировали с величиной IgG-ответа и тяжестью заболевания. У пациентов, например, с IgA-назальным ответом определялась высокая активность нейтрализации вирусов. Инфекция у таких больных протекала бессимптомно.
Это, с одной стороны, предполагает возможность нейтрализации вируса с помощью IgA слизистых без системного ответа, что имеет отношение к исходам заболевания. А с другой стороны, из-за множества корреляций, наблюдаемых между типами антител и их активностью в разных анатомических участках, клиническая интерпретация гуморального ответа существенно затруднена.
Кроме того, эти данные имеют важное значение для нашего понимания защиты вакцинации, индуцирующей системный ответ на вакцинные гены или белки коронавируса по классическому пути и обеспечивающей иммунный ответ слизистых оболочек на 3–6‑й неделе после вакцинации. В идеале вакцина должна не только защитить реципиента от неизбежной болезни, но и предотвратить бессимптомное носительство, что закрыло бы проблему бессимптомных носителей в популяции.
Титры Spike IgА и RBD IgА сохранялись на стабильном уровне на протяжении всего периода наблюдения t1/2— 210 дней, но у отдельных пациентов уровень специфических IgА-антител достоверно снижался через 90 дней.
Нельзя дать однозначный ответ в отношении серонегативных случаев COVID‑19. По-видимому, кроме протективного эффекта иммунитета слизистых, ответ напрямую связан с уровнем вирусной нагрузки SARS-CoV‑2. С одной стороны, высокие вирусные нагрузки связаны с более ранним ответом антител, в то время как у пациентов с низкой вирусной нагрузкой не может быть сероконверсии. С другой стороны, кинетика иммунного ответа может быть показателем скорости элиминации вируса у больного.
Идентификация специфичных В-клеток памяти к Spike, RBD и NCP с использованием флюоресцентно окрашенных зондов на IgD– и (или) CD27+ c последующей дифференцировкой по изотипам поверхностных IgM, IgG или IgA показала следующее. Количество специфических В-клеток увеличивалось в течение 120 дней после начала заболевания с последующим выходом на плато, в то время как Spike-специфические В-клетки памяти у людей, не заболевших COVID‑19, практически не встречались. RBD-специфические В-клетки появлялись на 16‑й день, и их количество увеличивалось в течение последующих 4–5 месяцев. Интересно, что только 10–30 % Spike-специфических В-клеток памяти было специфично для домена RBD через 6 месяцев после выздоровления больных.
NCP-специфичные В-клетки памяти также стабильно увеличивались в те же сроки и определялись спустя 5–6 месяцев после заболевания. Представленность изотипов иммуноглобулинов Spike-специфических В-клеток имела следующую динамику. В ранней фазе (20–60 дней) после заболевания IgM+ и IgG+ на В-клетках были представлены одинаково. В период после 60 дней до 240‑х суток преобладали IgG+ Spike-специфические В-клетки. Частота IgА+ Spike-специфических клеток составляла примерно 5 %, и они равномерно распределялись в течение всего периода наблюдения в 8 месяцев. Корреляция между сывороточным IgA и IgA слизистых оболочек не проводилась.
Сходная картина динамики наблюдалась и в случае IgG+, IgM+ и IgА+ к эпитопам RBD и NCP коронавируса. В то же время долгосрочное присутствие циркулирующих В-клеток памяти, направленных как против основных SARS-CoV‑2‑нейтрализующих таргетов (Spike и RBD), так и против не нейтрализующего таргета (NCP), свидетельствует о клеточной памяти, сохраняющейся после естественного воздействия вируса. Это может быть использовано для планирования ревакцинации. Тот факт, что почти все RBD- специфические IgG+-В-клетки памяти экспрессировали CD27, свидетельствует о долгосрочной иммунной памяти.
Анализ полученных данных говорит о том, что снижение нейтрализующих и других антител к SARS-CoV‑2 после клинического выздоровления вовсе мунитета. Просто с развитием и сохра- нением памяти В-клеток, способных активизироваться при встрече с новыми штаммами коронавируса, уровень антител в сыворотке снижается, в то время как IgА-ответ слизистых сохраняется на постоянном уровне в течении всего периода наблюдения.
Клеточный ответ
Процент больных с обнаруживаемыми циркулирующими CD8+-Т-клетками памяти через месяц после возникновения симптомов составил 70 %. К 6–9 месяцам клетки обнаруживались у 50 % выздоровевших пациентов. Фенотипические маркеры показали, что большинство SARS-CoV‑2‑специфичных CD8+-Т-клеток представлены терминально дифференцированными клетками памяти.
Циркулирующие SARS-CoV‑2‑специфичные CD4+-Т-клетки памяти через месяц после начала заболевания обнаруживались у 93 % пациентов. Через 6–9 месяцев уровень этих клеток был стабильным, а сами они выявлялись у более чем у 90 % пациентов, перенесших COVID‑19. Причем это касалось как Spike-специфичных, так и мембраноспецифичных CD4+-Т-клеток памяти.
Интересно, что при сравнении параметров иммунного ответа у больных с тяжелым и легким течением инфекции гуморальные показатели были более высокими у тяжелых больных, в то время как CD8+-Т-клетки были стабильными, а CD4+ — более низкими в тяжелых случаях заболевания. Объяснений этому феномену нет, важно, что слабый ответ Т-клеток наблюдается в острой фазе заболевания. Кроме того, важна и методология исследования клеточного им-мунитета.
Нарушения клеточного ответа проиллюстрированы дефицитом интерферонов I и II типов у пациентов с тяжелыми и среднетяжелыми формами COVID‑19 по сравнению с легкими и бессимптомными случаями заболевания. Это может быть связано с подавлением воспаления интерлейкином‑12 (IL‑12) и развитием вторичного дефекта клеточного иммунитета.
Иммунное взаимодействие
Большой интерес представляет изучение взаимодействия гуморального и клеточного ответа на SARS-Cov‑2. В исследованиях RBD-IgG, Spike IgА, RBD-В-клеток памяти, CD8+- и CD4+-Т-клеток в динамике у одних и тех же пациентов установлено, что у большинства из них (64 %) положительные показатели отмечались через 1–2 месяц после начала заболевания. Через 5–8 месяцев число реконвалесцентов, позитивных на пять тестов, снизилось до 43 %. В то же время как минимум три из пяти тестов были положительными спустя 6–9 месяцев. Важно отметить, что IgG на Spike дает на порядок больше положительных ответов, чем на RBD-антиген. Попытки связать гуморально- клеточные взаимодействия не привели к успеху из-за неоднородности участников исследования и методик оценки иммунного ответа.
Неопределенный результат
В метаанализе 22 исследований (4969 пациентов) установлены неблагоприятные признаки тяжелых форм болезни и летальных исходов, такие как лимфопения и нейтрофилез. Поскольку CD4+-Т-клетки необходимы для сбалансированного и эффективного иммунного ответа, неудивительно, что низкий уровень лимфоцитов может отражать гипервоспалительные процессы и способствовать более тяжелому течению заболевания и повышенной смертности.
Нейтрофилы как неотъемлемая часть врожденной защиты контролируют баланс микробиоты и элиминацию продуктов клеточной деструкции за счет производства активных форм кислорода и высвобождения нейтрофильных внеклеточных ловушек в венозном кровотоке. Лимфопения (менее 500 клеток в 1 мкл) указывает на повышение риска тяжелой формы заболевания и смертельных исходов при COVID‑19 в 3 раза. Стойкий нейтрофилез со сдвигом влево свидетельствует об истощении костномозгового резерва, а при сдвиге вправо отражает нарушения выхода клеток в ткани. Этот легко контролируемый анализом крови параметр указывает на более чем семикратное увеличение для пациента риска заболеть тяжело и погибнуть от COVID‑19.
Попытки выявить закономерности иммунного ответа на SARS-CoV‑2 оказались пока безуспешными.
Во-первых, можно сделать вывод, что переболевшие коронавирусной инфекцией сохраняют иммунную память в последующие 6–9 месяцев. Дальнейшие динамические исследования покажут, в какие сроки наступает снижение иммунного ответа, требующее профилактической вакцинации и (или) ревакцинации.
Во-вторых, и это очень интересно, каждый изученный компонент иммунного ответа и иммунной памяти демонстрирует различную кинетику. Это связано с индивидуальным ответом на инфекцию, наличием преморбида и частого превращения моноинфекции в смешанные инфекции SARS-CoV‑2 с активизировавшейся микробиотой больного.
В-третьих, неоднородность ответа может быть центральным признаком, характеризующим иммунную память к SARSCoV‑2. Биологические специфические IgG имеют 21 день периода полураспада, уровень антител с течением времени отражает продукцию короткоживущих, а потом и долгоживущих плазматических клеток. С точки зрения исчезновения возбудителя в течение нескольких дней после появления клиники, процесс наработки антител должен быть снижен к 6 месяцам, но, если SARS-CoV‑2 Spike и RBD IgG сохраняются дольше 8 месяцев, это означает, что вирус персистирует в организме хозяина или его микробиоте. Нельзя исключать и связь с пролонгированным иммунным ответом естественной реиммунизации циркулирующими эпидемическими альфа-коронавирусами, поддерживающими иммунный ответ.
В-четвертых, выявление и анализ SARSCoV‑2‑специфических В-клеток памяти потенциально могут применяться в качестве маркера гуморального ответа при вакцинации. Сейчас исследования поствакцинального иммунного ответа проводятся с использованием иммунофлуоресцентного анализа с оценкой IgM- и IgG-антител в качестве маркеров эффективности вакцины (рис. 3). Методы ИФА-диагностики, к сожалению, не стандартизованы едиными белками S, RBD, NCP, качество которых зависит от очистки антигена. Поскольку количество В-клеток памяти стабильно с течением времени, они могут представлять собой более надежный маркер продолжительности гуморальных иммунных реакций, чем иммуноглобулины сыворотки крови.
Таким образом, из результатов исследований иммунного ответа у больных COVID‑19 невозможно сделать какие-либо выводы о защитном иммунитете при новой коронавирусной инфекции. Ведь изучение антител и клеток памяти при этом заболевании пока еще не завершено. А значит, обсуждаемые механизмы защитного иммунитета против SARS-CoV‑2 у людей окончательно не определены.
Источник: Газета «Педиатрия сегодня» №6, 2021
Иммунитет и коронавирус. Академик Тотолян о механизмах иммунного ответа
Еще несколько месяцев назад мир не знал о существовании вируса, который изменит жизнь более 7,5 миллиардов человек. Сегодня ученые всего мира пытаются найти вакцину и действенное лекарство для борьбы с пандемией. Однако постепенно ученые узнают больше подробностей о новом вирусе. Так, стало известно, что SARS-CoV-2 в некоторых случаях избегает иммунного ответа и приостанавливает выработку важной молекулы — интерферона. Как коронавирусу это удается? Объясняет иммунолог, академик Арег Тотолян.
Арег Артемович Тотолян — директор Санкт-Петербургского института эпидемиологии и микробиологии имени Пастера, доктор медицинских наук, профессор, академик РАН.
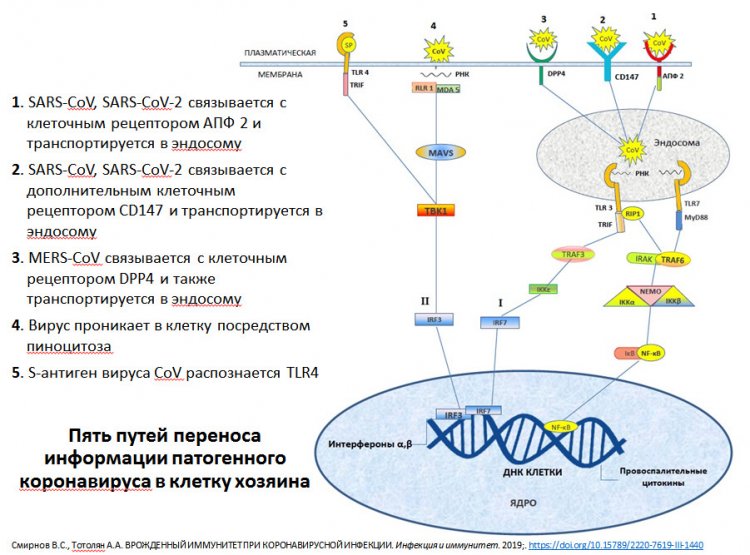
— Как вирус SARS-CoV-2 проникает в клетку?
— Первая и основная клетка, в которую проникает вирус — эпителиальная. Прежде всего, речь идет об эпителиальных клетках верхних дыхательных путей. Ведь основные ворота для проникновения вируса — это носоглотка и ротоглотка. При дальнейшем успешном развитии инфекции поражаются средние и нижние дыхательные системы.
В части случаев вирус поражает и другие органы и системы человека — желудочно-кишечный тракт и почки. Об этом свидетельствует соответствующая симптоматика — диарейный синдром и почечная недостаточность.
Когда в январе 2020 году инфекция стала известна широкому кругу специалистов, считалось, что единственный путь попадания вируса в клетку осуществляется с помощью ангиотензинпревращающего фермента — рецептора, получившего название ACE2. Но оказалось, что существует второй рецептор, который выполняет функцию входных ворот для вируса в клетку — CD147. Чем он примечателен?
Схема путей переноса информации патогенного коронавируса в клетку хозяина. Из презентации А.А. Тотоляна
Этот белок располагается на поверхности или мембране клетки. Против него уже существует моноклональное антитело — то есть лекарственный препарат, который применяют при лечении некоторых онкологических заболеваний. Поэтому в ряде зарубежных странах были инициированы клинические исследования этого препарата как возможного кандидата для лечения COVID-19. Исследования продолжаются, но пока результатов нет. Если этот препарат окажется эффективным, то это значительно упростит ситуацию, а главное — сэкономит время.
Вернемся к вопросу. Вирус, проникая в клетку, запускает целый ряд механизмов, которые приводят к развитию дефектов. Нормальная клетка при проникновении чужеродного микроорганизма ведет себя соответствующим образом. Одно из проявлений ее поведения связано с выработкой интерферона.
— Что собой представляет интерферон и каково его место в иммунной системе?
— Интерфероны — это семейство белковых молекул, которые продуцируются различными клетками организма человека и обеспечивают, в том числе, противовирусный иммунитет. При этом интерфероны обладают неспецифической активностью, то есть действуют не на возбудителя какого-то конкретного заболевания, а на любые вирусные частицы в целом. На сегодняшний день известно целое семейство интерферонов — 20 разных молекул, объединенных одним названием.
Наиболее известными являются три интерферона: альфа, бета и гамма. Об остальных говорить не буду. Даже если читатели запомнят три указанных представителя семейства интерферонов, этого вполне достаточно для общего понимания. Интерферон-альфа обладает истинной противовирусной активностью, чуть слабее — интерферон бета. Интерферон гамма напрямую не обладает противовирусной активностью. У него другая функция — иммунорегулирующая. Он принимает самое активное участие в регуляции иммунного ответа, во взаимодействии врожденного и адаптивного иммунитета.
Поэтому, в первую очередь, нас интересует интерферон альфа. По идее эпителиальные клетки должны были вырабатывать интерферон альфа и гамма при встрече с коронавирусом. Но в отношении интерферона альфа этого не происходит. Почему? Дело в том, что у вируса SARS-CoV-2 есть определенные механизмы, с помощью которых он подавляет не только продукцию интерферона, но и сам синтез.
— Как ему это удается?
— Эти процессы происходят на молекулярном уровне. Они приводят к дефекту эпителиальной клетки, после чего она не может продуцировать интерферон альфа. Этот факт имеет множество последствий для организма. Чтобы не допустить этого, специалисты проводят заместительную терапию с помощью препаратов на основе интерферона альфа, которые позволяют восполнить дефицит.
— Так мы помогаем иммунитету?
— Да, верно. Мы вводим интерферон извне, тем самым компенсируя дефект, вызванный вирусом. Препараты на основе интерферона альфа особенно должны быть эффективны на ранних этапах, пока инфекция не спустилась в нижние отделы дыхательных путей.
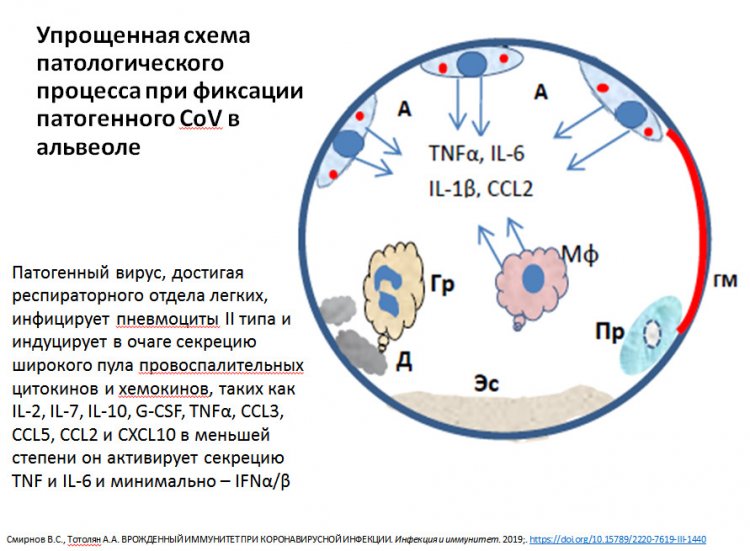
А интерферон гамма, напротив, важен на поздних этапах, когда инфекция сопровождается пневмонией и так называемым цитокиновым штормом.
Дело в том, что клетки иммунной системы «общаются» между собой с помощью самых разных молекул, которые называются цитокинами. В ответ на инфекцию они, естественно, синтезируются более активно. Поначалу эти молекулы выполняют защитную функцию, привлекая в очаг воспаления всё больше иных молекул и клеток. Но наступает момент, когда ситуация выходит из под контроля, и цитокины продуцируются в огромном количестве, тем самым нанося вред самому организму. И именно здесь важную роль играет интерферон гамма, который как раз запускает синтез целого ряда цитокинов. Поэтому целесообразно применять терапию с помощью антицитокиновых препаратов, чтобы нормализовать этот процесс.
Если цитокинового шторма нет, применять препараты для антицитокиновой терапии нельзя. Ведь так мы добьемся диаметрально противоположного результата. Выключение любого нормально функционирующего компонента иммунной системы приводит к развитию иммуносупрессии — дефекта иммунной системы.
Схема патологического процесса при фиксации вируса в альвеоле. Из презентации А.А. Тотоляна
— Давайте поговорим об особенностях протекания болезни COVID-19. Почему она поражает именно легкие? Вирусу комфортнее в этой среде или есть какие-то другие объяснения?
— Просто вирусу проще попасть в организм через нос или рот, а затем в легкие. А в ряде случаев, как я уже упоминал, он попадает в желудочно-кишечный тракт.
Иммунная система очень многогранна и распространена по всему организму, имея «представительства» практически во всех органах и тканях. Если иммунная система желудочно-кишечного тракта не справляется с ситуацией, значит, вирус с большей вероятностью там поселится. Такая же ситуация обстоит с почками. Скажем, если пациент страдает сахарным диабетом, то его почки также находятся в поврежденном состоянии. Следовательно, вирус может задержаться именно в почках.
— Сейчас многие научные коллективы ищут вакцину и лекарство против нового коронавируса. На чем они будут основаны?
— Начнем с вакцин. Сегодня как минимум 8 коллективов в России занимаются разработкой вакцины. Если ее удастся создать, то она поможет нам со второй волной пандемии. По разным оценкам, вирус может приобрести сезонный характер.
Я не думаю, что мы успеем использовать вакцину в нынешней ситуации. Скорее всего, пандемия завершится до того, как вакцина получит путевку в жизнь. Это работа, прежде всего, на перспективу. По сути, вакцина — это долгосрочная профилактика. Ее появление позволит нам быстро сформировать иммунизированную прослойку, которая будет защищать остальных.
Ведь мы не можем иммунизировать всех подряд. Существуют определенные ограничения, которые не позволяют использовать одну и ту же вакцину для всех. Есть также пациенты с иммунодефицитом, приобретенным или врожденным. Для таких групп пациентов некоторые вакцины просто противопоказаны. Именно поэтому 100%-я вакцинация не достигается. Но она, по существу, и не нужна. Согласно теории коллективного иммунитета, достаточно 70% населения с иммунитетом к вирусу, чтобы избежать пандемии.
Если говорить о лечении, то наиболее эффективными специфичными против вируса иммунопрепаратами должны стать терапевтические моноклональные антитела — антитела, вырабатываемые иммунными клетками, принадлежащими к одному клеточному клону, то есть произошедшими из одной плазматической клетки-предшественницы. Пока таких препаратов в нашем распоряжении нет, клиницисты идут другим путем: переливают плазму реконвалесцентов, то есть выздоравливающих людей. В крови выздоровевших имеются специфические антитела. Их плазму крови вводят тем, кто наиболее тяжело переносит заболевание.
— Какие препараты, разрабатываемые сегодня, будут наиболее перспективными?
— На первое место я бы поставил терапевтические антитела. Моноклональные антитела, как я уже говорил, это препараты, которые обладают высокой селективностью в отношении молекулярной мишени. Антитела обладают способностью точно связываться с антигеном благодаря специальным антигенсвязывающим участкам, имеющим к нему высокую специфичность. Это определяет селективность лекарств на основе антител в отношении конкретной мишени.
Вторые по значимости — пептиды, которые могут обладать активностью против вируса. В своих исследованиях мы решили пойти как раз по этому пути. Как нам кажется, результаты могут оказаться весьма перспективными.
Это то, что касается перспектив иммунотерапии. Пациенты, особенно с тяжелыми формами заболевания, получают самое разнообразное лечение и в части применяемых препаратов, и в части медицинских технологий. В этом вопросе «карты в руки» клиницистам, которые непосредственно ведут этих пациентов, прежде всего, реаниматологам и пульмонологам.
Интервью осуществлено при поддержке Министерства науки и высшего образования РФ и Российской академии наук