Синдром бланда уайта гарланда что это
Синдром бланда уайта гарланда что это
Этот порок встречается с частотой 0,25—0,5% от всех врожденных пороков сердца. В бассейне кровоснабжения левой коронарной артерии — передне-боковой стенке левого желудочка и верхушке сердца при патолого-анатомическом исследовании определяются субэндокардиальные или трансмуральные инфаркты, аневризмы миокардиальной стенки в этих областях, субэндокардиальный фиброэластоз.
Кровообращение и гемодинамика. Установлено, что кровь в левую коронарную артерию поступает нет из легочной артерии, а через межкоронарные анастомозы из правой коронарной артерии. Поэтому степень коронарной недостаточности и выживаемость новорожденных и грудных детей определяются развитием коллатерального кровотока в миокарде на момент рождения ребенка и его развитием в динамике.
Определенное значение имеет также тип коронарного кровообращения. При правом типе кровообращения течение этого порока более благоприятное. Ишемия миокарда у детей может возникать в случае так называемого коронарного steal-синдрома, или «синдрома обкрадывания», когда кровь через коллатерали уходит из правой коронарной артерии в левую и далее в легочную артерию из-за низкого перфузионного давления в легочной артерии. В этом случае особенно страдает эндокардиальный кровоток, что и является одной из причин формирования фиброэласто-за эндомиокарда.
Клинически у большинства детей заболевание впервые проявляется в первые 3 мес жизни. Появляются вялость, бледность кожных покровов, повышенная потливость, рвота, срыгивание, одышка, тахикардия. У части больных первыми признаками болезни являются приступы внезапного беспокойства с появлением одышки, бледности, потливости. Такие приступы возникают обычно после и во время кормления и продолжаются в течение нескольких минут. Во время приступа лицо новорожденного становится страдальческим, он пронзительно кричит, вытягивает ноги, определяется нитевидный пульс. После приступа иногда повышается температура тела, доходящая до 38 градусов, но через несколько часов она нормализуется. У части младенцев приступы одышки и беспокойства сопровождаются однократным или двухкратным жидким стулом.
Диагностика острой очаговой ишемии и свежих инфарктов миокарда, обусловливающих клиническую картину описанных приступов, а также состояние систолической функции желудочков, осуществляется с помощью электрокардиографии и двухмерной эхокардиографии.
Коррекция. На ранних этапах выявления заболевания проводится терапия сердечной недостаточности, затем решается вопрос о хирургической коррекции порока для ликвидации steal-синдрома путем перевязки левой коронарной артерии. Однако эта операция не является радикальной в связи с тем, что она превращает коронарную систему сердца в систему одной коронарной артерии с появлением риска внезапной смерти. В настоящее время разработаны другие виды оперативного вмешательства, позволяющие существенно продлить жизнь больных.
Прогноз без оперативного вмешательства неблагоприятный: около 2/3 больных умирают на первом году жизни, около 15% детей доживают до старшего возраста. Причиной внезапной смерти является физическая нагрузка или психическая травма.
Аномальное отхождение правой коронарной артерии от легочной артерии
Такая аномалия развития коронарной артерии встречается редко и относится к группе гемодинамически незначимых пороков,
В этом случае правая коронарная артерия отходит от правого легочного синуса, при этом кровь из нормально отходящей левой коронарной артерии через межкоронарные анастомозы поступает в правую коронарную артерию и затем в легочную артерию.
• При значительном левоправом сбросе развивается ишемия миокарда правого желудочка с возможным развитием сердечной недостаточности.
• При преимущественно правом типе кровообращения порок переходит в разряд неблагоприятных. Это происходит из-за того, что правая коронарная артерия снабжает кровью миокард правого желудочка, заднюю часть межжелудочковой перегородки и заднюю часть левого желудочка — постоянный дефицит коронарного кровотока в этих областях может приводить к формированию фиброэластоза в обоих желудочках сердца. Коррекция. Радикальное лечение сводится к оперативной коррекции порока.
Аномальное отхождение единой коронарной артерии от легочной артерии
Это редкий порок развития коронарных артерий. Аномальное отхождение единой коронарной артерии от легочной артерии — порок, несовместимый с жизнью, если нет сопутствующего дефекта межжелудочковой перегородки или открытого артериального протока.
В этом случае единая коронарная артерия после отхождения от легочной артерии делится на правую и левую. Миокард желудочков снабжается кровью из легочной артерии с низким содержанием кислорода и под низким давлением, что и является причиной ишемии миокарда ребенка с момента его рождения.
У младенцев с сопутствующим пороком сердца состояние менее тяжелое, так как кровь в единственную коронарную артерию поступает под более высоким давлением.
Аномальное отхождение левой коронарной артерии от правого синуса Вальсальвы
Эта аномалия развития относится к группе гемодинамически значимых и составляет основную ее часть.
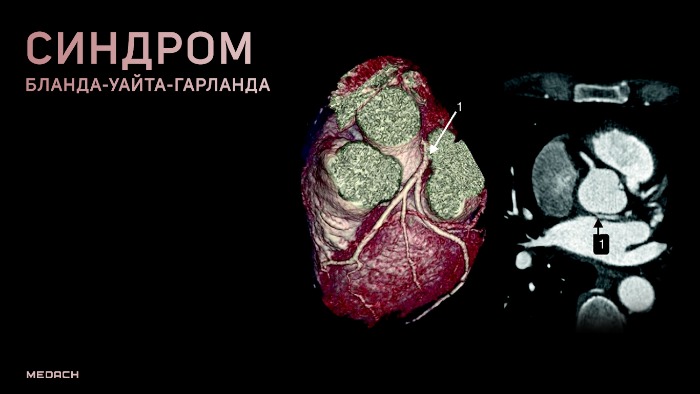
Синдром Бланда — Уайта — Гарленда
Бланда — Уайта — Гарленда синдром (Е. F. Bland, P. D. White, J. Garland, амер. ученые) — клинический симптомокомплекс, в основе которого лежит врожденное аномальное отхождение коронарных артерий сердца от легочного ствола (truncus pulmonalis). Первое упоминание об этой патологии принадлежит Бруксу (Н. Brooks, 1886). Аботт (М. Е. Abott, 1908) и А. И. Абрикосов (1911) впервые описали отхождение левой коронарной артерии от легочного ствола. В 1933 г. эта аномалия была представлена как синдром.
Различают 4 варианта этой аномалии: отхождение левой, правой, обеих и добавочной коронарных артерий от легочного ствола. В настоящее время описано свыше 200 наблюдений этой аномалии, причем в последние годы появились публикации прижизненной ее диагностики и хирургического лечения. По Кейту (Keith, 1959) аномальное отхождение левой коронарной артерии встречается в одном случае на 300 000 новорожденных; правой — в 10 раз реже [Эдварде (I. Edwards)].
Клиника
Аномалия развития сосудов сердца, при которой левая коронарная артерия отходит от легочного ствола; проявляется признаками сердечной недостаточности (цианозом, симптомами стенокардии, изменениями ЭКГ типа инфаркта миокарда) с 2-х — 3-х месячного возраста, при отсутствии сердечных шумов.
Лучевая диагностика.
Резкое увеличение размеров сердца. При ангиографии выявляется аномалия отхождения левой коронарной артерии
СБУГ — Аномальное отхождение коронарной артерии от легочной артерии
В современной кардиологии за названиями пороков часто закрепляется сокращенное название — аббревиатура (а за названиями операций — фамилии врачей, впервые предложивших методику, например, операция Фонтена). Обычно эти аббревиатуры образуются от слов в названии порока — ДМЖП (дефект межжелудочковой перегородки), ОАП (открытый артериальный проток) и др. Краткое название порока «аномальное отхождение коронарной артерии от легочной артерии» образовано по другому принципу: от первых букв имен врачей, которые впервые описали этот порок – Блант, Уайт, Гарланд, а буква «С» вначале аббревиатуры означает «синдром».
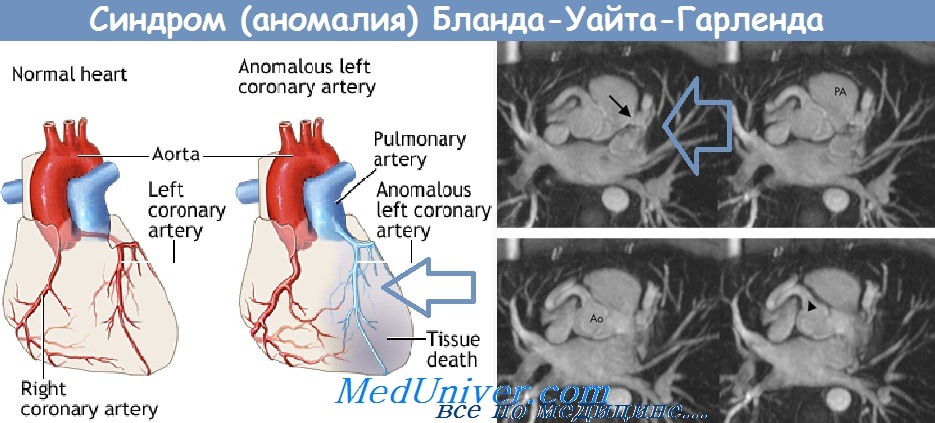
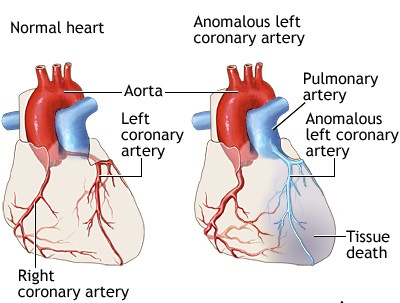
В правильно развитом сердце обе коронарные, или венечные, артерии, которые несут артериальную кровь для самого сердца, отходят от начала восходящей аорты, у самого ее корня. Это ее первые, важнейшие ветви, благодаря которым сердце получает свой кислород и питательные вещества.
При пороке сердца СБУГ, который мы сейчас рассматриваем, одна из коронарных артерий начинается не от аорты, а от рядом лежащей легочной артерии, в которой содержится венозная, а не артериальная кровь. Чаще всего это происходит с левой, т.е. главной артерией, которая питает большую часть сердечной мышцы.
Что же при этом происходит?
Во внутриутробной жизни обе коронарных артерии получают кровь под одинаковым давлением, т.к. в легочной артерии давление почти равно давлению в большом круге, а разница в насыщении крови кислородом незначительна.
Но после рождения условия кровотока в сердце резко меняются. По правой артерии продолжается поступление артериальной крови из аорты. А левая, а вместе с ней и вся масса мышц левого желудочка, получает артериальную кровь только через мелкие обходные пути, так называемые «коллатерали», из системы той же правой артерии. Из левой артерии часть крови вытекает в легочную артерию, не успев попасть в сосудистую сеть и отдать содержащийся в ней кислород. Происходит то, что называется «синдромом воровства». Для мышцы сердца такое воровство опасно: левые отделы начинают очень быстро страдать от недостатка кислорода и питательных веществ, а вся картина чрезвычайно напоминает и, в сущности, является ишемической коронарной болезнью, столь хорошо известной всем. У СБУГ и у ишемии, которая часто развивается у людей пожилого возраста, совершенно разные причины. Однако, следствия очень похожи: сердечная недостаточность, инфаркты сердечной мышцы, сопровождающиеся сильнейшими болями, о которых грудной ребенок не может ничего сказать.
Симптоматика чаще всего проявляется в течение первых 4-х месяцев, а если ничего не будет предпринято, то до своего первого дня рождения не доживут почти 90% детей с этим пороком. У части детей коллатерали развиваются хорошо и дети могут перенести период новорожденности, но, тем не менее, требуют хирургической помощи.
Катетеризация сердца позволит точно определить место расположения устья левой коронарной артерии.
Методов хирургической коррекции несколько. Прежде всего, можно просто перевязать устье аномальной левой коронарной артерии. Это прекратит утечку, повысит давление в коронарном бассейне и значительно улучшит питание сердечной мышцы. Сегодня закрытие устья может быть сделано без операции, в рентгенохирургическом кабинете. Но, даже если это невозможно, то операция перевязки достаточно проста, не требует искусственного кровообращения и может быть выполнена в любой детской кардиохирургической клинике.
В ряде случаев можно наложить анастомоз между подключичной и коронарной артерией, перевязав ее устье. Это тоже закрытая операция. Обе они — паллиативны, т.е. не решают главной задачи: восстановление нормальной двукоронарной системы снабжения сердца кровью.
Понятно, что это можно решить только с помощью «пересадки» устья левой веночной артерии от легочной в аорту, туда, откуда она должна отходить. Для этого предложено несколько вариантов операций, и детали вам должен объяснить оперирующий вашего ребенка хирург.
Операция непростая, довольно длительная, выполняется в условиях искусственного кровообращения, и, что самое важное — не частая, т.к. этот порок встречается достаточно редко. Поэтому значительным опытом обладают только крупные центры, имеющие постоянный поток больных с врожденными пороками сердца.
Синдром Бланда-Уайта-Гарланда
Общие сведения
Синдром Бланда-Уайта-Гарланда (СБУГ, синдром BWG) – аномальное ответвление коронарных артерий, кровоснабжающих сердечную мышцу, от легочного ствола. В кардиологии синдром Бланда-Уайта-Гарланда составляет 0,5% от всех врожденных пороков сердца. Клинические признаки порока были изучены и описаны в 1933 г. американскими кардиологами E. Bland, P. White, J. Garland, в честь которых данная аномалия получила название «синдром Бланда-Уайта-Гарланда». Синдром Бланда-Уайта-Гарланда в 2 раза чаще наблюдается у девочек, чем у мальчиков.
Синдром Бланда-Уайта-Гарланда обычно встречается в изолированном виде, однако может сочетаться с другими пороками: дефектом межпредсердной перегородки (ДМПП), дефектом межжелудочковой перегородки (ДМЖП), тетрадой Фалло, коарктацией аорты, открытым артериальным протоком, транспозицией магистральных сосудов.
Причины
Синдром Бланда-Уайта-Гарланда формируется вследствие неправильной эмбриональной закладки венечных артерий. Предложено несколько гипотез, объясняющих эмбриогенез порока:
Факторы риска, предрасполагающие к развитию синдрома Бланда-Уайта-Гарланда, на сегодняшний день неизвестны; четкая связь и с какими-либо генетическими нарушениями не выявлена.
Патогенез
В норме левая коронарная артерия берет начало от левого синуса Вальсальвы, а при синдроме Бланда-Уайта-Гарланда отходит от корня легочного ствола. Ее дальнейшее ветвление, как правило, остается нормальным. Особенности внутрисердечного кровообращения при синдроме Бланда-Уайта-Гарланда, прежде всего, определяются соотношением давлений в аорте и легочной артерии.
Во внутриутробном периоде давление в легочном стволе и насыщение крови кислородом сопоставимы с аортой, поэтому аномальная левая венечная артерия обеспечивает нормальный кровоток и адекватное кровоснабжение сердечной мышцы. При рождении происходит снижение давления в легочной артерии, в результате чего часть миокарда, кровоснабжаемая аномально расположенной коронарной артерией, получает недостаточный объем слабо оксигенированной крови. Снижение коронарной перфузии сопровождается тяжелой ишемией миокарда, дисфункцией и прогрессирующим повреждением участка сердечной мышцы.
Вместе с этим, постепенно формируются межкоронарные анастомозы, обусловливающие поступление крови в аномальный сосуд не только из легочной артерии, но и из правой коронарной артерии, отходящей от аорты. По мере увеличения количества межкоронарных анастомозов направление тока крови в аномальной артерии изменяется, формируется сброс из венечного русла в легочную артерию, что приводит к развитию «феномена обкрадывания», т. е. ухудшению кровоснабжения миокарда в бассейне нормально расположенной правой коронарной артерии. Это сопровождается дальнейшим ишемическим повреждением миокарда и усугублением его дисфункции.
Характер коронарной гемодинамики может существенно изменяться при наличии сопутствующих ВПС, протекающих с легочной гипертензией (ДМПП, ДМЖП и др.). Это в известной мере затрудняет прижизненную диагностику синдрома Бланда-Уайта-Гарланда.
Таким образом, в течении синдрома Бланда-Уайта-Гарланда различают 3 патофизиологические фазы.
Классификация
Различают четыре анатомических варианта синдрома Бланда-Уайта-Гарланда: аномальное отхождение левой, правой, обеих или добавочной венечных артерий от ствола легочной артерии. Статистически чаще встречается неправильное ответвление левой коронарной артерии. Также принято выделять два типа синдрома, различающиеся клинической картиной:
Симптомы
Клинические проявления синдрома Бланда-Уайта-Гарланда, прежде всего, зависят от его варианта. Инфантильный тип обычно заявляет о себе в возрасте 2-3 месяцев. При этом отмечаются затруднения при кормлении ребенка (так называемая стенокардия кормления): учащенное храпящее дыхание, одышка, потливость, бледность кожных покровов, цианоз губ, кашель, регургитация, рвота. Приступы также могут провоцироваться дефекацией, криком, любым физическим усилием, интеркуррентными инфекциями.
Дети вялые, быстро утомляются, медленно увеличивают массу тела. Объективно определяется расширение границ сердца, глухость сердечных тонов, тахикардия, систолический шум и ритм галопа, увеличение печени, влажные хрипы в легких. Позже присоединяются отеки подкожной клетчатки, гидроторакс, асцит. Синдрома Бланда-Уайта-Гарланда является наиболее частой причиной развития инфаркта миокарда у детей. Более 90% детей с инфантильным типом погибают в течение первого года жизни от тяжелой сердечной недостаточности, нарушений ритма и проводимости сердца.
Диагностика
Диагностика синдрома Бланда-Уайта-Гарланда осуществляется с помощью электрокардиографии, эхокардиографии, рентгенографии грудной клетки, коронарографии, аортографии, левой вентрикулографии, зондирования полостей сердца, МРТ и МСКТ сердца.
В заключительной фазе развития синдрома Бланда-Уайта-Гарланда катетеризация сердца обнаруживает повышенную артериализацию крови на уровне легочного ствола, обусловленную выраженным лево-правым сбросом крови. Левая вентрикулография выявляет дилатацию полости желудочка, признаки митральной недостаточности. С помощью МРТ и МСКТ сердца определяется местоположение венечных артерий, выявляется сопутствующая патология сердца и сосудов.
Лечение синдрома Бланда-Уайта-Гарланда
Больные с синдромом Бланда-Уайта-Гарланда нуждаются в консультации кардиохирурга и тщательном обследовании с целью определения показаний и противопоказаний к оперативному лечению. Различные хирургические методы коррекции синдрома Бланда-Уайта-Гарланда направлены на обеспечение адекватного кровоснабжение миокарда в бассейне левой венечной артерии.
В случае хорошо развитого коллатерального кровообращения производится перевязка устья аномальной коронарной артерии (лигирование фистулы коронарной артерии). В этом случае всю нагрузку по кровоснабжению миокарда берет на себя нормальная правая коронарная артерия.
Другим вариантом коррекции синдрома Бланда-Уайта-Гарланда является шунтирование аномально отходящей левой коронарной артерии с помощью внутригрудных артерий (маммарокоронарное шунтирование). При синдроме Бланда-Уайта-Гарланда возможно проведение транслокации устья левой коронарной артерии в аорту, соединение левой венечной артерии и аорты с помощью тоннеля внутри легочного ствола.
Прогноз
Естественное течение синдрома Бланда-Уайта-Гарланда ассоциировано с высоким риском смерти в раннем детском (инфантильный тип) или молодом возрасте (взрослый тип). Отхождение правой коронарной артерии от ствола легочной артерии встречается крайне редко, не приводит к каким-либо клинически значимым поражениям сердца и совместимо с нормальной жизнью. Случаи отхождения обеих венечных артерий от легочного ствола прогностически неблагоприятны и приводят к гибели больных в течение первых 2-х недель жизни.
Существенно улучшается прогноз при своевременном выявлении и адекватной кардиохирургической коррекции синдрома Бланда-Уайта-Гарланда.
Cиндром Бланда-Уайта-Гарланда
Аномалии коронарных артерий — почти terra incognita для современной кардиологии, в то же время, по разным данным, они обнаруживаются у 0,6 % – 5,64 % кардиологических пациентов, однако есть вероятность, что частота встречаемости намного выше. Недостаточно изучены анатомические варианты коронарных сосудов, их патофизиологическое и клиническое значение, прогноз, вследствие чего нет обоснованных рекомендаций по лечению пациентов, часты ошибки в диагностике и выборе лечения.
В подавляющем большинстве случаев аномалии коронарных артерий обнаруживаются посмертно, не являясь причиной смерти, или случайно при инструментальном исследовании по другому поводу и в течение жизни не вызывают патологических состояний. Таким образом, существуют предпосылки для определения новых «нормальных» вариантов анатомии коронарных сосудов, на что указывает P. Angelini в своих работах, предлагая идентифицировать коронарные сосуды по особенностям их средних и дистальных сегментов или микрососудистого бассейна, а не места отхождения и хода проксимальных сегментов.
Аномальное отхождение левой коронарной артерии от легочной артерии (ALCAPA — anomalous origin of the left coronary artery from the pulmonary artery), или синдром Бланда-Уайта-Гарланда (СБУГ), относится к редким врожденным порокам сердца (1 на 300 тысяч новорожденных) и составляет 0,25 % от всех ВПС.
СБУГ относится к гемодинамически значимым («большим») аномалиям коронарных артерий (КА). В 5% случаев сопровождает другие ВПС: открытый артериальный проток, дефект межжелудочковой или межпредсердной перегородки, тетраду Фалло, коарктацию аорты. Без должного лечения прогноз неблагоприятный. Средний возраст появления угрожающих жизни состояний при СБУГ составляет 33 года, а внезапной сердечной смерти — 31 год. Женщины болеют чаще.
Анатомическое описание порока впервые дал в 1911 году русский патологоанатом А.И. Абрикосов, описавший вскрытие 5-месячного ребенка с аневризмой левого желудочка. Исчерпывающее описание синдрома впервые дали E. Bland, P. White и J. Garland, работавшие в Массачусетской больнице общего профиля, в 1933 году.
Они описали случай 3-месячного ребенка с прогрессирующими проблемами с кормлением, кардиомегалией, выявленной при рентгенографии грудной клетки, и ЭКГ-признаками поражения левого желудочка. На вскрытии было обнаружено, что левая коронарная артерия (ЛКА) отходила от легочной артерии (ЛА). Эффективное лечение этой патологии нашлось только в 1960 году, когда Sabiston et al. показали наличие ретроградного тока крови из ЛКА в ЛА. Лигирование аномальной ЛКА в месте отхождения от ЛА спасло жизнь больному ребенку.
Аномальное отхождение ЛКА от ЛА возникает в эмбриогенезе в результате нарушения разделения конотрункуса перегородкой на аорту и ЛА или сочетания персистирования эндокардиальных подушек в легочной артерии и их дефективной инволюции в аорте. Генетические предпосылки заболевания не изучены. Предполагают, что причиной могут служить мутации в генах CFTR (трансмембранный регулятор муковисцидоза), MEN1 (множественная эндокринная неоплазия типа 1) и PKP2 (плакофилин-2).
Клиническая картина СБУГ
Спектр клинических проявлений СБУГ многообразен. Различают инфантильный и взрослый типы заболевания.
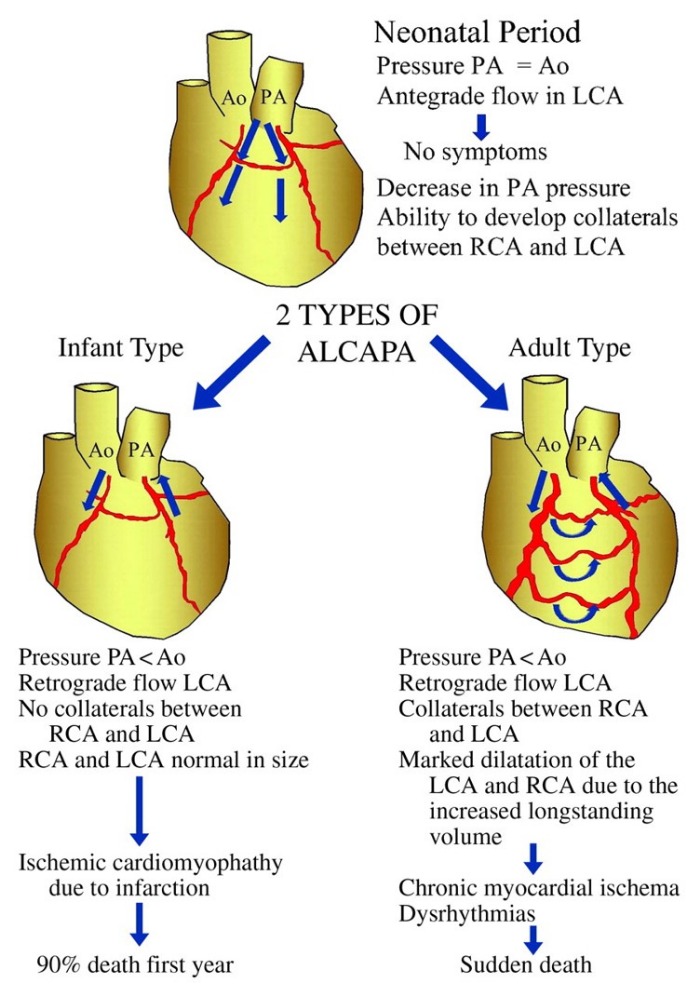
При инфантильном, или летальном, типе СБУГ (85–90 % случаев) симптомы манифестируют обычно на втором месяце жизни. Новорожденные выглядят здоровыми, поскольку относительно высокое сопротивление ЛА пока еще поддерживает антероградный ток крови по аномальной ЛКА, а фетальный гемоглобин обеспечивает миокард кислородом. На 1–2 месяце жизни ребенка сопротивление сосудистого русла легких падает в связи с закрытием артериального протока, что ведет к уменьшению антероградного тока крови и перфузии миокарда.
Классические симптомы (приступы беспокойства, плача, колик, одышки, бледность, цианоз, потливость, срыгивание, сложности с кормлением), описанные Bland et al. в 1933 г., позволяют заподозрить патологию коронарных артерий. Как правило, приступы беспокойства возникают после или во время кормления или плача, когда повышается потребность миокарда в кислороде, и длятся несколько минут. Между приступами ребенок выглядит здоровым. Больные дети отстают в физическом развитии.
При осмотре обнаруживается расширение сердечной тупости, сердечный горб, аускультативно нормальные тоны и отсутствие шумов либо выслуживаются шум митральной регургитации, ритм галопа, изредка, чаще на 2–3 году жизни, мягкий непрерывный шум в верхних отделах по левому краю грудины, напоминающий шум у больных с коронарной фистулой или открытым артериальным протоком, усиление II тона над ЛА при развитии легочной гипертензии, гепатомегалия. Со временем из-за недостаточного развития коллатералей развиваются инфаркты переднебоковой стенки ЛЖ, недостаточность митрального клапана и хроническая сердечная недостаточность.
Если у больного доминирует правый тип кровоснабжения сердца и имеется сеть многочисленных хорошо развитых межсосудистых анастомозов в системе коронарных артерий, симптомы могут отсутствовать или проявляться незначительно, и заболевание переходит во взрослый тип (10–15 % случаев). Некоторые взрослые пациенты с СБУГ не испытывают недомогания, но значительно чаще аномалия проявляет себя одышкой, сердцебиением, обмороками, стенокардией, легочной гипертензией, кардиомиопатией, желудочковыми аритмиями и внезапной сердечной смертью. Симптомы не всегда связаны с физической активностью и могут внезапно возникать в покое, результаты функциональных проб часто ложноотрицательные, что затрудняет диагностику.
Из-за развития большого числа коллатералей происходит шунтирование крови из правой коронарной артерии (ПКА) в ЛКА и ЛА и наблюдается феномен обкрадывания. В отдельных случаях СБУГ не проявляется до более позднего возраста (старше 30 лет), что объясняется адаптацией не только к хронической ишемии участка миокарда, кровоснабжаемого ЛКА, но и к шунтированию крови. Предполагается, что адаптация происходит благодаря:
P. Angelini выделяет несколько механизмов стеноза КА:
• Коронарная гипоплазия
Интрамуральный инвагинированный сегмент проксимальной эктопической артерии меньше в окружности, чем более дистальные экстрамуральные сосуды. Автор предлагает в качестве ценного количественного параметра индекс гипоплазии (отношение длин окружностей интрамурального сегмента и более дистального на внутрисосудистом УЗИ). Врожденный ход артерии в медии аорты скорее приводит к ненормальному росту КА до и после рождения.
• Латеральная компрессия
На поперечном разрезе интрамуральный сегмент имеет овоидную, а не круглую форму. Латеральное сдавливание уменьшает площадь по сравнению с площадью сечения круглого на разрезе сосуда с той же длиной окружности. Латеральное сдавливание характеризуется коэффициентом асимметрии (отношение меньшего диаметра к большему при внутрисосудистом УЗИ). В систолу диаметр еще больше уменьшается.
Таким образом, заподозрить у пациента СБУГ можно при наличии необъяснимой кардиомегалии, митральной недостаточности или стойкого систолического шума над областью сердца.
Инструментальная диагностика СБУГ
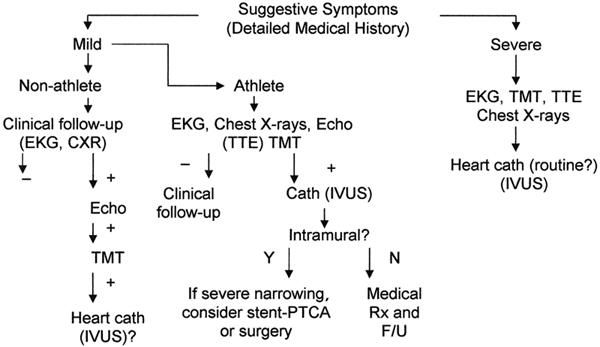
Рисунок 2 | Предлагаемый диагностический протокол для взрослых пациентов с риском развития аномалий коронарных артерий. Источник: Angeline P. Coronary artery anomalies—current clinical issues //Tex Heart Inst J. – 2002
В 80–90 % диагноз СБУГ устанавливается на вскрытии. Наиболее актуальна скрининговая диагностика аномалий коронарных артерий для спортсменов и военнослужащих. Согласно данным Американского Национального регистра внезапной смерти среди спортсменов аномалии КА являются второй по частоте причиной внезапной сердечной смерти (17 %), уступая лишь гипертрофической кардиомиопатии. Сообщается, что функциональные пробы и радионуклидные методы часто не выявляют временную ишемию у спортсменов с аномалиями КА. От 55 % до 93 % пациентов, умерших от внезапной сердечной смерти, вызванной аномалиями КА, не имели ранее кардиологической симптоматики и менее 10 % из них обращались к кардиологу с симптомами, связанными с аномалией.
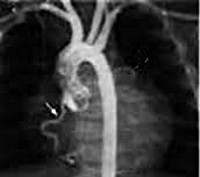
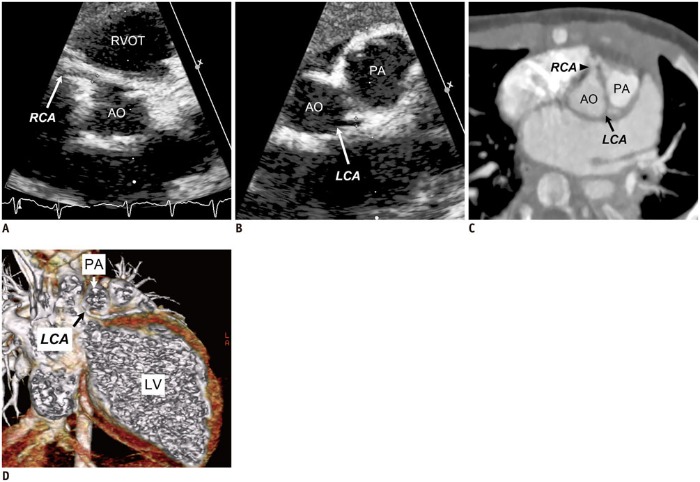
Прямым указанием на СБУГ служит визуализация ЛКА, отходящей от легочного ствола (чаще всего от его левой нижнелатеральной части сразу за клапаном ЛА). Далее ЛКА следует по межжелудочковой борозде и распадается на левую переднюю нисходящую и огибающую артерии. Косвенными признаками СБУГ являются извитость КА, расширенная ПКА, множественные расширенные коллатерали между ПКА и ЛКА, гипертрофия и дилатация ЛЖ, миксоматозная дегенерация и ишемическая дисфункция папиллярных мышц, гипокинез стенки ЛЖ, расширенные бронхиальные артерии.
Диагностической процедурой выбора для диагностики СБУГ является коронарография с инъекцией в корень аорты, однако из-за анатомических особенностей устья аномальной ЛКА не всегда удается визуализировать ее ход. Аортография используется для лучевой диагностики у детей младше одного года, коронарография – у детей старше 5 лет. Процедура чревата осложнениями, среди которых часто встречаются временные изменения на ЭКГ (11 %), временная брадикардия (2,5 %), сосудистые нарушения (11,6 %) и такие серьезные осложнения, как желудочковая фибрилляция (0,6 %).
Большинство диагнозов СБУГ основаны на данных эхокардиографии с цветовым допплеровским картированием. ЭхоКГ позволяет избежать осложнений коронарографии и оценить дисфункцию МК. Дополнительные исследования проводятся при невозможности установить точный диагноз на ЭхоКГ или для дифференциальной диагностики. Трансторакальная ЭхоКГ используется у детей в связи с наличием хорошего акустического окна (у взрослых более чувствительна чреспищеводная ЭхоКГ).
МРТ сердца дает дополнительную информацию о направлении тока крови в ЛКА (кино-МРТ с последовательностью SSFP), состоянии клапанов, миокарда, местной сократимости, сопутствующих пороках, которая важна для предоперационной оценки и послеоперационного наблюдения за пациентами. При исследовании пациент не подвергается ионизирующему облучению, что важно в педиатрии. МРТ сердца используется для обнаружения субэндокардиальной ишемии и фиброза миокарда, который может стать субстратом для возникновения летальных аритмий, при этом получают изображения с усилением в отложенную фазу после инъекции гадолиния.
На ЭКГ-синхронизированной МСКТ-ангиографии лучше, чем на МРТ, визуализируется не только аномальная ЛКА, но и расширенная и извитая ПКА, множественные межкоронарные коллатеральные сосуды, расширенные бронхиальные артерии.
Радионуклидные методы визуализации сердца позволяют оценить перфузию миокарда и функциональное значение аномалии КА. К ним относятся нагрузочная сцинтиграфия с таллием, однопротонная эмиссионная компьютерная томография и позитронная эмиссионная томография. Однопротонная эмиссионная КТ (ОПЭКТ)-МРТ и позитронная эмиссионная томография (ПЭТ)-МРТ выявляют ишемию миокарда у асимптоматических пациентов и пациентов с симптомами. При гибридном КТ-коронарография/ОПЭКТ-МРТ исследовании удается обнаружить нарушения кровотока в кровоснабжаемых КА участках даже при отсутствии дефектов перфузии. На решение об оперативном вмешательстве радионуклидные методы в целом не влияют и не используются при обследовании большинства пациентов.
Нередко первым признаком СБУГ являются нарушения ритма, представляющие риск развития внезапной сердечной смерти. Тем не менее, ЭКГ-признаки гипертрофии и перегрузки левых отделов сердца отмечают у всех пациентов с СБУГ. Перспективными в диагностике ишемии миокарда ЛЖ у данной категории больных могут быть поверхностное ЭКГ-картирование и метод 12-канального холтеровского мониторирования, помогающий выявить транзиторные периоды ишемии миокарда, даже при отрицательных результатах других нагрузочных проб.
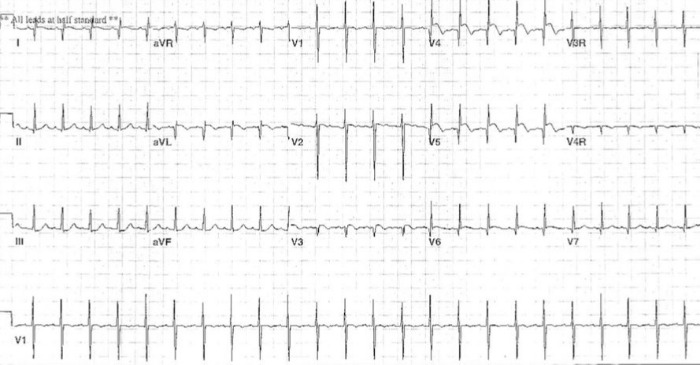
ЭКГ у младенцев с СБУГ обычно указывает на переднебоковой инфаркт ЛЖ, признаками которого являются аномальные зубцы Q и временные изменения интервала ST в отведениях I, aVL, V5 и V6. У 20–45 % пациентов отсутствуют аномалии зубца Q и на мысль о СБУГ может навести аномальный прирост зубца R в грудных отведениях.
Различают временные, связанные с текущим повреждением, и более длительные, связанные с исчезновением мышечной ткани, изменения на ЭКГ. Первыми признаками повреждения являются заостренные зубцы Т, свидетельствующие о локальной гиперкалиемии, которые исчезают через несколько часов и часто не обнаруживаются. Затем последовательно появляются изменения сегмента ST, элевация точки J с сегментом ST вогнутой формы и дальнейшая элевация точки J с выпучиванием сегмента ST.
Иногда наблюдается реципрокная депрессия сегмента ST в отведениях II, III, aVF и даже V1 и V2. Признаками исчезновения мышечной ткани являются появление зубца Q и уменьшение амплитуды зубца R в затронутых отведениях. В течение последующих двух недель сегмент ST становится изоэлектрическим, зубец Т — инвертированным и симметричным, уменьшается амплитуда зубца R, углубляется зубец Q. Единственными ЭКГ-признаками переднебокового инфаркта после окончания острой фазы являются аномальные зубцы Q и R.
Вышеперечисленные изменения неспецифичны и характерны для острого миокардита и дилатационной кардиомиопатии, однако одновременное наличие следующих четырех ЭКГ-признаков присуще только СБУГ и позволяет провести дифференциальную диагностику:
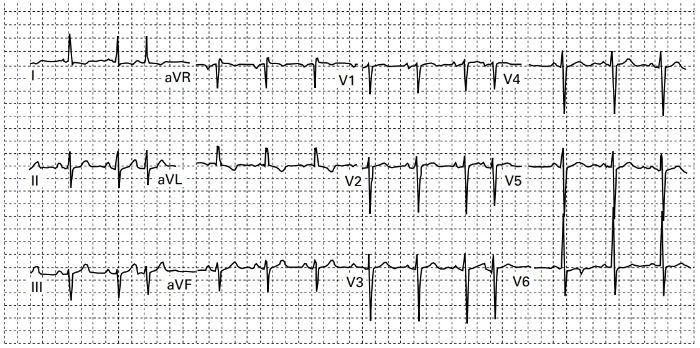
Рисунок 5 | ЭКГ ребенка 3-х месяцев с ALCAPA. Источник: Hoffman J. I. E. Electrocardiogram of anomalous left coronary artery from the pulmonary artery in infants //Pediatric cardiology. – 2013
Данные изменения встречаются в 55–80 % случаев СБУГ. Причины отсутствия аномальных зубцов Q недостаточно ясны, однако у взрослых пациентов оно ассоциировано больше с субэндокардиальным инфарктом, чем с трансмуральным; больше с нижним, чем с передним; больше с мелкоочаговым, чем крупноочаговым. Стоит отметить и новые, но пока не получившие широкого применения, методы диагностики, например внутрисосудистое УЗИ и измерение интракоронарного давления с определением ФРК.
Дифференциальную диагностику СБУГ проводят с миокардитом, болезнью Кавасаки, васкулитами (узелковым полиартериитом или артериитом Такаясу), склеродермией, синдромом Элерса-Данло, наследственной геморрагической телеангиэктазией, дилатационной кардиомиопатией, врожденной недостаточностью МК, стенозом и коарктацией аорты.
Лечение СБУГ
Синдром Бланда-Уайта-Гарланда является абсолютным показанием к хирургическому лечению.
В 1960 г. Sabiston et al., сотрудники Johns Hopkins Hospital, описали лечение 2,5-месячного ребенка с СБУГ. У ребенка наблюдались трудности при кормлении, одышка и звуки хрюканья. Рентгенография грудной клетки выявила кардиомегалию, на ЭКГ были признаки свежего повреждения миокарда. Катетеризация сердца выявила дилатацию и дисфункцию ЛЖ, аномальная ЛКА не визуализировалась. После полного обследования было принято решение о хирургическом вмешательстве с целью реваскуляризации ЛЖ. В ходе операции был обнаружен инфаркт миокарда и аномальная ЛКА.
С целью определить направление кровотока по аномальной КА Sabiston et al. измерили систолическое давление в ЛА и ЛКА, которое составило 25 и 30 мм рт.ст. соответственно. При окклюзии аномального сосуда в месте отхождения от ЛА давление в нем возросло до 75 мм рт.ст., обеспечив ретроградный кровоток по коллатералям. Сатурация кислородом в ЛКА составляла 100 %, в ЛА — 76 %, что также свидетельствовало о наличии кровотока по коллатералям. Sabiston et al. рекомендовали наложение лигатуры на аномальную ЛКА как эффективный метод лечения патологии.
В последние десятилетия были предложены несколько способов хирургического лечения СБУГ. Простое наложение лигатуры на аномальную артерию в месте ее отхождения от ЛА, описанное Sabiston et al., при своей эффективности оказалось чревато серьезными ранними и поздними осложнениями по той причине, что после наложение лигатуры коронарное кровоснабжение сердца обеспечивается только ПКА и целиком зависит от степени развития коллатералей. В 1966 г. Cooley et al. сообщили о способе создания двухкоронарной системы кровоснабжения миокарда. Создав с помощью протеза из дакрона сообщение между аортой и ЛКА, они восстановили прямой антероградный кровоток в ЛКА. В последующие годы были предложены другие способы создания двухкоронарной системы — шунтирование подкожной веной, внутренней грудной артерией, левой подключичной артерией.
Доказанными осложнениями перечисленных методов хирургической коррекции являются реканализация аномальной КА, увеличение риска атеросклероза, тяжелая ишемическая митральная регургитация. Более современные методы не несут за собой такие риски.
Современный способ хирургической коррекции СБУГ основан на предложенной в 1974 г. Neches et al. прямой имплантации ЛКА в аорту. Устье аномальной ЛКА выделяется из ЛА вместе с небольшим лоскутом ЛА и подсоединяется к корню аорты с формированием двухкоронарной системы. Описанный способ является операцией выбора при СБУГ. Послеоперационная летальность составляет 0–16 % в зависимости от степени дооперационного повреждения миокарда. Главным осложнением может стать тяжелая кровопотеря из-за разрыва аномальной артерии при пересадке. У взрослых прямая имплантация ЛКА часто невозможна из-за ригидности ткани и большим расстоянием от устья ЛКА до аорты. В этих случаях предпочтительным является шунтирование аномальной ЛКА с использованием артериального и венозного трансплантата. При этом риск стеноза пересаженного сосуда выше при использовании венозного трансплантата. Трансплантат подкожной вены сохраняет проходимость в среднем на 80 % в течение 5–8 лет.
При наличии противопоказаний к прямой имплантации ЛКА в аорту с 1979 г. применяется операция Takeuchi. Она заключается в создании тоннеля внутри ЛА (аортопульмонарного окна), через который аорта сообщается с устьем аномальной ЛКА. Данный метод ассоциирован с высокой частотой надклапанного стеноза легочной артерии и обструкции тоннеля.
Пациентам с необратимым, несмотря на коррекцию с формированием двухкоронарной системы, повреждением миокарда показана трансплантация сердца. У пациентов с высоким риском возникновения желудочковых фибрилляций (пациенты с ишемической кардиомиопатией и низкой фракцией выброса) возможно использование имплантируемого кардиовертера-дефибриллятора.
Источники: