на основе чего делают вакцины
На основе чего делают вакцины
В мире сложилась тяжелая эпидемиологическая ситуация. Пандемия COVID-19 никуда уходить пока не собирается. Работа над лекарствами и вакцинами идет полным ходом практических во всех странах и Россия не исключение. Разберемся какие есть разработки и технологии на примере вакцин против коронавируса.
Из белков
Большая часть вакцинных препаратов, разрабатываемых для профилактики COVID-19 — субъединичные. Прививки разработанные по этой технологии самые безопасные: ни на одной стадии создания не используется живой вирус, а сама она содержит только вирусные белки. Для формирования полноценного иммунного ответа такие препараты вводятся несколько раз и требуют добавления компонентов, усиливающих иммунный ответ, например адъювантов или иммуностимуляторов.
Из частиц вирусов
Вакцины на основе вирусоподобных частиц также состоят только из вирусных белков, адъювантов и иммуностимуляторов. Для усиления иммунного ответа эти белки собираются в частицы, похожие на вирус. Они безопасны и способны вызывать иммунный ответ, но их создание для массовой вакцинации технологически сложно и дороже.
Из нуклеиновых кислот
ДНК- и РНК-вакцины — препараты на основе нуклеиновых кислот. Создание таких прививок осложняется тем, что технологии доставки генетического материала внутрь клетки организма еще разрабатываются. Это ограничивает использование ДНК- и РНК-вакцин: пока ни один препарат на основе нуклеиновой кислоты не применяется в клинической практике на людях.
С помощью других вирусов
Немалая часть разработок прототипов иммунобиологических препаратов основана на применении вирусных векторов: реплицирующихся — способных размножаться; нереплицирующихся — не способных размножаться. Технология создания этих двух видов одинакова: в геном вирусного вектора встраивается ген, кодирующий целевой белок другого вируса. Вектор — другой вирус, не вызывающий болезнь у человека. Например, для создания вакцины против COVID-19 в аденовирус встраивается ген, кодирующий белок коронавируса. Препятствие при использовании таких препаратов — присутствие у человека антител к вирусному вектору. В этом случае полноценный иммунный ответ может не сформироваться. Выбор вирусного вектора важный и определяющим этап при их разработке. Иммунитет при использовании реплицирующегося вектора формируется, как правило, уже после однократного введения, тогда как для вакцин на основе нереплицирующихся вирусных векторов чаще всего требуется несколько введений препарата.
Проверенные временем
Цельновирионные живые аттенуированные и инактивированные вакцины имеют самую продолжительную историю применения и являются классическими технологическими платформами. Инактивированные содержат нежизнеспособные вирусы, и для формирования иммунного ответа часто требуются повторные введения препарата. Для живых аттенуированных вакцин чаще требуется однократное введение, так как вирус сохраняет возможность размножаться в организме человека. Вирус в аттенуированной вакцине ослаблен, однако есть вероятность возврата к дикому типу, что приведет к вспышке при её использовании. Это приводит к необходимости регулярного проведения исследований по изучению генетической стабильности таких препаратов. Кроме того, технологическое создание вакцин этих типов медленнее в сравнении с производством ДНК- и РНК- или субъединичных вакцин. Кроме этого, при этом особых санитарных норм и требований биологической безопасности.
Где привиться
На данный момент созданные вакцины против коронавируса, к сожалению, доступны не всем. В первую очередь они используются для защиты людей, которые каждый день сталкиваются с вирусом, а также тех чьи профессии связаны с контактом с большим количеством людей, например учителя. Скоро привиться сможет и каждый желающий, а пока можно сделать прививку от гриппа и защитить себя и своих близких.
Подробнее о вакцинации читайте здесь «Коротко о вакцинации» и на сайте Роспотребнадзора.
Виды вакцин от COVID-19: какую выбрать
Оглавление
Сегодня поставить прививку от можно с использованием нескольких препаратов. Какие виды вакцин от ковида применяются в нашей стране? Чем они отличаются друг от друга? Какие прививки ставят в других странах? Давайте разберемся в этих вопросах.
Российские типы вакцин от ковида
В нашей стране в настоящий момент используются исключительно отечественные препараты.
Они разделяются на несколько групп:
Рассмотрим все вакцины от коронавируса более внимательно, определим их виды и отличия.
«Спутник V» (от Исследовательского центра имени )
Препарат создан на основе аденовируса (вируса, вызывающего ОРВИ) человека. Для разработки вакцины вирус лишили гена размножения. Благодаря этому он стал так называемым вектором (транспортным средством для доставки груза в клетки организма). В качестве груза в данном конкретном случае выступает генетический материал заболевания, против которого и работает препарат. Поступая в клетку, груз стимулирует выработку антител.
Важно! После введения первой дозы препарата организм человека от заражения еще не защищен. Это обусловлено тем, что антитела вырабатываются постепенно. Максимальный их уровень обеспечивается примерно через 2–3 недели после постановки второй прививки.
Иммунитет после вакцинации сохраняется примерно 2 года. При этом важно понимать, что антитела в крови присутствуют определенное количество времени, которое во многом зависит от индивидуальных особенностей пациента. В настоящий момент говорят о том, что хватает их примерно на год. При этом клеточный иммунитет сохраняется. Он защищает организм и после исчезновения антител.
«Спутник Лайт» (однокомпонентный вариант вакцины «Спутник V»)
Этот препарат отличается от исходного тем, что достаточно введения одной его дозы.
«ЭпиВакКорона» (от Центра «Вектор»)
Данная вакцина разработана на основе искусственно созданных фрагментов белков вируса. Благодаря этому она дает минимальное количество побочных эффектов. К основным относят возможную болезненность в месте инъекции и незначительное повышение температуры тела на короткое время. При этом и эффективность препарата является более низкой, чем у вакцины «Спутник V». Для повышения данного показателя проводится двукратная вакцинация с интервалом в 2–3 недели. На формирование иммунитета уходит около 30 дней. Ревакцинация по предварительным оценкам требуется примерно через 6–9 месяцев.
Разработчики уверяют, что препарат может обеспечить защиту организма от различных штаммов коронавируса. Но существует и другое мнение. Некоторые специалисты утверждают, что вакцина уязвима при мутациях вируса.
Иностранные виды вакцин от коронавируса
К ним относят: Pfizer/BioNTech и Moderna. Вирусные белки для производства препаратов синтезируются непосредственно в организме человека. Матричная РНК представляет собой своеобразную инструкцию. Прочитав ее, клетка начинает самостоятельно вырабатывать закодированный белок (фрагмент коронавируса). Препараты Pfizer/BioNTech и Moderna сегодня применяются для вакцинации в Великобритании, Израиле, странах Евросоюза, на Украине, в США и в других государствах. Прививки демонстрируют хорошую защиту от тяжелого течения заболевания. Это обусловлено тем, что вакцины проникают вглубь клеток, что имитирует инфицирование и приводит к формированию полноценного иммунитета. Недостатком препаратов является их недостаточная изученность.
Таким средством является вакцина AstraZeneca. Изготовлена она по принципу препарата «Спутник V». В качестве вектора в AstraZeneca выступает модифицированный вирус шимпанзе. Эффективность этой вакцины составляет 79%. При этом препарат на 100% защищает от тяжелого течения вирусной инфекции. Он используется в странах Евросоюза.
К ним относят Sinopharm и Sinovac.
Основными крупными поставщиками вакцин стали биофармацевтические компании из Китая. Они разработали препараты по принципу российского препарата «КовиВак». Вакцинация Sinopharm и Sinovac проводится не только в КНР, но и в Турции, ОАЭ, Чили, Аргентине и ряде других стран. Во время третьей фазы исследований определена общая эффективность препаратов, которая варьируется от 50% до 84%. При этом от тяжелого течения заболевания средства защищают на 100%.
Сравнение российских препаратов
Для правильного выбора прививки от коронавируса нужно сравнить между собой представленные препараты. Мы провели такое сравнение и оформили его в виде таблицы для вашего удобства.
| «Спутник V» | «Спутник Лайт» | «Кови Вак» | «Эпи Вак Корона» | |
|---|---|---|---|---|
| Срок формирования иммунитета (в днях) | 42 | 28 | Исследуется | 35-40 |
| Формирование антител (в процентах от вакцинированных) | У 98% | Почти у 97% | Исследуется | Более чем у 82% |
| Эффективность | Более 91% (в том числе для пациентов старше 65 лет) | Почти 80% | На стадии исследований | В настоящий момент не установлена |
Побочные эффекты вакцин
Необходимо сразу уточнить, что все побочные эффекты легкого и умеренного типов являются вариантом нормы.
В некоторых случаях также возможно развитие диареи.
После введения препарата пациент на 20–30 минут остается в медицинском учреждении. Это необходимо по причине риска развития аллергической реакции.
Преимущества обращения в МЕДСИ
Вакцины: путь от изобретения до применения
Производство вакцин – многоступенчатый, длительный процесс, который требует участия тысяч человек и серьезных материальных вложений. Его стандарт был разработан в середине XX века. На сегодняшний день в мире зарегистрировано около 100 вакцин, и ученые накопили достаточно опыта, чтобы быстро отреагировать и разработать новый препарат в случае критической ситуации.
С чего все начинается
Вакцины не разрабатываются просто так, по чьему-либо желанию. Процесс инициируется, когда инфекция приобретает угрожающий характер (эпидемии или пандемии), особенно всемирного масштаба. Огромное количество накопленных статистических данных служит толчком к поиску нового препарата.
В разработке принимают участие ученые разных направлений – вирусологи, биологи, иммунологи, бактериологи и другие. И на первом этапе им необходимо не только выявить возбудителя и «опознать» его, но и тщательно изучить особенности жизнедеятельности, генетического материала, антигенов. Более того, перед исследователями стоит задача понять, как организм отвечает на проникновение микроба, какие иммунные механизмы задействованы.
Изучение свойств патогена происходит как в условиях лаборатории (с привлечением животных или in vitro), так и путем непосредственного наблюдения за инфицированными людьми.
in vitro – это технология выполнения опытов «в пробирке», т.е. вне живого организма.
В процессе принимают участие одновременно несколько групп ученых, каждая из которых имеет свои задачи и методы. Таким образом, инфекционного возбудителя исследуют с максимального числа сторон.
Здесь же формируются гипотезы, каким может быть будущий препарат, – живой, инактивированный, синтетический. Важными моментами являются, например:
как будет происходить оценка иммунного ответа;
какие антигены возбудителя нужно взять;
какая питательная среда потребуется для выращивания микроорганизма;
сколько антигена надо, чтобы стимулировать формирование иммунитета у людей разных возрастов;
сколько дозировок нужно и с какой периодичностью введения, и так далее.
НА ЗАМЕТКУ! Антиген – часть инфекционного возбудителя, к которому иммунная система вырабатывает защитные антитела. Для разных антигенов (даже одного микроба) нужны разные антитела.
То есть, на этапе разработки вакцин ученые сталкиваются с огромным количеством вопросов, выдвигают и проверяют десятки и сотни гипотез, при необходимости меняют концепцию. Понятно, что в экстренных случаях такая работа ведется непрерывно, круглосуточно, и в ней задействовано в несколько раз больше исследований, чем в штатном режиме.
НА ЗАМЕТКУ! Возникает вопрос: почему бы тогда не создать одну вакцину, например, от гриппа, и делать прививку каждый год, не вспоминая об этом заболевании? Дело в том, что вирус гриппа постоянно мутирует, свойства антигенов изменяются, и ученым приходится ежегодно создавать новые препараты. Но это не значит, что новую вакцину делают «наугад». ВОЗ располагает сетью специализированных центров, в которых происходит сбор данных о вспышках гриппа по всему миру. Ученые непрерывно анализируют штаммы, выявляют новые разновидности, проводят антигенные исследования. То есть, состав будущего препарата обоснован конкретными фактами. Более подробно о вакцине от гриппа можно почитать в нашей статье: « Вековая война с гриппом: про вакцины от начала до наших дней». К слову, другая ситуация с ВИЧ. Мутации этого вируса происходят в несколько раз чаще, чем гриппа. «Уловить» изменения на данный момент исследователи не могут, поэтому вакцины от него нет.
Доклинический этап
Когда базовые исследования закончены, и прототип препарата готов, начинается доклинический этап. Испытания проводятся на животных, параллельно отрабатывается технология производства вакцины.
Среди важных моментов доклинических испытаний можно отметить следующие:
В процессе тестирования животным вводят вакцину в различных концентрациях и в разных состояниях организма, наблюдая и фиксируя при этом малейшие изменения. Нужно отметить, что большая часть вакцин не проходит доклинические испытания, так как не приводит к цели – иммунный ответ на введение отсутствует.
НА ЗАМЕТКУ! Для проведения доклинических исследований, как правило, берут два вида животных. Чаще всего, это – мыши и приматы. Идеальный вариант – когда в тестировании принимают участие от трех и более видов. Это дает возможность подобрать оптимально подходящую дозировку и обеспечить полную безопасность препарата.
Если доклинические испытания прошли успешно, для дальнейших испытаний нужно получить разрешение в специализированных органах. Авторы подают заявку, в которой подробно описываются проведенные исследования и тесты, обосновывается необходимость применения препарата и другие моменты. В ответ получают либо отказ, либо разрешение. При положительном решении разработка вакцины переходит в клинический этап.
ЭТО ИНТЕРЕСНО! Своеобразные «прививки» от оспы делали в Китае в 15 веке. У больного человека брали струпья, растирали в порошок и давали вдыхать здоровому. Среди других вариантов «вакцинации» – надетое на здорового человека белье инфицированного или вкладывание в ноздри ватного тампона, пропитанного гнойным содержимым язв. Какими бы варварскими не казались нам эти методы сейчас, в то время они реально помогали!
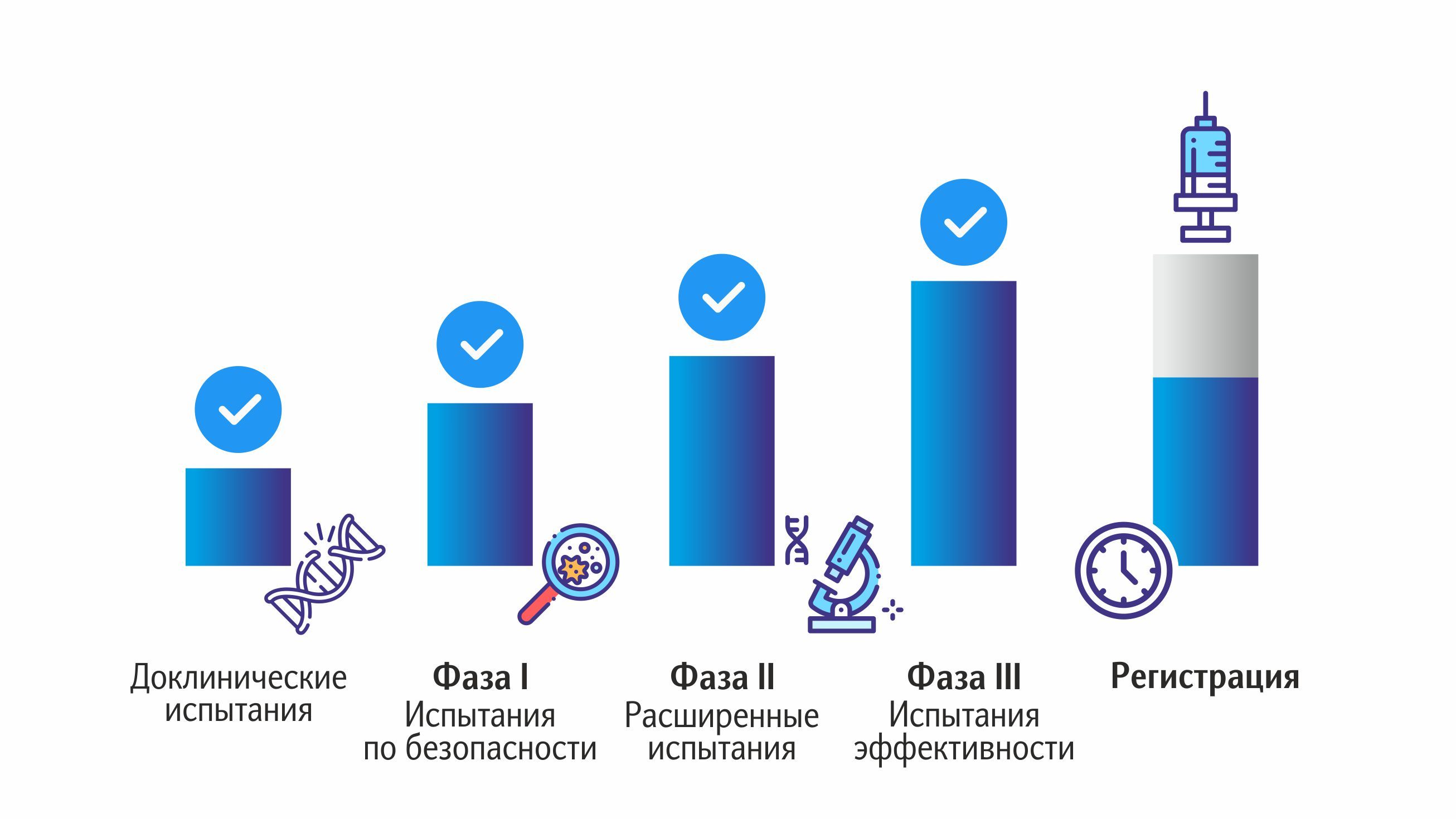
Клинический этап разработки
Этот этап предполагает непосредственное участие в испытаниях людей-добровольцев. Неважно, для какого возраста разрабатывается вакцина, ее действие изучают только на здоровых взрослых людях. Клинические исследования проводятся в три фазы. Процесс разделен на стадии, что позволяет контролировать тестирование препарата, постепенно увеличивая количество людей. Это значительно снижает риски: всё что будет тестироваться массово, уже прошло испытания в узких кругах. И, конечно, такой подход позволяет прекратить тестирование на любом этапе в случае обнаружения нежелательных явлений. Именно поэтому каждая фаза имеет огромную значимость и свои цели.
Первая фаза
Проводится на совсем небольшом количестве людей (десятки людей). Её цель – подтверждение первичной безопасности для людей в принципе. Происходит исследование вакцины в действии. Ученые обращают внимание на следующие моменты:
В процессе тестирования может изменяться не только дозировка, но и состав препарата. Вакцину вводят не сразу всем участникам, а поочередно, чтобы избежать массовых негативных проявлений в случае, если что-то пойдет не так.
Вторая фаза
Цель этой стадии – оценка эффективности (иммуногенности) вакцины. Во второй фазе испытаний принимает участие несколько сотен добровольцев. На данном этапе происходит еще большая отработка свойств и дозировки препарата. Тщательно фиксируются и анализируются реакции организма, определяется периодичность и сроки вакцинации, особенности транспортировки и прочие моменты.
Третья фаза
Её цель – доказать безопасность и эффективность вакцины при массовом применении в динамике, а также удостовериться, что польза вакцины компенсирует те нежелательные реакции, которые неминуемо будут выявлены (хотим уточнить, что допускаются лишь легкие реакции). Именно на третьей фазе ученые делают выводы, которые невозможны при небольшой численности испытуемых: действие вакцины изучается на тысячах человек. Анализируется частота побочных эффектов (в том числе отдаленных), продолжается определение безопасности.
После того, как все фазы клинического этапа исследований успешно пройдены, данные о них поступают в специализированные структуры. Положительное решение означает, что вакцина может быть запущена в производство; препарат регистрируют, а фирме-изготовителю выдается соответствующая лицензия.
Нужно отметить, что лицензируется не только сама вакцина, но и ее производство. Если в процесс изготовления вносятся какие-либо изменения или он не может в полной мере обеспечить качество, препарат заново проходит испытания. Вакцины выпускаются сотнями тысяч дозировок, и важно, чтобы каждая из них соответствовала ранее заявленным протоколам.
Дальнейшая «жизнь» вакцины
Выдача лицензии и массовый выпуск вакцины не означает, что исследования закончились. Существует еще четвертая фаза клинических исследований. Она проводится уже после того, как препарат становится доступным для людей через розничную сеть медицинский организаций. Это постмаркетинговые испытания или так называемый постклинический мониторинг. Он имеет масштабный характер, позволяют получить еще более подробную информацию о безопасности и эффективности препарата. Также на четвертой фазе оцениваются комбинации с другими препаратами и уточняются вновь открывшиеся данные и гипотезы.
Может быть и такое: вакцину зарегистрировали и начали применять, но внезапно сняли с производства. Дело в том, что даже несколько тысяч человек в некоторых случаях не могут являться абсолютным показателем безопасности. Только внедрение в массы способно в полной степени проявить те или иные качества препарата. Однако такие случаи – редкость.
НА ЗАМЕТКУ! Стоит коснуться и такого вопроса, как материальные затраты. Разработка вакцины требует огромных вложений. Это и заработная плата сотрудникам, и содержание лабораторий и центров, содержание животных, реагенты и многое-многое другое. Кроме того, значительная доля от продаж уже зарегистрированного препарата уходит на постклинический мониторинг – сбор, фиксацию и анализ данных.
Примечательно, что даже после того, как все фазы испытаний пройдены, наблюдения за действием препарата продолжают вестись постоянно в течение многих лет: ученые отслеживают влияние на организм в долгосрочном отношении, анализируют данные о динамике заболевания с момента внедрения препарата.
Как же получают сами препараты?
Непосредственное производство вакцины зависит от ее вида. В общих чертах его можно описать следующим образом.
1. Живая вакцина (ослабленная)
2. Инактивированная вакцина (убитые возбудители).
3. Рекомбинантная вакцина. Используются методы генной инженерии.
Кроме этого, существуют и другие способы производства вакцин, инновационные и дорогостоящие, например, полное воссоздание вируса искусственным путем. Иммунитет реагирует на него, как на «живого», но вероятность заражения нулевая, так как в такой частице отсутствует геном.
НА ЗАМЕТКУ! Одни из последних разработок ученых – создание вакцин на основе растительных вирусов. Их комбинируют с антигеном возбудителя болезни человека. Подобные исследования с использованием вируса табачной мозаики уже проводятся в отношении краснухи, COVID, сибирской язвы.
Сколько времени требуется для создания препарата
Длительность разработки и производства вакцин зависит от многих факторов: штамма возбудителя, антигенных свойств, того, насколько он изучен. В среднем, этапы занимают следующее количество времени:
Суммарно на разработку одной вакцины уходит примерно 10-15 лет (без мониторинга на практике после внедрения в производство).
В ряде ситуаций допускается экстренный выпуск препаратов. Однако это не означает, что они «не проверены». В любом случае вакцина проходит установленные протоколом этапы, но в очень сокращенном варианте. В качестве примера можно взять COVID-19 или вирус Эбола.
То же происходит, если свойства, присущие семейству возбудителя, хорошо известны. Например, ежегодные мутации вируса гриппа не являются препятствием для быстрого производства новой вакцины.
Особенности контроля
Каждый этап производства вакцин жестко контролируется. Стандарты и положения, регулирующие нормы качества препаратов, изложены в сборнике – фармакопее. Она имеет юридическую силу и находится под государственным контролем.
Люди-добровольцы, которые участвуют в испытаниях, обязательно должны дать на это свое согласие на основании утвержденного этическим комитетом протокола. Непосредственно на производстве надзору подвергается каждая серия выпущенного препарата. Контролируется не только состав вакцины, но и стерильность, концентрация, требования к фасовке, упаковке и так далее.
На фоне вышесказанного утверждения противников вакцинации выглядят, по меньшей мере, смешными. А если вы запутались в современных вакцинах, раздумываете – делать прививки или нет, наши специалисты всегда придут на помощь: проконсультируют, объяснят, посоветуют.
Вакцинация без мифов

Человечеству не удалось справиться с распространением COVID-19 с помощью одних только противоэпидемических мер. Ученые считают, что пандемия не остановится до тех пор, пока большая часть населения планеты (более 80%) не приобретет иммунитет к возбудителям этой инфекции, второй год циркулирующей в человеческой популяции. Добиться как личного, так и коллективного иммунитета можно двумя путями: либо переболеть, либо вакцинироваться. А учитывая, что риск умереть от этой болезни в случае тяжелого течения составляет примерно 1 к 30, то выбор очевиден. Тем более что за невероятно короткое время удалось создать много эффективно действующих вакцин, разработанных на самых разных технологических платформах.
Об авторе
Сергей Викторович Нетесов — член-корреспондент РАН, доктор биологических наук, заведующий лабораторией бионанотехнологии, микробиологии и вирусологии факультета естественных наук Новосибирского государственного университета. Автор более 150 публикаций в международно цитируемых журналах и более 10 монографий. Дважды лауреат Премии Правительства России в области биомедицинских наук.
Считается, что история вакцин начинается с британского врача Эдварда Дженнера и французского микробиолога Луи Пастера — изобретателей живых и инактивированных вакцин. Однако на самом деле идея имитировать инфекцию в целях профилактики родилась более тысячи лет назад в Китае и Индии, где стали заражать здоровых людей возбудителем натуральной оспы. Риск умереть в результате такой процедуры был в 20–30 раз меньше, чем от спонтанной инфекции.
Заслуга же Дженнера состоит в том, что он предложил вакцинировать людей не возбудителем человеческой болезни, а подобным, но безопасным для них агентом, вызывающим коровью оспу. К этому решению врач пришел благодаря наблюдениям, что доярки не болеют оспой. После успешных экспериментов такая вакцинация стала общепризнанной. Утверждение появившихся уже тогда антивакцинаторов, что таким образом люди превратятся в коров, не смогло этому помешать.
На французской гравюре (1800 г.) изображен новый процесс вакцинации с использованием возбудителя «коровьей оспы» (вверху). Английская гравюра Д. Гиллрэя (1802 г.) отражает скептицизм, который первоначально встречала осповакцинация (внизу). По: (Fenner et al., 1988. P. 269). With permission from World Health Organization
Французский химик и микробиолог Луи Пастер стал изобретателем инактивированной вакцины. До 1895 г. Фото П. Надара. Public domain
Следующий шаг сделал спустя почти сотню лет Пастер, который предложил «убивать» или ослаблять возбудителя инфекции перед вакцинацией. А поскольку он был по образованию химиком, а не врачом, то ему противостояли, и довольно мощно, уже сами медики. Но разработанная им для крупного рогатого скота вакцина от сибирской язвы резко снизила заболеваемость и смертность животных и ухаживающих за ними людей, а прививка от бешенства спасла множество человеческих жизней в разных странах. И антивакцинаторы затихли.
Очередным прорывом в противовирусных вакцинных технологиях стало создание так называемых субъединичных белковых вакцин, которые содержат не весь вирус, а только его белки, необходимые для стимуляции иммунитета. Первая такая вакцина была разработана против вируса гепатита В, поскольку оказалось невозможным получить достаточное количество инактивированной вакцины против этой болезни.
В первой субъединичной белковой вакцине против гепатита В использовался оболочечный вирусный белок HBsAg, выделенный из плазмы хронически инфицированных доноров. Но очень скоро выяснилось, что необходимой для этого донорской крови не хватает. И вот в 1979 г. в США с помощью генной инженерии был впервые получен рекомбинантный белок HBsAg. Его продуцентами стали генно-модифицированные клетки дрожжей, в которые был встроен ген, кодирующий вирусный белок.
Новую технологию было легко масштабировать, а стоимость препарата была значительно меньше по сравнению с плазменной вакциной (которая к тому же могла содержать возбудителей и других болезней). Эта рекомбинантная белковая вакцина более пяти лет тестировалась FDA (Food and Drug Administration, USA) перед тем, как прийти на смену плазменной. Она защищает от заражения на срок не менее 30 лет, и сегодня ею прививают всех новорожденных практически во всех странах мира.
Применение генно-инженерных технологий для создания вакцин обернулось колоссальным успехом. Через 20 с лишним лет с использованием аналогичного подхода были разработаны вакцины против папилломавирусной инфекции, которые сейчас применяются в более чем 90 странах мира. Основные компоненты таких вакцин — поверхностные белки — нарабатывают в клетках эукариот, высших организмов с оформленным ядром, к которым относятся и дрожжи. Это связано с тем, что вирусные белки должны быть гликозилированы, чтобы сформировать правильную структуру и вызывать «правильный» иммунный ответ, а в клетках бактерий, которые чаще всего используют в биотехнологическом производстве, соответствующие механизмы отсутствуют.
Пандемия, вызванная коронавирусом SARS-CoV-2, буквально всколыхнувшая весь мир в начале 2020 г., не оставила времени для размышлений. Стало ясно, что для того, чтобы максимально быстро получить вакцину, необходимы разработки сразу в нескольких направлениях.
На этой упрощенной схеме показан процесс инфицирования клетки SARS-CoV-2. Коронавирусы, включая SARS-CoV-2, относятся к РНК-вирусам: в качестве «наследственной» молекулы у них выступает не ДНК, а РНК (эта нуклеиновая кислота может непосредственно служить матрицей для синтеза белков). Когда SARS-CoV-2 попадает в клетку благодаря взаимодействию своего поверхностного белка-шипа S с клеточным рецептором ACE2 (а также рецептором TMPRSS2), он с помощью клеточных рибосом производит фермент полимеразу, необходимую для копирования своей РНК. На следующем этапе в клетке синтезируется множество копий вирусной РНК, а рибосомы по матрице этой РНК синтезируют разнообразные вирусные белки. Далее с использованием других клеточных органелл — эндоплазматического ретикулума и аппарата Гольджи (ЭРиГ) — происходит сборка вирусных нуклеокапсидов, а затем и самих частиц вируса. Часть вирусных белков «презентируется» на поверхности клеточной мембраны. Клетки иммунной системы организма, распознавшие чужеродные белки-антигены, могут уничтожить как сами вирусные частицы, так и зараженную клетку, если она не успеет закончить жизнь апоптозом (клеточным «самоубийством»)
Почему мы считаем COVID-19 опаснее гриппа? Потому что смертность от гриппа в среднем составляет примерно 0,02% от числа заболевших, а от новой коронавирусной инфекции она как минимум в 100 раз выше.
В целом данные по смертности от COVID-19 очень разнятся для разных стран и разных периодов пандемии. С чем это связано? В Италии в 2020 г. на эту инфекцию списывали все смерти в больницах с положительным диагнозом на SARS-CoV-2 — независимо от того, умирал пациент от дыхательной недостаточности или от других причин. В результате формально смертность от COVID-19 составляла 6%. В России же в 2020 г. «считали» наоборот, и реальная смертность занижалась.
Вверху: полная подтвержденная смертность от COVID-19 (число смертей на 1 млн человек) по разным странам мира на 1 сентября 2021 г. (Из-за проблем с тестированием болезни и определения причины смерти это число может не соответствовать истинному числу смертей от этой инфекции). Внизу: число новых ежедневных подтвержденных случаев смерти от COVID-19 (на 1 млн человек) на 1 сентября 2021 г. Показатель рассчитывается как скользящее среднее за неделю. Источник данных: Johns Hopkins University SCCE COVID-19 Data. © Our World in Data
В качестве причин более половины дополнительных смертей указаны болезни системы кровообращения (БСК). А виновником около четверти всех случаев «прибавочной» смертности оказался COVID-19. Однако во многих случаях он же указывался в свидетельствах о смерти одновременно с теми же БСК. Очевидно, что именно коронавирус стал «катализатором» развития основного заболевания, и это относится к болезням не только сердечно-сосудистой, но и дыхательной системы.
Таким образом, реальная летальность от коронавируса в Москве за первые 4 месяца 2020 г. составила 2% от официально заболевших, если брать во внимание лишь те случаи, где он являлся единственной причиной, и 3,8% — если учитывать его в качестве не только основного, но и сопутствующего заболевания.
Векторный транспорт
«Классические» инактивированные вакцины против COVID-19 разработаны, испытываются и уже применяются во многих странах мира (Индии, Китае, Казахстане, России, Франции, Турции, Иране и др.). При их производстве высокоочищенные препараты коронавируса инактивируют (как правило, бета-пропиолактоном — высокоактивным алкилирующим агентом, или формальдегидом), а в качестве стимулятора иммунного ответа (адъюванта) добавляют гидроокись алюминия. Основная трудность — для производства такой вакцины необходим высокопатогенный живой вирус в больших количествах, который можно получить в условиях биологической безопасности — BSL-2 или даже BSL-3, подразумевающей помещения со сложными инженерными системами для фильтрации воздуха и дезактивации всех отходов, недешевое оборудование и обязательные защитные костюмы для персонала в течение всего рабочего дня.
Инактивированные вакцины производятся по разным технологиям уже более ста лет, и фактически они представляют собой цельные вирусные частицы, но как бы «зашитые» химическими скрепками без возможности раскрыться. Поэтому в результате иммунизации антитела на их внутренние белки чаще всего не образуются. При грамотном производстве такие вакцины дают при введении минимум побочных реакций, но далеко не всегда — полноценный и долговременный иммунитет.
К примеру, так и не удалось получить эффективные инактивированные вакцины против паротита, ВИЧ-инфекции, гепатита С и вируса герпеса, а для вируса кори инактивированная вакцина оказалась очень дорогой. Что касается коронавируса SARS-CoV-2, то эффективность инактивированных вакцин оказалась существенно ниже по сравнению с векторными и мРНК-вакцинами, о которых пойдет речь ниже (70–80 против 90–95%). Так что минимум побочных реакций у вакцины — это хорошо, но более важна ее эффективность.
Уже несколько десятков лет у разработчиков вакцин были в запасе еще два новаторских подхода. Развивались они давно, но из-за консерватизма контролирующих органов до 2020 г. эти разработки оставались на стадии клинических испытаний.
Во-первых, это векторные вакцины, работы над которым ведутся с 1980-х гг. В этом случае в генетический материал непатогенного вируса вставляют ген основного иммуногенного белка патогена, и этот «гибрид» (непатогенный и чаще всего неспособный размножаться в организме человека) используют для вакцинации.
Когда такой рекомбинантный вирус попадает в клетки, информация с вирусного генома «считывается» в виде матричной РНК, по которой в клетке синтезируются вирусные белки, включая тот самый встроенный иммуногенный белок патогена. Далее этот белок, как при обычной инфекции, встраивается в клеточную мембрану, имитируя ситуацию заражения организма инфекционным агентом, не утратившим способность к размножению. Организм реагирует на такой экспонированный на клетке белок формированием иммунного ответа.
В качестве векторов-переносчиков генов иммуногенных вирусных белков испытывались разные вирусы: осповакцины, кори, аденовирусы, везикулярного стоматита, желтой лихорадки, альфа- и флавивирусы и др. Еще до 2020 г. ряд таких кандидатных вакцин дошел до клинических испытаний 1–2-й фазы, показав свою перспективность, но дальше этого дело не пошло. Кстати сказать, в 1990-е гг. несколько кандидатных вакцин были разработаны в новосибирском ГНЦ вирусологии и биотехнологии «Вектор», но контролирующие органы тогдашнего российского Минздрава не пустили их дальше первых двух фаз клинических испытаний, мотивируя это тем, что таких вакцин раньше не было. Но ведь и до Пастера не было инактивированных вакцин!
Слово о «Спутнике»
Ярким примером векторных вакцин может служить российский «Спутник V». Эта двухкомпонентная вакцина сконструирована на основе двух разных серотипов человеческого аденовируса — 26 и 5. Для выработки иммунного ответа на коронавирус в геном каждого из штаммов были вставлены ДНК-копии гена, кодирующего основной коронавирусный белок оболочки S. Он вставлен таким образом, чтобы в инфицированных клетках синтезировалась матричная РНК, кодирующая именно этот белок.
На этой упрощенной схеме показан принцип действия аденовирусной вакцины против SARS-CoV-2. Аденовирусы относятся к ДНК-вирусам. Генно-инженерный аденовирус, входящий в состав рекомбинантной вакцины от COVID-19, содержит в своем геноме фрагмент ДНК, который кодирует часть поверхностного белка-шипа S коронавируса. При попадании в клетку весь вирусный нуклеокапсид забрасывается в клеточное ядро. Однако из-за генетических дефектов аденовирусная ДНК не может там копироваться, как в случае полноценной вирусной частицы. В результате с этой ДНК считывается лишь матричная РНК, по которой в цитоплазме синтезируются коронавирусный и аденовирусные белки. Далее эти белки презентируются на поверхности клетки, где клетки иммунной системы распознают их так же, как в случае заражения коронавирусом или аденовирусом. При этом клетки, зараженные вакцинным вирусом, погибают, как и при реальной инфекции
Почему использовались два вектора-переносчика? Это связано с тем, что только живые аттенуированные (на основе ослабленных возбудителей) вакцины, да и то не все, обеспечивают хороший иммунный ответ после единственной инъекции. А инактивированные и субъединичные дают надежный иммунный ответ только после двух или трех инъекций. «Спутник V» сделан на основе двух серотипов аденовируса, чтобы сформировавшийся иммунитет к аденовирусным антигенам первой компоненты не мешал формированию усиленного иммунного ответа на вирусный белок при второй инъекции.
Белок-шип S коронавируса SARS-CoV-2 состоит из трех мономеров (показаны разным цветом). Верхняя часть белка (слева) связывается с клеточным рецептором АПФ2 человека, который коронавирус использует для проникновения в клетку. © 5-HT2AR. Public Domain Dedication
Еще одна особенность векторных вакцин, о которой уже упоминалось: сами вирусные носители не размножаются в организме человека. Для этого, к примеру, у аденовируса удаляют часть генов из области Е (так называемых ранних генов), отвечающей за его копирование и «маскировку» от иммунной системы. Такой дефектный вирус не может вызвать у вакцинированного аденовирусную инфекцию: он лишь некоторое время производит целевой продукт и часть своих белков, после чего погибает.
Поэтому и размножать его приходится в специальных клеточных культурах, в геномах которых имеются недостающие аденовирусные гены.
Как создается аденовирусная векторная вакцина? Из генома аденовируса вырезаются фрагменты (области E1 и E3), которые позволяют ему размножаться и обходить иммунную систему. Такой вирус называется нереплицирующимся, т. е. неспособным копировать сам себя. Далее на место гена E1 встраивается искусственно синтезированный ген, кодирующий чужеродный белок-антиген. Получается конструкция, состоящая из неразмножающегося аденовируса, которая способна производить белки-мишени, но не способна скрыть свое присутствие в инфицированной клетке от внимания иммунной системы.
«Спутник V» зарегистрирован более чем в 60 странах мира и применяется, помимо России, в таких государствах, как Аргентина, Венгрия, Сан-Марино, Алжир и другие. В случае его регистрации в Европейском медицинском агентстве соответствующие сертификаты о вакцинации будут действовать и в странах ЕС.
Все применяемые ныне векторные вакцины, как и «Спутник V», создавались на базе аденовирусов. Вместе с тем шли работы и по созданию вакцин против COVID-19 на основе вирусов кори, осповакцины, гриппа и других векторов, но большинство из них не показало хорошего защитного эффекта. Российский «Спутник V» по всем характеристикам сейчас считается одной из лучших векторных вакцин. И хотя поствакцинальные реакции на него довольно существенные, он формирует сильный иммунитет.
Один из часто возникающих вопросов в отношении всех векторных вакцин: можно ли использовать их для ревакцинации, ведь в организме формируется иммунитет и против самих вирусных носителей? Точный ответ на него могут дать только результаты испытаний. Но согласно предварительным данным, такие вакцины можно применять для повторной вакцинации уже через полгода. И пусть с меньшей эффективностью, но зато и без существенных поствакцинальных реакций.
К середине 2021 г. для вакцинации стали применяться четыре векторных вакцины — все на основе разных дефектных аденовирусов с встроенным полным геномом поверхностного S-белка исходного варианта нынешнего коронавируса SARS-CoV-2:
Результаты клинических испытаний вакцины «Спутник V» опубликованы в двух статьях во всемирно известном научном журнале The Lancet, который основан в 1823 г. и является вторым по цитируемости общемедицинским журналом мира после New England Journal of Medicine (Logunov, Dolzhikova, Zubkova et al., 2020; Logunov, Dolzhikova, Shcheblyakov et al., 2021). И хотя придирчивые читатели задали в комментариях к этим публикациям непростые вопросы, авторы на большинство из них достойно, на мой взгляд, ответили. А подобные дискуссии в этом журнале не редкость.
Суть — в пузырьках
Помимо векторных вакцин, усилия ученых направлены на создание так называемых мРНК-вакцин. В случае их применения в организм попадает не генетический материал вирусов, а лишь матричная РНК — готовая основа для синтеза патогенного вирусного белка, который должен вызывать иммунный ответ. Для доставки в наши клетки такая мРНК «пакуется» в специально разработанные липидные пузырьки.
Американская компания Moderna была основана десять лет назад для разработки именно этого типа вакцин. К 2020 г. она создала уже восемь кандидатных вакцин против целого ряда респираторных вирусных инфекций. Как минимум три из них еще несколько лет назад прошли первые фазы клинических испытаний на добровольцах.
Механизм работы вакцины, созданной в Moderna против SARS-CoV-2, примерно такой же, как у векторных, только проще. Она состоит из липидных пузырьков, заполненных раствором, который содержит молекулы матричной РНК, кодирующей все тот же коронавирусный белок S. При введении в мышечную ткань эти пузырьки сливаются с мембраной клеток, и мРНК высвобождается. А далее все происходит, как описано выше для векторных вакцин. Иначе говоря, иммуногенная часть этой вакцины аналогична той, что и у применяющихся сейчас векторных.
Эти клетки лабораторной культуры Vero CCL81CCL-81, полученные из эпителия почки африканской зеленой мартышки, инфицированы вирусными частицами SARS-CoV-2 (отмечены бежевым цветом). Щупальцевидные выступы, отходящие от зараженных клеток, прикрепляются к соседним клеткам и служат своего рода «мостом» для передачи вирусной инфекции. Сканирующая микроскопия. © NIAID
Другую популярную мРНК-вакцину разработала крупнейшая американская транснациональная компания Pfizer совместно с небольшой германской фирмой BioNTech. Она действует по тому же принципу, однако ее мРНК сконструирована немного по-другому, имеются отличия и в составе липидных пузырьков.
Эти вакцины требуют ввода двух инъекций одним и тем же препаратом. Эффективность их весьма высока — более 90%, и сейчас они — самые массовые в производстве и применении. Преимущества мРНК-вакцин очевидны. Во-первых, при их использовании в организме не возникает иммунных реакций на «сопутствующие» компоненты самой вакцины, как в случае векторных. Во-вторых, при необходимости разработки вакцины против другого возбудителя нужно просто заменить одну матричную РНК на другую.
Это очень перспективный подход к конструированию вакцин. Недостаток у подобных вакцин один: их надо хранить и перевозить при достаточно низких температурах. Правда, им страдает и ряд векторных вакцин.
Вакцина и организм
Общее воздействие на организм человека как векторных, так и мРНК-вакцин нетрудно оценить.
Как известно, в нашем организме примерно 30 трлн (30×10 12 ) клеток. В одной дозе векторной вакцины «Спутник V», согласно инструкции, 10 11 вирусных частиц. Таким образом, одна доза вакцины может, в принципе, заразить одну клетку из 300, т. е. 0,3% от общего числа. Фактически эта цифра будет на один-два порядка меньше, потому что на одной эпителиальной клетке имеются десятки рецепторов для аденовируса. Заметим, что в случае инактивированных вакцин число вводимых в организм вирусных частиц имеет близкий порядок — 10–50 млрд, так что рассуждение о большем вреде векторных вакцин в сравнении с инактивированными не обосновано.
Что касается мРНК-вакцин, то на сайте компании Pfizer не указано количество молекул матричной РНК в дозе вакцины, поэтому нельзя оценить, сколько их попадает в организм в результате одной инъекции. Но, исходя из логических соображений, доля клеток, куда проникла молекула мРНК, вряд ли превышает такую же долю для аденовирусов в случае векторных вакцин.
У некоторых векторных аденовирусных вакцин против COVID-19 была выявлена очень редкая побочная реакция в виде тромбообразования. В ряде случаев она привела даже к смертельным исходам, что вызвало серьезные беспокойства у населения. Такие осложнения были зафиксированы у 5–10 человек среди миллиона привитых вакциной Oxford / AstraZeneca и у 1–2 человек из миллиона привитых вакциной Johnson & Johnson, в которой используется в качестве носителя аденовирус 26-го серотипа, как и в первом компоненте «Спутника V». В отношении самого «Спутника V» подобной информации нет.
В нескольких препринтах, посвященных выяснению причин этих весьма серьезных осложнений, были выдвинуты три возможные причины: попадание основного содержимого шприца не в мышцу, а в крупный кровеносный сосуд; редкая генетическая особенность; повышенная свертываемость крови в день инъекции. Но все это пока рабочие гипотезы, которые проверяются. В любом случае вероятность этого осложнения при применении той же вакцины Johnson & Johnson сопоставима со смертью в собственной ванне — события, безусловно, крайне редкого.
Еще один вопрос, который иногда задают, касается феномена антителозависимого усиления инфекции. Как известно, обычно антитела способствуют фагоцитированию («заглатыванию») вируса иммунными клетками, что препятствует его размножению. Однако в некоторых случаях благодаря связыванию вирусной частицы с субоптимальными антителами вирус после проникновения в иммунные клетки не деградирует, а, напротив, начитает активно размножаться. Это вызывает гибель иммунных клеток и, соответственно, усиление инфекции.
Такой феномен достоверно зафиксирован, к примеру, в отношении лихорадки денге: при перенесении человеком заболевания, вызванного одним из серотипов этого вируса, в случае заражения вирусом другого серотипа болезнь проходит намного тяжелее и доля смертельных случаев резко возрастает. То же самое наблюдалось при создании и применении первых вакцин против лихорадки денге, а также против малярии.
Предполагалось, что такое явление может наблюдаться и в случае коронавирусных инфекций, поэтому при разработке всех вакцин его учитывали и пытались отслеживать. К счастью, в случае COVID-19 подобных осложнений до сих не выявлено, как при заболевании, так и при вакцинации (Halstead, Katzelnick, 2020).
Мир вакцинируется
Благодаря огромному «спросу» к 21 августа 2021 г. на стадии доклинических испытаний находилось уже 75 кандидатных вакцин. В клинических испытаниях на добровольцах участвовали 99 вакцинных препаратов, при этом треть из них — на завершающей, 3-й фазе. И уже больше десятка вакцин было в ряде стран разрешено для применения полностью либо ограниченно.
Вакцинация от COVID-19 в России стартовала в Москве 5 декабря 2020 г., а спустя 10 дней Минздрав РФ объявил о начале вакцинации во всех регионах. К 18 декабря 2020 г. первые прививки от коронавирусной инфекции сделали более 1,1 млн человек в четырех странах мира, включая США, Китай и Великобританию. © Our World in Data
Все ведущие вакцины в мире до сих пор испытываются в рамках 3-й фазы клинических испытаний с участием десятков тысяч человек, которые закончатся не ранее осени 2021 г. Но если бы их не начали применять уже полгода назад, то число смертей от коронавирусной инфекции было бы в несколько раз больше.
Наиболее масштабно производятся мРНК-вакцина компании Pfizer и векторная вакцина компании Johnson & Johnson. В шестерку самых массовых вошли также китайские инактивированные вакцины Sinovac и Sinopharm, векторная вакцина компании AstraZeneca и мРНК-вакцина компании Moderna. Затем — с большим отрывом — идет отечественный «Спутник V».
Число доз вакцин от COVID-19 (на 100 человек), которые получило население разных стран мира, на 31 августа 2021 г. Так как некоторые вакцины требуют двукратного введения, число введенных доз может превышать 100. © Our World in Data
При вакцинации зарубежными вакцинами ни в одном случае не требуется определение титров антител. Противопоказания минимальны: ими служат только тяжелая текущая инфекция и сильная аллергическая реакция на первый компонент вакцины. Наиболее безопасными на сегодняшний момент считаются инактивированные и мРНК-вакцины, которые можно использовать и для беременных женщин. А недавно была доказана безвредность для беременных женщин и некоторых векторных вакцин (Shimabukuro, Kim, Myers, 2021).
По степени охвата вакцинированием все государства можно разделить на группы. В первой группе окажутся те страны, где более половины населения получили хотя бы одну дозу вакцины, во второй — где было вакцинировано более 25%. В России к середине августа хотя бы одну дозу получило около четверти всего населения.

Доля людей в некоторых странах мира, полностью или частично вакцинированных против COVID-19, на 31 августа 2021 г. © Our World in Data
Для того, чтобы в сентябре полноценную прививку сделали 60% россиян (такой показатель нужен для обеспечения минимального коллективного иммунитета, необходимого для окончания пандемии), требуется привить в шесть раз больше человек, чем это было сделано за первое полугодие 2021 г. А, к примеру, для прекращения пандемии при распространении коронавирусного варианта дельта нужно, согласно прогнозу ВОЗ, вакцинировать около 80% населения (Abu-Raddad et al., 2021). До такого показателя Россия до конца 2021 г. не дойдет без кардинального — на порядок — ускорения темпов вакцинации.
В странах, где продолжают соблюдаться противоэпидемические меры, а доля вакцинированных приближается к 60% (Великобритания, Израиль и др.), заболеваемость к июню 2021 г. упала до минимального уровня с начала года. Что касается ее июльского подъема в США и Великобритании (в первую очередь из-за распространения вирусного варианта дельта), то директор Центров по контролю и профилактике заболеваний в США Р. Валенски назвала его «в основном эпидемией непривитых». Однако нужно отметить, что вариант дельта в несколько раз более заразный, чем прежние, и в принципе способен «пробивать» иммунитет у некоторых давно вакцинированных людей.
В России на начало лета новой коронавирусной инфекцией переболело, по данным санкт-петербургских исследователей, около 30% населения (Barchuk et al., 2021). В это время у нас началась мощная третья волна заболеваемости COVID-9. Причин этому несколько: от пренебрежения противоэпидемическими мерами, включая защитные маски, и проведения масштабных публичных мероприятий до массового заноса из Индии варианта дельты. При этом одна из самых значимых причин — низкий уровень вакцинирования населения. И если мы кардинально не изменим ситуацию с вакцинацией и противоэпидемическими мерами, то у нас будут и четвертая, и пятая, и шестая волны.
Главное — это не просто издавать приказы, а тщательно отслеживать и контролировать их выполнение. Ведь, к примеру, вакцин у нас откровенно не хватает: «Спутник V» пока производится в недостаточном количестве, а ее первый компонент в качестве однокомпонентной вакцины «Спутник Лайт» лишь недавно был разрешен к использованию для пожилых людей. И в этом отношении совершенно непонятен призыв к ревакцинации, в то время как около трех четвертей населения не вакцинировано вообще.
Подводя итоги, можно сказать, что на сегодняшний день уже есть более-менее безопасные вакцины с эффективной защитой от этой инфекции.
За векторными вакцинами — будущее для здоровых людей, потому что разработать их можно быстро, они дают сильный иммунитет и относительно дешевы. Производство таких вакцин легко масштабировать, их проще перевозить и хранить. Но и поствакцинальные реакции на них есть. И в этом смысле самыми перспективными являются вакцины на основе мРНК, как наиболее очищенные и минимизированные по составу, а также числу и тяжести побочных реакций. Производство этих вакцин также можно масштабировать, однако они существенно дороже, а перевозить и хранить их надо при низких (до минус 70°С) температурах.
Нельзя забывать и о классических инактивированных вакцинах, которые сейчас массово выпускаются в Индии и Китае и начали производиться в России и Казахстане.
Но окончательно сравнить все вакцины против COVID-19 можно будет только после финальных оценок их реального защитного эффекта, побочных реакций и безопасности, которые будут сделаны на основе анализа заболеваемости на больших выборках из вакцинированных и невакцинированных людей. Публикации подобных результатов ожидаются в начале 2022 г.
Безусловно, защитный эффект от любых вакцин может утрачиваться со временем, поэтому вакцинации от COVID-19 станут, скорее всего, регулярными — раз в 2–3 года, а то и чаще. И SARS-CoV-2, по-видимому, войдет в нашу жизнь так же, как в нее вошли вирусы гриппа, «обычные» коронавирусы и другие возбудители ОРВИ.
Литература
1. Abu-Raddad L. J., Chemaitelly H., Butt A. A. Effectiveness of the BNT162b2 Covid-19 Vaccine against the B.1.1.7 and B.1.351 Variants // NEJM. 2021. V. 385. № 2. P. 187–189. DOI: 10.1056/NEJMc2104974.
2. Halstead S. B., Katzelnick L. COVID-19 Vaccines: Should We Fear ADE? // The Journal of Infectious Diseases. 2020. V. 222. P. 1946–1950.
3. Logunov D. Y., Dolzhikova I. V., Zubkova O. V., et al. Safety and Immunogenicity of an rAd26 and rAd5 Vector-based Heterologous Prime-boost COVID-19 Vaccine in Two Formulations: Two open, Non-randomised Phase 1/2 Studies from Russia // The Lancet. 2020. V. 396. P. 887–897.
4. Logunov D. Y., Dolzhikova I. V., Shcheblyakov D. V., et al. Safety and Immunogenicity of an rAd26 and rAd5 Vector-based Heterologous Prime-boost COVID-19 Vaccine in Two Formulations: Two open, Non-randomised Phase 1/2 Studies from Russia // The Lancet. 2021. V. 397. P. 671–681.
5. Shimabukuro T. T., Kim S. Y., Myers T. R., et al. Preliminary Findings of mRNA Covid-19 Vaccine Safety in Pregnant Persons // NEJM. 2021. V. 384. P. 2273–2282.