мутация в гене braf не обнаружена что это значит
Мутация гена BRAF при меланоме
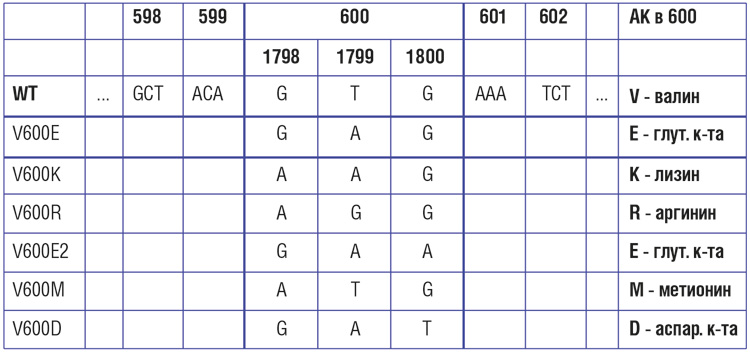
Частота и виды мутаций в гене BRAF
Частота мутаций в гене BRAF при меланоме кожи, по данным разных исследователей, варьирует от 30-40% до 70%. Наиболее распространенной (69-94% случаев) разновидностью BRAF-мутаций является V600E – замена валина на глутамин в 600-м кодоне. Эта мутация представляется доминирующей, но далеко не единственной разновидностью нарушений BRAF [14, 15]. Второй по частоте является мутация V600К – ее частота может достигать 5-10%. Мутации V600D и V600R встречаются значительно реже.
Cтатус мутации гена BRAF и выбор тактики лечения
За последние годы достигнуты значительные успехи в изучении патогенетических основ развития меланомы и сделан огромный шаг к выявлению новых потенциальных молекулярных мишеней. Открытие молекулярной мишени BRAF и понимание ее роли в патогенезе меланомы легли в основу разработки нового класса препаратов – низкомолекулярных ингибиторов мутированного фермента BRAF. Использование этих препаратов позволяет блокировать патологически активированный сигнальный каскад, который запускается мутацией BRAF V600, и, таким образом, тормозить развитие опухоли. Следует особо отметить, что воздействие данной группы препаратов на опухолевые клетки с нормальной последовательностью BRAF, напротив, может сопровождаться патологической активацией каскада RAS-RAF-MEK-ERK и провоцировать рост меланомы. Этот феномен свидетельствует об исключительной важности достоверной диагностики статуса гена BRAF.
BRAF ингибиторы не должны использоваться в тех случаях, когда статус мутации BRAF не определен или мутация не обнаружена!
Следует подчеркнуть, что ингибиторы BRAF и MEK зарегистрированы к применению только для терапии метастатической формы меланомы. В настоящее время отсутствуют данные по использованию ингибиторов BRAF и MEK в адъювантном режиме, поэтому они не могут быть рекомендованы пациентам, перенесшим (условно-)радикальное удаление первичной меланомы и метастических очагов.
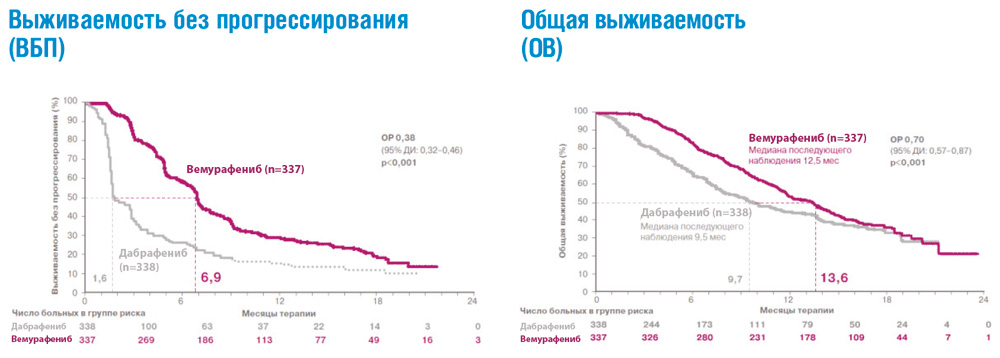
В рандомизированных клинических исследованиях ингибиторы BRAF – вемурафениб и дабрафениб – продемонстрировали значительное преимущество по сравнению со стандартной химиотерапией в отношении частоты объективных ответов, продолжительности жизни без прогрессирования и общей продолжительности жизни у пациентов с метастатической меланомой и подтвержденной мутацией гена BRAF, ранее не получавших системного лечения (см. рис. 2). Полученные результаты привели к пересмотру международных клинических рекомендаций, которые включили эти препараты в современные стандарты лечения метастатической меланомы кожи с BRAF мутацией.
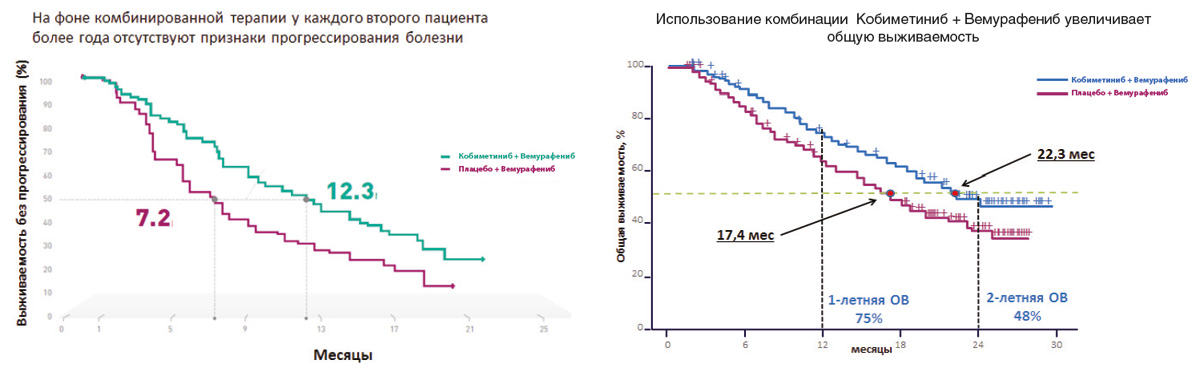
Результаты последних исследований показали, что двойное ингибирование сигнального пути MAРK, которое достигается при одновременном использовании ингибиторов BRAF и MEK, обладает более высокой эффективностью по сравнению с ингибитором BRAF в монорежиме. Важно отметить, что помимо более высокой эффективности комбинация препаратов снижает вероятность развития резистентности к проводимой терапии и отдельных нежелательных явлений, в том числе плоскоклеточного рака кожи. В рамках клинического исследования coBRIM было подтверждено, что комбинированная терапия с использованием препаратов вемурафениб и кобиметиниб в 90% случаев позволяет достичь ответа на терапию у больных BRAF+ метастатической меланомой. У каждого второго пациента более года отсутствовали признаки прогрессирования заболевания, а общая выживаемость приближалась к 2 годам (рис. 3).
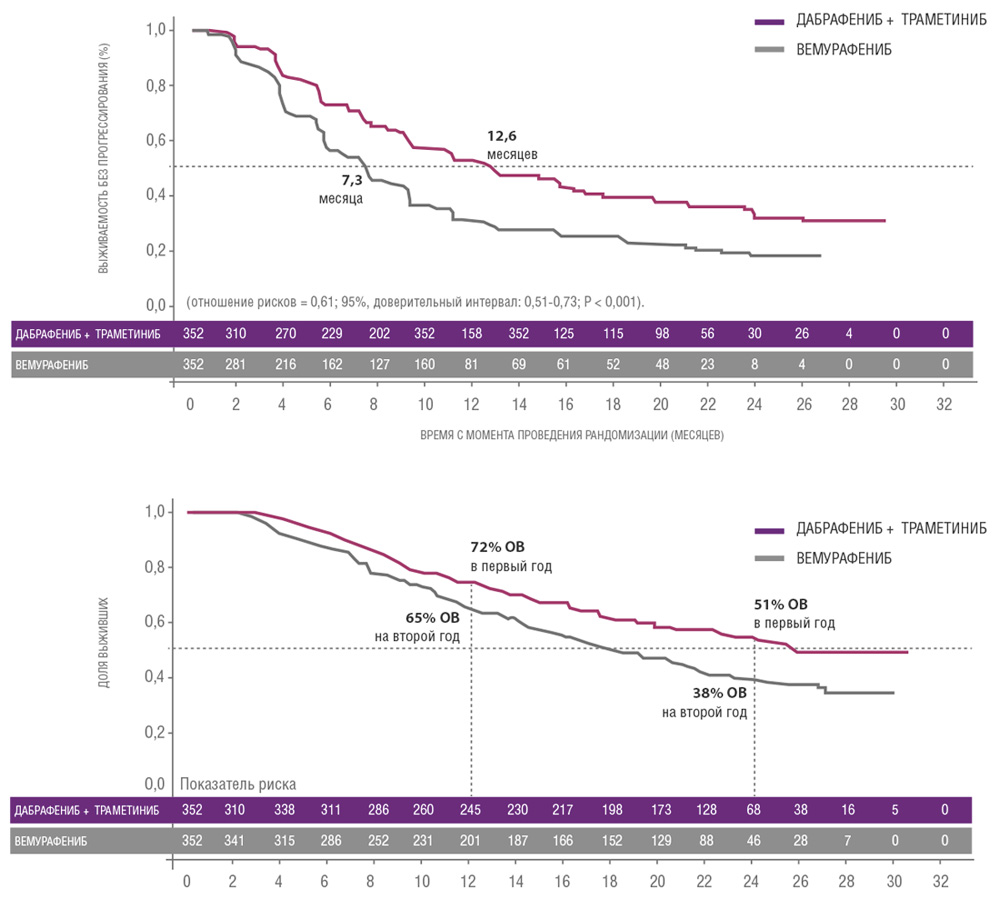
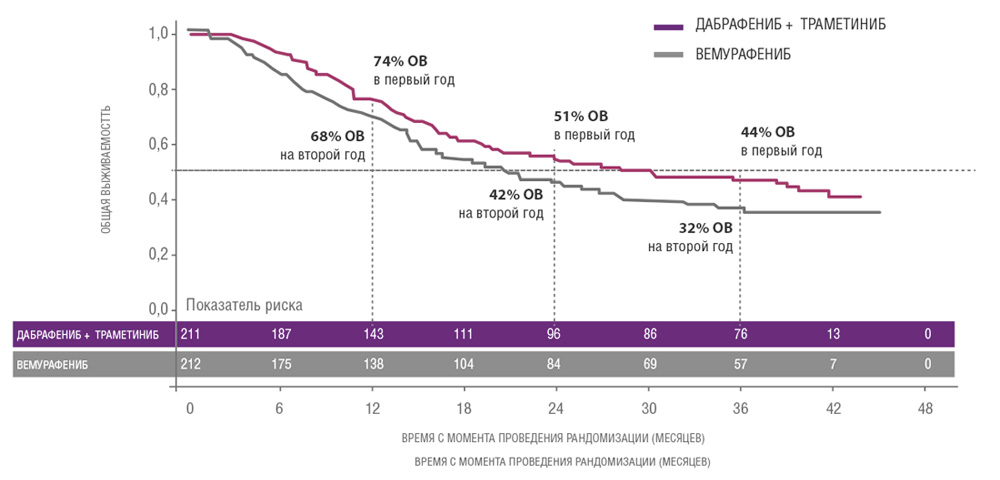
Сходные результаты были продемонстрированы в исследованиях дабрафениба и траметиниба. В частности, исследование COMBI-V (дабрафениб+траметиниб vs монотерапия вемурафенибом) продемонстрировало значимой увеличение общей продолжительности жизни у пациентов, получавших комбинированную терапию, по сравнению с применением вемурафениба без ингибитора MEK (25.6 мес. vs 18 мес.; рис. 4, табл. 1). В клиническом испытании COMBI-D сравнивалась эффективность комбинации дабрафениб+траметиниб по отношению к монотерапии дабрафенибом в сочетании с плацебо. Примечательно, что в этом исследовании были зарегистрированы практические идентичные показатели общей продолжительности жизни (25.1 мес. vs 18.7 мес.; рис. 5, табл. 1).
Определение статуса гена BRAF является обязательным компонентом выработки тактики лечения всех пациентов с неоперабельной/метастатической меланомой кожи.
Рисунок 2. Результаты рандомизированного исследования BRIM-3: сравнение эффективности вемурафениба и дабрафениба в 1-й линии терапии метастатической меланомы с мутацией BRAF.
Рисунок 3. Результаты рандомизированного исследования coBRIM: сравнение эффективности комбинации кобиметиниба+вемурафениба и вемурафениба+плацебо в 1-й линии терапии метастатической меланомы с мутацией BRAF.
Рисунок 4. Результаты клинического исследования COMBI-V: (дабрафениб+траметиниб vs монотерапия вемурафенибом).
Рисунок 5. Результаты клинического испытания COMBI-D: эффективность комбинации дабрафениб+траметиниб по отношению к монотерапии дабрафенибом в сочетании с плацебо.
Сводные данные по всем исследованиям представлены в таблице 1.
| Исследование | COMBI-d | COMBI-v | ||
|---|---|---|---|---|
| Препарат(ы) | Д + T | Д + пла | Д + T | В |
| Кол-во пациентов, n | 211 | 212 | 352 | 352 |
| Медиана ВБП, мес. | 11,0 | 8,8 | 12,6 | 7,3 |
| Медиана ОВ, мес. | 25,1 | 18,7 | 25,6 | 18,0 |
| Медиана ОВ, ЛДГ≤ВГН | Нет анализа | НД | 21,5 | |
| Медиана ОВ, ЛДГ>ВГН | 10,8 | 8,9 | ||
Сокращения: В – вемурафениб, К – кобиметиниб, Д – дабрафениб, Т- траметиниб, пла – плацебо, НД – не достигнута, ВГН – верхняя граница нормы.
Таким образом, использование BRAF/MEK ингибиторов у пациентов с мМК, имеющей BRAF мутацию, представляет первый успешный пример персонализированной терапии, изменившей представление о мМК как об опухоли, рефрактерной к лекарственному лечению. Эти препараты пришли на смену химиотерапии и стали новым стандартом лечения меланомы с BRAF мутацией, что подтверждает ранее сформулированный постулат о необходимости разработки различных подходов к лечению для различных молекулярно-генетических подтипов меланомы. Появляются результаты исследований таргетных препаратов и при других типах меланомы, имеющих альтернативные мутации (NRAS, cKIT). Можно ожидать, что определение молекулярно-генетического портрета опухоли уже в ближайшее время станет неотъемлимой частью разработки стратегии лечения каждого пациента, имеющего диагноз «меланома».
На сегодняшний день все существующие BRAF и MEK ингибиторы зарегистрированы на территории Российской Федерации и, при соответствующем лекарственном обеспечении, с успехом могут быть использованы для терапии мМК. Профиль безопасности этих препаратов позволяет использовать их в амбулаторных условиях.
Для того, чтобы отправить материал на диагностику, вы должны быть зарегистрированным пользователем. Если у вас уже есть логин и пароль, то повторная регистрация не требуется.
Если вы новый пользователь, пожалуйста, пройдите процедуру регистрации.
Мутация в гене braf не обнаружена что это значит
С увеличением покрытия молекулярно-генетическим тестированием популяции пациентов с метастатическим колоректальным раком все чаще в клинической практике встречаются больные с мутацией в гене BRAF и все актуальнее становится вопрос, можно ли применять стандартные подходы в лечении рака толстой кишки с данной альтерацией или нет. К настоящему времени уже известно об агрессивном течении данного подтипа опухоли [1] с медианой продолжительности жизни пациентов с момента начала первой линии терапии в академических центрах всего 11,7 месяца [2], низкой эффективности добавления анти-EGFR моноклональных антител к химиотерапии [1], частотой встречаемости в РФ 5% [3], эффективности во второй и последующих линиях лечения комбинации BRAF ингибиторов с анти-EGFR антителами [4]. В данной статье рассмотрим, на какие вопросы удалось ответить исследователям по результатам работ, представленных на ASCO 2021 года, касаемых метастатического рака толстой кишки с мутацией в гене BRAF.
Несмотря на внедрение молекулярно-генетического профилирования при метастатическом колоректальном раке, можно видеть, что в зависимости от региона земного шара даже в современных условиях имеется значимое отставание в определении мутационного статуса гена BRAF. И если в восточной Азии, западной Европе, Северной Америке и Австралии частота определения профиля гена BRAF находится на уровне 88-97%, то уже в восточной Европе, Африке/Индии/Ближнем Востоке и Южной Америке она составляет всего 47%, 67% и 52% соответственно [5]. Вероятно, в РФ частота определения мутационного статуса гена BRAF находится на уровне восточной Европы. А здесь принципиально помнить, что кроме негативного предикторного значения в отношении эффективности добавления анти-EGFR антител к химиотерапии, наличие мутации в гене BRAF определяет эффективность нового лечебного подхода – сочетания ингибитора BRAF с анти-EGFR моноклональным антителом. Так, в рандомизированном исследовании III фазы BEACON при сравнении комбинации BRAF ингибитора (энкорафениба), анти-EGFR антитела (цетуксимаба) с или без MEK ингибитора (биниметиниба) и комбинации иринотекана или режима FOLFIRI с цетуксимабом во 2-3 линии лечения больных метастатическим раком толстой кишки с мутацией в гене BRAF применение тройной или двойной комбинации таргетных препаратов привело к увеличению в 10 раз частоты объективных эффектов (26,8 и 19,5% соответственно) в сравнении с контрольной группой (1,8%). При этом наибольшая частота объективных эффектов зарегистрирована при применении тройной комбинации во второй линии терапии – 28%. Применение комбинации BRAF, MEK ингибитора и анти-EGFR антитела также привело к снижению риска смерти на 40% (ОР 0,6; 95% ДИ 0,47-0,75; р
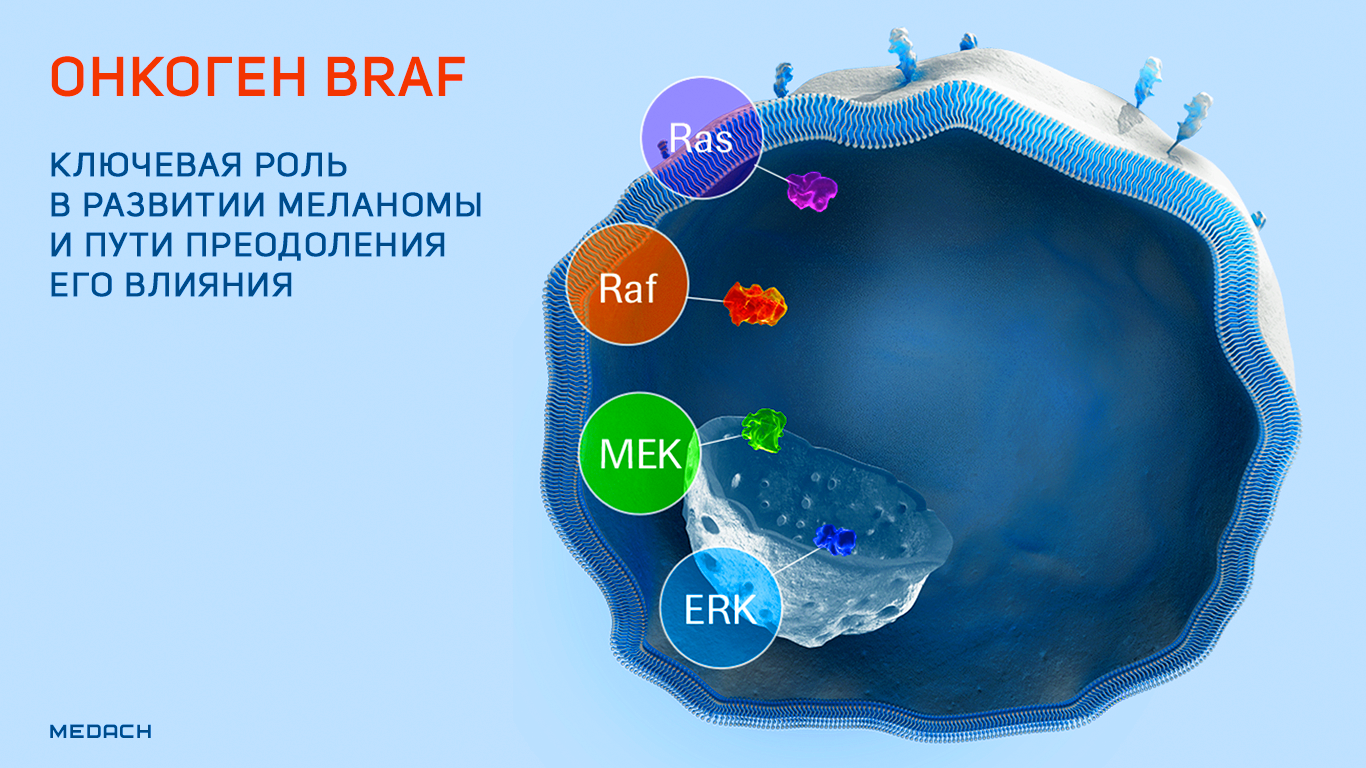
Онкоген BRAF: ключевая роль в развитии меланомы и пути преодоления его влияния.
BRAF является достаточно известным онкогеном, а вот приставка V600E после его названия ясна не каждому. Между тем мутация в структуре данного онкогена играет ключевую роль в развитии меланомы — опухоли с одним из самых неблагоприятных прогнозов. В этом материале будут рассмотрены история разработки средств против меланомы с мутацией в гене BRAF и пути преодоления резистентности последнего к современной таргетной терапии.
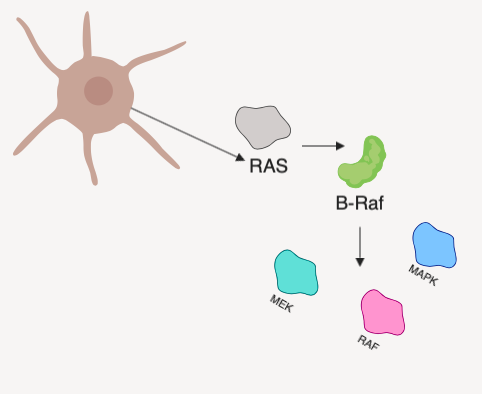
BRAF представляет собой онкоген, кодирующий белок B-Raf — серин-треонин протеинкиназу, участвующую в функционировании высокоонкогенных сигнальных путей RAS/RAF/MEK/ERK (название одного из перечисленных сигнальных путей и дало имя данному белку и его гену). Продукт BRAF обнаруживается в клетках абсолютно разных типов в неактивном состоянии. Его функциональная активация происходит путем димеризации под действием сигнального пути RAS. Активированный B-Raf фосфорилирует и активирует другие ассоциированные сигнальные пути, и киназный каскад, запускаемый в результате этих процессов, поддерживает выживание клеток и их пролиферацию, одновременно ингибируя дифференцировку [1].
Рисунок 1 | Упрощенная схема активации сигнальных путей, в которых принимает участие протеин B-Raf.
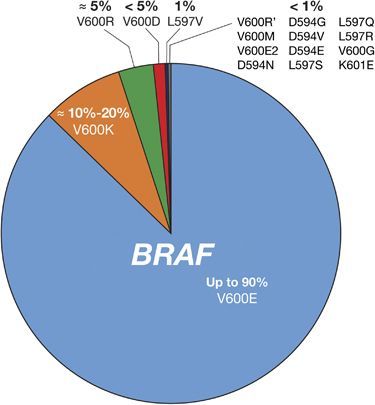
BRAF и его продукт играют критическую роль в формировании опухолей человеческих тканей. Около 7 % всех опухолей связаны с мутацией данного гена, включая 100 % случаев волосатоклеточного лейкоза, 50–60 % случаев меланомы, 30–50 % случаев папиллярной карциномы щитовидной железы, 10–20 % случаев колоректальных опухолей и 3–5 % случаев немелкоклеточного рака легкого. Самой распространенной мутацией является нуклеотидная замена, которая превращает валин в позиции 600 в глутамин (мутация V600E), лизин (мутация V600K) или другую аминокислоту (V600 A/D/G/L и другие). Подобные мутации способствуют тому, что B-Raf перестает зависеть от активации сигнального пути RAS и становится функционально активным в форме мономера [1].
Рисунок 2 | Частота встречаемости наиболее распространенных мутаций BRAF.
Обнаружение активирующих мутаций в данной серин-треонин киназе послужило основой волны последующих исследований того, насколько критическую роль играют ассоциированные с ней сигнальные пути в инициации и прогрессии меланомы и других опухолей. Так, активация ассоциированного с B-Raf сигнального пути МАРК in vivo ассоциируется с пролиферацией клеток меланомы. Доклинические исследования, длившиеся более 15 лет, утвердили, что центральную роль в контроле пролиферации клеток меланомы играет мутация BRAF V600E. Кроме того, данная активирующая мутация оказывает влияние на апоптоз, миграцию, инвазию клеток меланомы, метаболизм глюкозы в них, их адаптацию к гипоксии и ангиогенез формирующейся опухоли. Таким образом, чувствительность опухоли к химиотерапии обретает зависимость не только от функциональной активности B-Raf, но и от скорости протекания в ее клетках процессов, связанных с активацией МАРК [2].
Определение и характеристика мутаций BRAF оказывает существенное влияние на подбор терапии меланомы. Выявление мутаций в структуре этого онкогена осуществляется путем проведения методов генетического секвенирования [3]. Подробнее эти методы рассмотрены в данном материале.
До открытия активирующих мутаций в гене BRAF, меланома крайне тяжело поддавалась терапии. Классическая химиотерапия и пролекарство дакарбазин демонстрировали небольшие терапевтические возможности для клиницистов, стремящихся снизить заболеваемость данным типом опухоли. В 2002 году было обнаружено наличие мутаций BRAF в 60 % случаев меланом, что сыграло огромную роль в определении сущности данного гена в инициации и прогрессировании опухолей кожи. Сегодня известно, что активирующая мутация BRAF обнаруживается в 50 % случаев меланом и в 80 % тканей меланоцитарных невусов. Явная ассоциация данного онкогена с формированием меланоцитарных опухолей дала основу для разработки средств таргетной терапии меланомы, что принесло новую надежду как клиницистам, так и пациентам.
Первый препарат антител, активных против B-Raf, был разработан в 2011 году [4]. Первоначально для таргетной терапии меланомы ингибиторы BRAF (вемурафениб, дабрафениб) использовались как самостоятельные агенты. В дальнейшем была выявлена способность клеток меланомы к формированию резистентности против таких агентов. Одни из наиболее распространенных путей такой фармакорезистентности — это реактивация сигнального пути МАРК, ограничение апоптоза клеток меланомы, а также активация сигнального пути PI3K, стабилизирующего выживаемость меланомных клеток «в обход» МАРК [2, 5].
В настоящее время во избежание формирования терапевтической резистентности при лечении меланомы ингибиторы BRAF комбинируют с ингибиторами другого онкогенного сигнального пути — МЕК (такими препаратами являются биниметиниб и траметиниб). Систематические обзоры и мета-анализы продемонстрировали, что применение подобной комбинации увеличивает общую продолжительность жизни пациентов и замедляет прогрессирование опухоли в сравнении с монотерапией только ингибиторами BRAF [6].
К сожалению, несмотря на обилие современных разработок, меланома по-прежнему ассоциируется с крайне негативным терапевтическим прогнозом и малой общей выживаемостью. Разработки средств таргетной терапии данной опухоли непременно должны продолжаться — возможно, еще одна новая комбинация поможет существенно снизить смертность от этой патологии и сделать диагноз «меланома» менее пугающим.
Источники:
1. The landscape of BRAF transcript and protein variants in human cancer. / Andrea Marranci, Zhijie Jiang, Marianna Vitello [et al]. // Mol Cancer. — 2017. — Vol. 16. — p. 85.
2. Overcoming resistance to BRAF inhibitors. / Imanol Arozarena, Claudia Wellbrock. // Ann Transl Med. — 2017. — Vol. 5, №19. — p. 387.
3. Rapid BRAF mutation tests in patients with advanced melanoma: comparison of immunohistochemistry, droplet digital PCR, and the Idylla mutation platform. / Cornelis Bisschop, Arja ter Elst, Lisette J. Bosman [et al]. // Melanoma Res. — 2018. — Vol. 28, №2. — p. 96-104.
4. BRAF V600E-specific antibody: a review. / Ritterhouse LL, Barletta JA. // Semin Diagn Pathol. — 2015. — Vol. 32, №5. — p. 400-408.
5. BRAF-mutant melanoma: treatment approaches, resistance mechanisms, and diagnostic strategies. / Francesco Spagnolo, Paola Ghiorzo, Laura Orgiano [et al]. // Onco Targets Ther. — 2015. — Vol. 8. — p. 157-168.
6. Combination therapy of BRAF inhibitors for advanced melanoma with BRAF V600 mutation: a systematic review and meta-analysis. / Kim S, Kim HT, Suh HS. // J Dermatol Treat. — 2018. — Vol. 29, №3. — p. 314-321.
Мутации меланомы braf, c-kit, nras
Меланома — агрессивный рак кожи, который диагностируется у 2,5-10% пациентов и имеет высокую вероятность злокачественного течения. Для нее характерны стремительное прогрессирование и быстрый переход с 1 до 4 стадии развития.
Опасность мутации меланомы
Такой рак относится к самым агрессивным видам онкологии. Иммунная система человека слабо реагирует на меланому, из-за чего опухоль быстро развивается – от начальной стадии до опасной для жизни проходят недели, а в отдельных случаях дни. При меланоме довольно часто возникают рецидивы, а метастазы проникают практически во все органы.
Чтобы повысить вероятность благоприятного исхода и выздоровления, а также снизить риск метастазирования, важно своевременно проводить точную диагностику, в том числе на определение генной мутации.
Дело в том, что в основе развития заболевания нередко «повинны» генетические мутации. Поэтому в МеланомаЮнит большое значение уделяется генетической диагностике, позволяющей выявить причинно-следственные мутации и подобрать прицельное лечение. Этим задачам отвечает таргетная терапия — специально подобранные средства, воздействующие на клетки-мишени опухоли конкретного пациента, не затрагивая при этом здоровые ткани.
Чаще всего встречаются и активно используются в составлении плана лечения три генетические мутации: BRAF, NRAS и c-Kit.
Мутация BRAF
Самый распространенный вид мутации, который диагностируется у 40-70% пациентов с меланомой. Свое название BRAF получило от гена, участвующего в регуляции деления клеток за счет активации специфического сигнального пути. При изменении его структуры возникает мутация и процесс деления выходит из-под контроля.
обеспечивающий образование белка после мутации. Этот белок провоцирует патологический рост клеток, в результате которого формируется опухоль.
В норме ген BRAF неактивен, но при определенных обстоятельствах начинает «работать» и развивается меланома.
Мутация NRAS
На нее приходится около 15-20% случаев, и в основе лежит механизм «поломки» гена, который провоцирует активную выработку белка — активатора злокачественного роста и размножения клеток. При составлении схемы лечения одной из задач онколога блокировка синтеза протеинкиназы. В настоящее время препараты, воздействующие на данный вид мутации, проходят клинические испытания. Но уже на этом этапе специалисты отмечают положительные результаты и фиксируют замедление развития опухоли.
Мутация c-Kit
Меланома ассоциирована с мутацией c-Kit у 6-15% пациентов с меланомой, возникающей преимущественно на слизистой оболочке половых органов, прямой кишки и носоглотки, а также на кистях и ладонях. При диагностике такой мутации врач назначает препараты-ингибиторы c-Kit.
Очень важно выявить мутацию, так как в настоящее время существует прицельное лечение, позволяющее «блокировать» измененный ген. Использование этих препаратов позволяет блокировать патологически активированный сигнальный каскад, который запускается мутацией генов. Это в свою очередь тормозит развитие опухоли. Ранняя диагностика и своевременное лечение в таком случае позволяет значительно увеличить шансы на благоприятный исход заболевания.
Преимущества диагностики и лечения рака кожи в МеланомаЮнит:
Записаться на прием к дерматоонкологу МеланомаЮнит можно по телефону.
Определение мутации в генах EGFR и V600 BRAF
Каждая клетка организма подчиняется определенным законом и выполняет отведенные ей функции. Работа клеток программируется генетическим кодом, молекулы и белки регулируют жизнь клеток, обеспечивая бесперебойное функционирование организма. Однако в любом механизме могут происходить поломки, и наши гены – не исключение. Сегодня мы расскажем о мутациях в генах EGFR и BRAF. Тестирование на эти мутации помогает онкологам назначать эффективное лечение пациентам со злокачественными новообразованиями.
Биологические функции гена EGFR?
Ключевое свойство любой опухоли — это нарушение баланса между клеточным делением, т.е. размножением клеток, и клеточной гибелью. Для того, чтобы процесс деления осуществлялся в норме, необходимо поступление верного сигнала в клеточное ядро. Подобным сигналом являются специальные белки – факторы роста. Например, фактором роста может выступать белок EGF (Epidermal Growth Factor ‒ перевод «эпидермальный фактор роста»). EGF и другие белки способны стимулировать рост и деление различных клеток.
Белок EGF взаимодействует с соответствующим рецептором на мембране (оболочке) клетки — EGFR (epidermal growth factor receptor). Белок подает «команду» рецептору, в результате внутри клеток запускается последовательность биохимических реакций и клетки начинают делиться. Рецептор EGFR кодируется геном EGFR. Если в гене EGFR есть мутация, то изменяется структура рецептора. Рецептору больше не нужно взаимодействовать с ростовым фактором, т.е. ему больше не нужна «команда» для активации. Вследствие этого в клетках с мутацией сигналы к делению передаются непрерывно, клетки начинают активно делиться и происходит рост опухоли, а также усиление процессов инвазии (прорастания в окружающие ткани), патологического ангиогенеза (образования новых сосудов в опухоли) и метастазирования.
Открытие мутаций в гене EGFR при раке легкого стало одним из важнейших событий в онкологии. Повышенное количество данного белка наблюдается при многих видах рака. С учетом этого факта ученые и медики разрабатывали ингибиторы – вещества, которые подавляют или задерживают течение физиологических или физико-химических процессов. Ожидалось, что эти препараты могут стать «универсальным лекарством против рака». Однако на практике у пациентов редко наблюдались объективные ответы на ингибитор EGFR гефитиниб, т.е. терапия редко оказывала ожидаемый эффект. При этом для малого количества пациентов лечение было эффективным. Врачи выяснили, что опухоли этих пациентов содержали в своём геноме ранее неизвестные мутации в гене EGFR.
Таким образом стало понятно, что именно мутированный белок EGFR является мишенью препарата, и что перед назначением молекулярных ингибиторов EGFR должно проводиться молекулярно-генетическое тестирование. Существует несколько вариантов мутаций EGFR, две из них встречаются наиболее часто – Del19 и L858R. Они встречаются в 15-20% немелкоклеточных неплоскоклеточных опухолей легкого, наиболее часто – в аденокарциномах.
В каких случаях нужно сделать тест на мутацию EGFR?
Тест на мутации в гене EGFR позволяет онкологу принять решение о назначении пациенту с местно-распространенным или метастатическим немелкоклеточным раком легкого терапии низкомолекулярными ингибиторами EGFR (гефитиниб, эрлотиниб, афатиниб, осимертиниб и т.д.). Тест целесообразно назначать только тем пациентам, у которых обнаружена аденокарцинома лёгкого или другая разновидность немелкоклеточного неплоскоклеточного рака. Помимо этого, EGFR-тестирование рекомендуется всем пациентам с местно-распространенным или метастатическим, плоскоклеточным раком лёгкого, которые либо являются женщинами, либо не имеют анамнеза длительного и/или интенсивного курения.
Что делать, если в опухоли лёгкого обнаружена мутация в гене EGFR?
Идентификация мутации в гене EGFR в опухоли является основанием для назначения низкомолекулярных ингибиторов EGFR (гефитиниб, эрлотиниб, афатиниб, осимертиниб). Положительный эффект от лечения наблюдается практически у каждого пациента с мутацией EGFR.
Биологические функции гена BRAF
Процесс деления клеток в норме происходит при поступлении верного сигнала в клеточное ядро. Подобным сигналом являются специальные белки – факторы роста. Они прикрепляются к определённым рецепторам на поверхности клеточной оболочки и запускают внутри клетки ряд последовательных биохимических реакций. Результатом становится производство и накопление внутри клетки белков, которые необходимы для дальнейшего деления.
Белок BRAF принимает участие в описанной выше сигнальной цепи EGFR. В норме BRAF активируется только при поступлении сигнала от расположенного «выше» по цепи белка. А мутации BRAF могут привести к автономной активации процесса деления клетки, т.е. клетки начинают размножаться без «команды» организма.
Наиболее частый тип мутации – это замена 600-ой по счету аминокислоты валин (V) в структуре белка на глутаминовую кислоту (E) (BRAF V600E).
Мутации BRAF встречаются при самых разных типах рака, чаще всего – при меланоме (40-60%), реже – при раке толстой кишки (5-10%), немелкоклеточном раке легкого (2-3%) и др. Помимо этого, генетические дефекты BRAF характерны для редкого онкогематологического заболевания – волосатоклеточного лейкоза (90-100%).
Открытие мутаций гена BRAF привело к созданию низкомолекулярных ингибиторов мутированного фермента BRAF (вемурафениб, дабрафениб). Эти препараты блокируют сигнальную цепочку, которую активирует мутация BRAF, и таким образом держивают рост опухоли.
В каких случаях нужно сделать тест на мутацию V600 BRAF?
Тестирование мутаций в гене BRAF необходимо для выбора тактики лечения при неоперабельной/метастатической меланоме кожи, распространенном немелкоклеточным раке легкого и раке толстой кишки. Присутствие мутации является необходимым условием для назначения ингибиторов BRAF (вемурафениб, дабрафениб). При раке толстой кишки наличие мутации BRAF свидетельствует о необходимости использования комбинации BRAF- и EGFR-ингибиторов.
В настоящее время определение мутаций V600 BRAF в биопсийном производится при диагнозах «меланома кожи и слизистых оболочек», «рак прямой кишки», «рак ободочной кишки и ректосигмоидного отдела», «волосатоклеточный лейкоз»
Как сдать анализ на мутации в гене EGFR и BRAF?
Материалом для молекулярно-генетического тестирования являются опухолевые клетки. В качестве источника опухолевых клеток можно использовать как биопсийный материал, так и опухоль, удалённую в ходе хирургической операции.
В ходе первичного обследования онкологическому пациенту практически всегда выполняют биопсию, на основании которой происходит патоморфологическое подтверждение диагноза. Для этого каждый биоптат проходит многоэтапную химическую обработку, в результате которой создаётся специальный парафиновый блок. С одной стороны, это необходимо для получения качественного тонкого среза (толщиной 5 мкм) с целью патоморфологической диагностики. С другой стороны, в правильно подготовленном парафиновом блоке молекулы ДНК надёжно сохраняются на протяжении десятилетий. Эти же процедуры выполняются в отношение опухолевых тканей, удалённых в ходе операции. Правильное выполнение процедуры фиксации позволяет использовать образцы опухолей для молекулярно-генетического исследования ДНК спустя месяцы и годы после заливки образца в парафин.
Идеальным набором для молекулярно-генетического исследования является следующий комплект: парафиновый блок c тканью опухоли и одно стекло, окрашенное гематоксилином и эозином (всё перечисленное хранится в патологоанатомических архивах медицинских учреждений, а окраска гематоксилином и эозином – основная окраска, используемая в современной патоморфологической диагностике). Если медицинское учреждение по какой-либо причине не может предоставить блоки, то для молекулярно-генетического тестирования достаточно 5-10 неокрашенных срезов ткани опухоли на непокрытых стёклах толщиной 3-5 мкм и одно стекло, окрашенное гематоксилином и эозином.
Кроме того, для молекулярно-генетического исследования пригодны опухолевые клетки, полученные в результате цитологического исследования (мазки, цитоспины, цитоблоки). Для проведения теста необходимо, чтобы в препарате присутствовало не менее 200 (!) опухолевых клеток. Тип окрашивания (по Папаниколау, Романовского-Гимза, Лейшмана, Май-Грюнвальд и т.д.) не влияет на сохранность нуклеиновых кислот.
Требования к упаковке материала перед транспортировкой
В настоящее время многие молекулярно-диагностические исследования выполняются за счет средств территориальных фондов ОМС регионов России
Авторская публикация:
Иванцов Александр Олегович
доктор медицинских наук, старший научный сотрудник научной лаборатории морфологии опухолей ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России