мутация протромбина что это такое
F2 Thr165Met. Ген протромбина (ген F2).
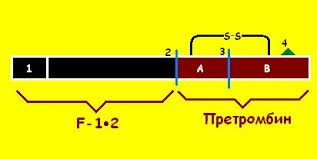
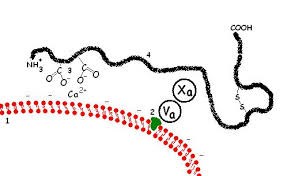
В организме механизм свертывания крови имеет каскадный характер: каждый участник, переходя в активное состояние, приобретает способность активировать другие факторы свертывания. Активация протромбина осуществляется протромбиназой, представляющей комплекс фосфолипида и ионов Ca2+ с факторами свертывания Va и Xa. В результате чего протромбин разлагается до трех пептидов: тромбин, фрагмент F1 и фрагмент F2, Тромбин включается в состав сгустка крови, фрагмент F2 слабо взаимодействует с кальцием. Согласно современным представлениям фрагмент F1 протромбина блокирует образование почечных камней.
Рис.1. Строение протромбина.
Рис.2. Протромбиназный комплекс
Ген протромбина локализован на 11 хромосоме человека в позиции 11p11-q12. Размер гена протромбина составляет 20210 пар оснований, разделяется на 14 экзонов 13 интронами.
Классической и достаточно изученной является мутация протромбина F2 G20210A (20210G>A, rs1799963). Мутацию связывают с наличием ряда мультифакториальных заболеваний: венозный тромбоз, тромбофилия, инфаркт миокарда, атеросклероз, диабет. Проявление генотипа с аллелями «риска» (G/A, A/A): мутация является фактором риска невынашивания беременности, фетоплацентарной недостаточности, внутриутробной гибели плода в I триместре, гестоза (преэклампсии), задержки развития плода, отслойки плаценты. Сдать анализ на мутацию гена F2 G20210A можно у нас в лаборатории ЦИР. Анализ включает выявление двух наиболее распространенных полиморфизмов, связанных с тромбофилией: F2 G20210A и FV 1691 G>A (мутация Лейдена).
Существует еще один вариант мутации гена протромбина – F2 Thr165Met (T165M, 494С>T, rs5896), однако в литературе имеется мало данных о наличии связи данной мутации T165M с возникновением тромбофилии в отличие от классической мутации F2 G20210A.
Однако доказана связь полиморфизма T165M с образованием мочекаменной болезни. Фрагмент протромбина 1 является одним из самых сильных белковых ингибиторов кристаллизации оксалата кальция. За счет значительного количества групп гамма-карбоксиглутаминовой кислоты в составе его молекулы фрагмент связывается с областями кристаллов оксалата кальция, образуя вокруг них протеинового «покрывала», которое препятствует сцеплению кристаллического материала. Считается, что генотип СС и присутствие аллеля С являются защитным фактором в развитии мочекаменной болезни. Есть данные, что полиморфизм 494С>T, который приводит к замене аминокислот треонина на метионин в положении 165 (Thr165Met), изменяет формирование Н-связи. В отличие от треонина метионин в 165 положении не способен образовывать Н-связь с глутаминовой кислотой из 180 положения, тем самым изменяя структуру и функцию белка фрагмента F1 мочевого протромбина (UPTF1). В связи с этим угнетается ингибирующее действие образования камней, приводящее к болезни. Отметим, что эта закономерность в исследовании была характерна для женской группы пациентов.
Также есть литературные данные о связи полиморфизма Т165М с развитием синдрома Ушера – генетического заболевания, характеризующегося сочетанием врожденной нейросенсорной тугоухости и потери зрения (пигментный ретинит). Наиболее частой причиной развития синдрома являются мутации в генах миозина VIIA (MY07A) и ушерина (USH2A), белковые продукты которых играют чрезвычайно важную роль в функционировании сетчатки и внутреннего уха. Известно, что различные мутации в гене MY07A также могут вызывать другие заболевания потери слуха. Есть данные, что полиморфизм Thr165Met имеет способность изменять третичную структуру белка, кодируемого геном MYO7A, тем самым увеличивая риск развития синдрома Ушера.
Тромбофилические и аутоиммунные нарушения.
При наличии репродуктивных проблем, подготовке к беременности, при наступлении беременности, планировании гормональной контрацепции, спектр анализов, связанных с тромбофилическими и аутоиммунными нарушениями гораздо шире.
Фактор свертываемости крови 2, протромбин (F2). Выявление мутации G20210A (регуляторная область гена)
Маркер связан с изменением уровня фактора II (протромбина) системы свертываемости крови. Исследуется для выявления генетической предрасположенности к тромбоэмболии, тромбозам, инфаркту миокарда, ишемической болезни сердца, тромбоэмболическим осложнениям во время беременности. Имеет прогностическое значение при приёме оральных контрацептивов и гормональной заместительной терапии.
Локализация гена на хромосоме — 11p11.2
Ген F2 кодирует свертывающий фактор II (F2), или протромбин, — гликопротеин, в неактивной форме присутствующий в плазме крови и являющийся предшественником тромбина – важнейшего компонента системы свертывания крови.
Генетический маркер F2 G20210А
Мутация гена F2 проявляется в замене гуанина (G) на аденин (А) в позиции 20210 регуляторной области гена и обозначается как генетический маркер G20210А.
Возможные генотипы
Частота встречаемости в популяции
Частота встречаемости аллеля А в европейской популяции составляет от 1,7 до 3%.
Ассоциация маркера с заболеваниями
Система гемостаза представляет собой совокупность биохимических процессов, обеспечивающих жидкое состояние крови, поддержание её нормальных реологических свойств (вязкости), предупреждение и остановку кровотечений. В нее входят факторы свёртывающей, естественной противосвертывающей и фибринолитической систем крови. В норме процессы в ней уравновешены, что обеспечивает жидкое состояние крови. Смещение этого равновесия вследствие внутренних или внешних факторов может повышать риск кровотечений или тромбообразования.
Наследственная тромбофилия (патология, обуславливающая повышенную склонность к тромбообразованию) – одно из самых распространенных генетических нарушений. Она часто остается недиагностированной и проявляется обычно в форме тромбоза глубоких вен и венозной тромбоэмболии. Нарушение свертываемости крови при наследственной тромбофилии в большинстве случаев вызывается изменениями в генах факторов свертывания крови II и V, связанными с известными генетическими маркерами (F2 G20210A, F5 G1691A). Именно они играют главную роль в развитии тромбофилии и ассоциированных с ней заболеваний.
Протромбин (фактор II) – витамин-К-зависимый гликопротеин, синтезируемый в печени и циркулирующий в крови в неактивной форме. При недостатке витамина К уровень протромбина в крови уменьшается, что может приводить к кровотечениям.
Протромбин активируется в тромбин комплексом фосфолипидов, ионов кальция, фактора Va (F5 активированного) и фактора Хa (F10, активированного). Активированный фермент тромбин играет важную роль в гемостазе – он преобразует фибриноген в фибрин при формировании сгустка крови, стимулирует агрегацию клеток и активирует свертывающие факторы F5, F8 и F13A1. Также тромбин ингибирует коагуляцию, активируя естественный антикоагулянт — протеин С.
Протромбин, или коагуляционный фактор II, является одним из главных компонентов свертывающей системы крови. При мутации гена протромбина повышается экспрессия гена, что в свою очередь приводит к повышению уровня протромбина в плазме. Мутация гена F2 проявляется в замене гуанина (G) на аденин (А) в позиции 20210 и обозначается как генетический маркер G20210А. Изменение происходит в регуляторном участке гена, поэтому нарушения структуры белка не происходит, но это влияет на регуляцию синтеза белка. У носителей аллеля А в крови обнаруживается повышенный уровень протромбина. Соответственно, риск образования тромбов возрастает.
Мутация в гене F2 наследуется по аутосомно-доминантному типу, поэтому патологический эффект реализуется даже при наличии одной копии поврежденного гена (генотип G/A).
Сочетание мутации гена протромбина и мутации Лейден увеличивает риск тромбофилии с ранним началом. Наряду с повышенным риском тромбозов наличие наследственной тромбофилии может быть связано с повышенным риском развития акушерских и гинекологических осложнений (привычное невынашивание, задержка внутриутробного развития плода, гестозы и др.).
Например, спонтанные аборты в первом триместре беременности чаще наблюдаются у пациенток с генотипом G/A. Поэтому для безопасного течения беременности необходимо своевременно выявить генетическую составляющую риска тромбоэмболических осложнений и начать их профилактику.
Проявление носительства тромбофилических генетических мутаций зависит также от возраста, факторов окружающей среды и наличия других мутаций. Носители аллеля, предрасполагающего к тромбофилии, могут не иметь никакой клинической симптоматики заболевания до появления внешних провоцирующих факторов. Негенетические факторы, такие как беременность, приём оральных контрацептивов, гормональная заместительная терапия, длительная иммобилизация, курение и другие, могут значительно увеличивать риск.
Особенно важна генетическая диагностика при наличии наследственной тромбофилии. Наследственный дефект коагуляции следует предполагать при отсутствии тромбоза в возрасте до 45 лет в отсутствие дополнительных факторов риска, например хирургического вмешательства или иммобилизации, при частых тромбозах у взрослых или тромбозе в детском возрасте. Генетическое исследование будет иметь профилактическое значение для человека в случае, если у его кровных родственников имелись тромботические заболевания в молодом возрасте.
Своевременная диагностика генетической предрасположенности к повышенной свертываемости крови поможет избежать серьезных последствий для сердечно-сосудистой системы и развития ассоциированных тяжелых заболеваний при проведении ранних профилактических и/или лечебных мероприятий.
Интерпретация результатов исследования должна проводиться врачом в комплексе с другими генетическими, анамнестическими, клиническими и лабораторными данными.
Исследование рекомендуется проводить в комплексах:
Мутация протромбина что это такое
Маркер связан с устойчивостью к действию активированного протеина С системы свертываемости крови (Лейденовская мутация). Исследуется для выявления генетической предрасположенности к тромбоэмболии, тромбозам, преэклампсии, тромбоэмболическим осложнениям во время беременности, ишемическому инсульту. Имеет прогностическое значение при приеме оральных контрацептивов и гормональной заместительной терапии.
Полимеразная цепная реакция в режиме реального времени.
Какой биоматериал можно использовать для исследования?
Венозную кровь, буккальный (щечный) эпителий.
Как правильно подготовиться к исследованию?
Специальной подготовки не требуется.
Локализация гена на хромосоме – 1q24.2
Ген F5 кодирует свертывающий фактор V (фактор Лейден), основной плазматический белок, регулирующий свертывание (коагуляцию) крови, выступая в качестве кофактора при превращении протромбина в тромбин фактором F10.
Генетический маркер F5 G1691A
Мутация гена F5 проявляется в замене гуанина (G) на аденин (А) в позиции 1691 и обозначается как генетический маркер G1691А (синонимы: фактор V Лейден, мутация Лейден, Лейденовская мутация). Следовательно, изменяются и биохимические свойства фермента, в котором происходит замена аминокислоты аргинин на глутамин.
G1691A – замена гуанина (G) на аденин (А) в позиции 1691 последовательности ДНК, кодирующей белок F5.
Arg506Gln – замена аминокислоты аргинина на глутамин в аминокислотной последовательности белка F5.
Возможные генотипы
Встречаемость в популяции
Встречаемость аллеля А составляет от 1 до 8 % в различных популяциях.
Ассоциация маркера с заболеваниями
Общая информация об исследовании
Система гемостаза представляет собой совокупность биохимических процессов, обеспечивающих жидкое состояние крови, поддержание ее нормальных реологических свойств (вязкости), предупреждение и остановку кровотечений. В нее входят факторы свертывающей, естественной противосвертывающей и фибринолитической систем крови. В норме процессы в ней уравновешены, что обеспечивает жидкое состояние крови. Смещение этого равновесия вследствие внутренних или внешних факторов может повышать риск кровотечений и тромбообразования, то есть тромбофилии.
Наследственная тромбофилия (патология, обуславливающая повышенную склонность к тромбообразованию) – одно из самых распространенных генетических нарушений. Она часто остается недиагностированной и проявляется обычно в форме тромбоза глубоких вен и венозной тромбоэмболии. Нарушение свертываемости крови при наследственной тромбофилии в большинстве случаев вызывается изменениями в генах факторов свертывания крови II и V, связанными с известными генетическими маркерами (F2 G20210A, F5 G1691A). Именно они играют главную роль в развитии тромбофилии и ассоциированных с ней заболеваний.
Ген F5 кодирует свертывающий фактор V, плазматический белок, постоянно циркулирующий в неактивной форме в крови. Его активация осуществляется белком – тромбином (F2), который с помощью ионов кальция объединяет вместе тяжелую и легкую цепь фактора V. Активированный фактор V (Vа) является основным белком, регулирующим свертывание (коагуляцию) крови, выступая в качестве кофактора при превращении протромбина в тромбин фактором F10.
Замена в положении 1691 аденина на гуанин в гене F5 приводит к замещению в молекуле белка F5 аминокислоты аргинина на глутамин в положении 506. Это один из трех участков фактора V, в которых он расщепляется естественным антикоагулянтом — активированным протеином C. При таком изменении в гене фактора V (мутация Лейден) риск образования тромбов значительно увеличивается за счет отсутствия возможности негативной регуляции работы фермента. Мутация в гене F5 наследуется по аутосомно-доминантному типу, поэтому патологический эффект реализуется даже при наличии одной копии поврежденного гена.
Проявление тромбофилических генетических мутаций зависит также от возраста, факторов окружающей среды и наличия других мутаций. У носителей аллеля, предрасполагающего к тромбофилии, заболевание может не проявляться до воздействия провоцирующих факторов, таких как беременность, прием оральных контрацептивов, гормональная заместительная терапия, длительная иммобилизация, курение.
Наряду с повышенным риском тромбозов наследственная тромбофилия может увеличивать вероятность развития акушерских и гинекологических осложнений (привычное невынашивание, задержка внутриутробного развития плода, гестозы и др.).
По исследованиям Gerhardt et al. (2000), среди беременных женщин с наличием в анамнезе венозной тромбоэмболии распространенность фактора V Лейден составила 43,7 %, по сравнению с 7,7 % среди здоровых женщин.
Риск тромбоза повышается при совместном носительстве мутации в гене F5 и по генетическому маркеру MTHFR (C677T), а также при наличии 20210G-мутации в гене протромбина. Такие сочетания увеличивают риск тромбофилии в раннем возрасте и способствуют более тяжелым тромбозам.
В исследованиях Casas et al. (2004) была показана ассоциация наличия мутации Лейден с ишемическим инсультом.
С другой стороны, мутация Лейден может быть выгодной с эволюционной точки зрения. Это объясняется тем, что у женщин – носительниц этой мутации имеется такое преимущество, как сниженный риск кровотечений при родах. Таким образом, высокая распространенность потенциально вредной мутации среди населения в целом может быть результатом эволюционного отбора.
Своевременная диагностика генетической предрасположенности к повышенной свертываемости крови и ранние профилактические и/или лечебные мероприятия помогут избежать серьезных последствий для сердечно-сосудистой системы и ассоциированных тяжелых заболеваний. Кроме того, профилактика тромбоэмболических осложнений важна для безопасного течения беременности при наличии наследственной тромбофилии.
Интерпретация результатов исследования должна проводиться врачом в комплексе с другими генетическими, анамнестическими, клиническими и лабораторными данными.
Исследование рекомендуется проводить в комплексах:
Мутация протромбина что это такое
Комплексный генетический анализ, который позволяет определить риск тромбофилии. Он представляет собой молекулярно-генетическое исследование генов факторов свертываемости крови, тромбоцитарных рецепторов, фибринолиза, обмена фолиевой кислоты, изменение активности которых напрямую или опосредованно обуславливает склонность к повышенному тромбообразованию.
Какой биоматериал можно использовать для исследования?
Буккальный (щечный) эпителий, венозную кровь.
Как правильно подготовиться к исследованию?
Подготовки не требуется.
Подробнее об исследовании
В результате различных патологических процессов в сосудах могут образоваться тромбы, которые блокируют кровоток. Это самое частое и неблагоприятное проявление наследственной тромбофилии – повышенной склонности к тромбообразованию, связанной с определенными генетическими дефектами. Она может приводить к развитию артериальных и венозных тромбозов, которые в свою очередь зачастую являются причиной инфаркта миокарда, ишемической болезни сердца, инсульта, тромбоэмболии легочной артерии и др.
В систему гемостаза входят факторы свертывающей и противосвертывающей систем крови. В нормальном состоянии они находятся в равновесии и обеспечивают физиологические свойства крови, не допуская повышенного тромбообразования или, наоборот, кровоточивости. Но при воздействии внешних или внутренних факторов это равновесие может нарушаться.
В развитии наследственной тромбофилии, как правило, принимают участие гены факторов свертывания крови и фибринолиза, а также гены ферментов, контролирующих обмен фолиевой кислоты. Нарушения в этом обмене могут привести к тромботическим и атеросклеротическим поражениям сосудов (через повышение уровня гомоцистеина в крови).
Наиболее значимым нарушением, ведущим к тромбофилии, является мутация в гене фактора свертываемости 5 (F5), ее еще называют Лейденской. Она проявляется устойчивостью фактора 5 к активированному протеину С и увеличением скорости образования тромбина, в результате чего и происходит усиление процессов свертываемости крови. Также важную роль в развитии тромбофилии играет мутация в гене протромбина (F2), связанная с повышением уровня синтеза данного фактора свертываемости. При наличии этих мутаций риск тромбозов значительно возрастает, особенно за счет провоцирующих факторов: приема оральных контрацептивов, избыточного веса, гиподинамии и т. д.
У носительниц таких мутаций высока вероятность неблагоприятного течения беременности, например невынашивания беременности, задержки внутриутробного развития плода.
Предрасположенность к тромбозам может быть также обусловлена мутацией гена FGB, кодирующего бета-субъединицу фибриногена (генетический маркер FGB (-455GA). Результатом является повышение синтеза фибриногена, вследствие чего возрастает риск периферического и коронарного тромбоза, риск тромбоэмболических осложнений во время беременности, при родах и в послеродовом периоде.
Среди факторов, повышающих риск развития тромбоза, очень важны гены тромбоцитарных рецепторов. В данном исследовании проводится анализ генетического маркера гена тромбоцитарного рецептора к коллагену (ITGA2 807 C>T) и фибриногену (ITGB3 1565T>C). При дефекте гена рецептора к коллагену усиливается прилипание тромбоцитов к эндотелию сосудов и к друг к другу, что ведет к повышенному тромбообразованию. При анализе генетического маркера ITGB3 1565T>C возможно выявить эффективность или неэффективность антиагрегантной терапии аспирином. При нарушениях, обусловленных мутациями в этих генах, повышается риск тромбозов, инфаркта миокарда, ишемического инсульта.
С тромбофилией могут быть связаны не только нарушения свертывающей системы крови, но и мутации генов фибринолитической системы. Генетический маркер SERPINE1 (-675 5G>4G) – ингибитор активатора плазминогена – основного компонента антисвертывающей системы крови. Неблагоприятный вариант этого маркера приводит к ослаблению фибринолитической активности крови и, как следствие, повышает риск сосудистых осложнений, различных тромбоэмболий. Мутация гена SERPINE1 также отмечается при некоторых осложнениях беременности (невынашивание беременности, задержка развития плода).
Кроме мутаций факторов свертывающей и противосвертывающей систем, как значимую причину тромбофилии рассматривают повышенный уровень гомоцистеина. При чрезмерном накоплении он оказывает токсическое действие на эндотелий сосудов, поражает сосудистую стенку. В месте повреждения образуются тромбы, там же может осесть избыточный холестерин. Эти процессы приводят к закупориванию сосудов. Избыточное содержание гомоцистеина (гипергомоцистеинемия) увеличивает вероятность развития тромбозов в кровеносных сосудах (как в артериях, так и в венах). Одной из причин повышения уровня гомоцистеина является снижение активности ферментов, обеспечивающих его обмен (в исследование включен ген MTHFR). Помимо генетического риска развития гипергомоцистеинемии и ассоциированных с ней заболеваний, наличие изменений в данном гене позволяет определить предрасположенность и к неблагоприятному течению беременности (фетоплацентарной недостаточности, незаращению нервной трубки и другим осложнениям для плода). При изменениях в фолатном цикле в качестве профилактики назначаются фолиевая кислота и витамины В6, В12. Продолжительность терапии и дозировка препаратов может определяться на основании генотипа, уровня гомоцистеина и особенностей сопутствующих факторов риска у пациента.
Заподозрить наследственную предрасположенность к тромбофилии возможно при семейной и/или личной истории тромботических заболеваний (тромбоз глубоких вен, варикозная болезнь и др.) и также в акушерской практике – при тромбоэмболических осложнениях у женщин во время беременности, в послеродовом периоде.
Комплексное молекулярно-генетическое исследование позволяет оценить генетический риск тробофилии. Зная о генетической предрасположенности можно предотвратить своевременными профилактическими мероприятиями развитие сердечно-сосудистых нарушений..
Факторы риска развития тромбофилии:
Когда назначается исследование?
Что означают результаты?
По результатам комплексного исследования 10 значимых генетических маркеров выдается заключение врача-генетика, которое позволит оценить риск тромбофилии, спрогнозировать развитие таких заболеваний как тромбоз, тромбоэмболия, инфаркт, или вероятность осложнений, связанных с нарушением гемостаза, при беременности, выбрать направления оптимальной профилактики, а при уже имеющихся клинических проявлениях детально разобраться в их причинах.
Генетические маркеры
Фактор коагуляции II (тромбин) F2: G20210A в Москве
Генетическое исследование, направленное на выявление мутации гена F2. Мутация ассоциирована с повышенной свертываемостью крови, в результате чего возможно развитие ряда патологий со стороны сердечно-сосудистой системы и тромбоэмболических осложнений беременности.
Приём и исследование биоматериала
Когда нужно сдавать анализ Фактор коагуляции II (тромбин) F2: G20210A?
Подробное описание исследования
Исследование генетической мутации в гене протромбина (F2) используется в диагностике наследственной тромбофилии, которая проявляется тромбозами глубоких вен и легочной артерии, а также рядом акушерских осложнений. Исследование также используется в диагностике заболеваний сердечно-сосудистой системы.
Ген F2 кодирует фактор свертывания крови II (протромбин). Мутация G20210A связана с заменой гуанина на аденин в положении 20210. В результате мутации изменяется синтез протромбина. Люди с А-аллелем имеют увеличенный синтез протромбина, в результате чего риск формирования тромбов повышается.
При повреждении сосудистой стенки в организме человека запускается процесс свертывания крови, называемый гемостазом. Гемостаз включает в себя серию последовательных химических реакций (каскад коагуляции). В этом каскаде участвуют факторы свертывания крови, которые активируются один за другим и приводят к формированию кровяного сгустка, который препятствует излишней кровопотере.
Для обеспечения нормального процесса свертывания в крови должно быть достаточное количество всех факторов, каждый из которых должен быть функционально активным.
Недостаточная активность может привести к обильной кровопотере, излишняя активность — к чрезмерному свертыванию.
Протромбин, или фактор II свертывающей системы крови, выступает предшественником тромбина — важнейшего компонента образования кровяного сгустка. Он постоянно находится в плазме крови и активируется в момент повреждения ткани или органа. Как часть свертывающей системы крови он участвует в формировании тромба, который препятствует излишней кровопотере при травме.
Наследственная тромбофилия — распространенная наследственно обусловленная предрасположенность к гиперкоагуляции. Тромбофилия проявляется образованием глубоких венозных тромбозов, тромбоэмболией легочной артерии.
Тромбоз глубоких вен, как правило, поражает бедренную вену и проявляется болью в месте образования тромба (также может наблюдаться судорога или онемение), покраснением кожи на этом участке, а также отеком. Боль усиливается во время ходьбы или физических нагрузок.
Тромбоз легочных артерий приводит к тромбоэмболии легочной артерии, симптомами которой являются одышка, боли в грудной клетке, кашель (иногда с примесью крови), частый слабый пульс, бледность кожи.
Наследственная тромбофилия наследуется по аутосомно-доминантному типу, т.е. для проявления патологии человеку достаточно унаследовать «дефектный» ген от одного из родителей. При наследовании мутации от обоих родителей клинические проявления будут более выраженными. Риск наследования мутации, ведущей к тромбофилии, составляет 50%.
Предрасположенность к тромбофилии может никак не проявляться у человека в обычной жизни, но во время беременности, особенно в третьем триместре, изменение свертываемости крови опасно развитием серьезных осложнений.
При беременности формируется дополнительный маточно-плацентарный круг кровообращения, благодаря которому кровь матери вместе с питательными веществами поступает к плоду. Повышение активности свертывающей системы крови (гиперкоагуляция) в третьем триместре беременности — физиологический процесс, направленный на подготовку к родам и предупреждение массивного кровотечения. При наличии предрасположенности к гиперкоагуляции, риск осложнений беременности возрастает в 10 раз.
Ряд негенетических факторов увеличивают риск формирования осложнений, связанных с гиперкоагуляцией, к ним относят:
Данное генетическое исследование рекомендовано отдельным группам пациентов:
Генодиагностика на наличие мутаций гена F2 у пациентов из групп риска позволяет вовремя начать профилактику тромбозов и избежать развития патологий со стороны сердечно-сосудистой системы (ишемический инсульт, инфаркт миокарда), а также осложнений беременности.