можно ли лечить обструктивный бронхит дома
Хронический и острый бронхит: чем опасна болезнь и как её лечить
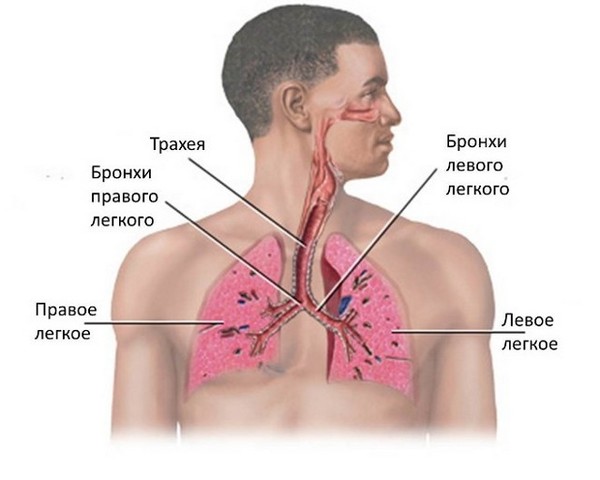
Бронхит – это патологическое состояние, при котором развивается воспаление бронхов. В свою очередь, бронхи – это пути, которые проводят воздух от трахеи к тканям легких, согревают воздушный поток, увлажняют и очищают его. Находятся они в нижней части трахеи и представляют собой две крупных ветви.
Болезнь вызывает воспаление слизистой оболочки или всей толщи бронхиальных стенок. Начинается чрезмерное выделение слизи, затрудняется дыхание. Организм пытается самостоятельно вывести лишнюю слизь, поэтому появляется сильный мучительный кашель. Патология может переходить из кратковременной острой в продолжительную хроническую форму, поэтому требует комплексного незамедлительного лечения.
Острый бронхит
Развивается в подавляющем большинстве случаев и представляет собой распространенное осложнение острой респираторной инфекции. Зачастую диагностируется у детей, так как они более восприимчивы к подобным инфекциям.
При остром поражении бронхов происходит размножение условно-патогенной микрофлоры. Слизистая меняет свою структуру, развивается поражение верхних слоев и стенок бронхов. Формируется отек слизистой, эпителиальные клетки отторгаются организмом, появляются инфильтраты на подслизистом слое. Процессы сопровождаются тяжелым продолжительным кашлем, который может сохраняться даже после излечения пациента.
Острая форма лечится в течение 3-4 недель. На протяжении этого времени восстанавливается структура и функции бронхов. При правильной и своевременной терапии прогноз благоприятный.
Хронический бронхит
При хроническом бронхите кашель с выделением мокроты наблюдается на протяжении не менее двух лет в течение трех месяцев ежегодно. При этом важно исключить наличие других причин кашля.
Такая форма чаще возникает у взрослых, так как формируется только при длительном раздражении бронхов. Причиной раздражения может быть не только многократно перенесенное острое заболевание, но и сигаретный дым, газы, пыль, химические испарения и прочие отрицательные факторы.
Продолжительное воздействие на слизистую бронхов неблагоприятных факторов вызывает изменения в слизистой, постепенное повышение выделения мокроты. Существенно снижается способность бронхов проводить воздух, а вентиляция легких нарушается.
Формы хронического бронхита
В зависимости от характера воспалительных процессов выделяют:
С учетом наличия нарушения проходимости (обструкции) дыхательных путей бронхит может быть:
По причинам развития болезни выделяют:
Причины заболевания
При острой и хронической формах причины развития патологического состояния бронхов несколько отличаются.
Острый бронхит в 90% случаев формируется в результате попадания в организм вирусной инфекции: гриппа, аденовируса, респираторно-синцитиального, коревого или коклюшного вируса, а также прочих возбудителей. Реже болезнь становится результатом бактериального поражения стафилококком, стрептококком, пневмококком и др.
Среди прочих факторов, которые способствуют развитию острой формы болезни:
При хронической форме основной причиной развития признано курение. У курильщиков болезнь диагностируют в 2-5 раз чаще, чем у некурящих людей. Табачный дым наносит вред как при активном, так и при пассивном курении.
Среди прочих предпосылок развития хронической формы – повторно перенесенные и частые острые бронхиты, ОРВИ, пневмонии, болезни носоглотки. Инфекционная составляющая в таких условиях усугубляет уже имеющееся поражение бронхов.
Симптомы бронхита
Признаки патологии отличаются в зависимости от острой или хронической формы течения болезни:
Осложнения
Острый бронхит может провоцировать осложнение в виде бронхопневмонии – инфекционно-воспалительного процесса, который поражает легкие, вызывает лихорадку, сухой кашель, общую слабость.
Бесконтрольное прогрессирование хронического заболевания приводит к регулярным острым пневмониям и со временем переходит в обструктивную болезнь легких. При этом сужается просвет и отекает слизистая дыхательных путей, частично разрушаются легочные ткани.
Хронический бронхит также может стать причиной развития легочной гипертензии, сердечно-легочной недостаточности, эмфиземы легких, бронхоэктатичской болезни, пневмонии и ряда других опасных заболеваний.
Когда стоит обратиться к врачу
Крайне важно не пускать болезнь на самотек. К врачу нужно обращаться при появлении первых симптомов возможного бронхиального поражения: кашля, повышенной температуры, недомогания. Врач проведет диагностику, укажет, как и чем лечить бронхит и кашель, а дальнейшая терапия пройдет в домашних условиях под контролем доктора. В большинстве случаев патология не требует госпитализации.
Бесконтрольное течение острой болезни в большинстве случаев приводит к усугублению симптоматики, повторному развитию заболевания, переходу в хроническую болезнь и формированию осложнений.
Чтобы определить болезнь и изучить степень поражения бронхов, необходима комплексная диагностика пациента и изучение клинической картины. Этим занимается терапевт или педиатр, который назначает необходимые для диагностики обследования. При необходимости он направляет пациента на консультации к пульмонологу и другим смежным специалистам.
Если по результатам опроса и осмотра у врача появились подозрения на бронхит или другие схожие болезни, назначаются дополнительные обследования:
Среди возможных дополнительных исследований: эхокардиография, электрокардиография, бронхография и др.
Лечение
Терапия бронхита носит комплексный характер, так как преследует цель избавить организм от инфекции, восстановить проходимость бронхов, устранить усугубляющие болезнь факторы.
В первые дни острой фазы необходимо придерживаться постельного режима, много пить, соблюдать молочно-растительную диету. Крайне важно отказаться от курения и поддерживать влажность воздуха в помещении, где находится больной, на уровне 40-60%.
Медикаментозная терапия острой стадии cводится к приему препаратов, которые облегчают симптомы и предотвращают развитие осложнений. Для этого используют:
Важную роль играет физиотерапия. Улучшить состояние пациента помогает лечебная гимнастика, физиотерапия, вибрационный массаж.
Хроническая форма заболевания требует продолжительного лечения как при обострении, так и во время ремиссии. Схема терапии предусматривает прием перечисленных препаратов по назначению врача, а также интенсивную программу легочной реабилитации, которая помогает снизить проявления болезни.
Максимально важно устранить из жизни пациента причину, которая спровоцировала развитие хронического бронхита, вести здоровый образ жизни, укреплять иммунитет и правильно питаться.
Профилактика бронхита
Профилактика легочных заболеваний – это комплексный и систематический процесс, цель которого – укрепить защитные силы организма и минимизировать воздействие факторов риска. Для этого необходимо в первую очередь отказаться от курения, защищать легкие от пыли, вредных химических соединений, слишком горячего или сухого воздуха. В рамках профилактики важно своевременно лечить хронические инфекции, предотвращать аллергические реакции и обязательно обращаться к врачу при первых признаках заболевания, проходить ежегодную вакцинацию от гриппа и пневмонии.
Cовременная терапия хронической обструктивной болезни легких
Хроническая обструктивная болезнь легких (ХОБЛ) — заболевание, характеризующееся прогрессирующей, частично обратимой бронхиальной обструкцией, которая связана с воспалением дыхательных путей, возникающим под влиянием неблагоприятных факторов внешней сред
Хроническая обструктивная болезнь легких (ХОБЛ) — заболевание, характеризующееся прогрессирующей, частично обратимой бронхиальной обструкцией, которая связана с воспалением дыхательных путей, возникающим под влиянием неблагоприятных факторов внешней среды (курения, профессиональных вредностей, поллютантов и др.). Установлено, что морфологические изменения при ХОБЛ наблюдаются в центральных и периферических бронхах, легочной паренхиме и сосудах [8, 9]. Это объясняет использование термина «хроническая обструктивная болезнь легких» вместо привычного «хронического обструктивного бронхита», подразумевающего преимущественное поражение у больного бронхов.
В опубликованных недавно рекомендациях ведущих экспертов Американского и Европейского торакальных обществ подчеркивается, что развитие ХОБЛ у больных можно предупредить, а при ее лечении вполне реально добиться успехов [7].
Заболеваемость и смертность пациентов от ХОБЛ продолжают расти во всем мире, что в первую очередь обусловлено широкой распространенностью курения. Показано, что этим заболеванием страдают 4–6 % мужчин и 1–3 % женщин старше 40 лет [8, 10]. В европейских странах оно ежегодно является причиной смерти 200–300 тыс. человек [10]. Высокое медико-социальное значение ХОБЛ стало причиной издания по инициативе ВОЗ международного согласительного документа, посвященного ее диагностике, лечению, профилактике и основанного на принципах доказательной медицины [8]. Аналогичные рекомендации выпущены Американским и Европейским респираторными обществами [7]. В нашей стране недавно опубликовано 2-е издание Федеральной программы по ХОБЛ [1].
Задачами терапии ХОБЛ являются предупреждение прогрессирования болезни, уменьшение выраженности клинических симптомов, достижение лучшей переносимости физической нагрузки и повышение качества жизни больных, предупреждение осложнений и обострений, а также снижение смертности [8, 9].
Основными направлениями лечения ХОБЛ являются уменьшение воздействия неблагоприятных факторов внешней среды (в том числе отказ от курения), обучение больных, использование лекарственных средств и немедикаментозная терапия (оксигенотерапия, реабилитация и др.). Различные комбинации этих методов используются у пациентов с ХОБЛ в фазу ремиссии и обострения.
Уменьшение влияния на больных факторов риска является неотъемлемой частью лечения ХОБЛ, позволяющей предупредить развитие и прогрессирование этого заболевания. Установлено, что отказ от курения позволяет замедлить нарастание бронхиальной обструкции. Поэтому лечение табачной зависимости актуально для всех пациентов, страдающих ХОБЛ. Наиболее эффективны в этом случае беседы медицинского персонала (индивидуальные и групповые) и фармакотерапия. Существуют три программы лечения табачной зависимости: короткая (1–3 мес), длительная (6–12 мес) и программа снижения интенсивности курения [2].
Назначать лекарственные препараты рекомендуется в отношении больных, с которыми беседы врача оказались недостаточно эффективны. Следует взвешенно подходить к их применению у людей, выкуривающих менее 10 сигарет в день, подростков и беременных. Противопоказанием к назначению никотинзамещающей терапии являются нестабильная стенокардия, нелеченая пептическая язва двенадцатиперстной кишки, недавно перенесенные острый инфаркт миокарда и нарушение мозгового кровообращения.
Повышение информированности пациентов позволяет повысить их работоспособность, улучшить состояние здоровья, формирует умение справляться с болезнью, повышает эффективность лечения обострений [8]. Формы обучения больных различны — от распространения печатных материалов до проведения семинаров и конференций. Наиболее эффективно интерактивное обучение, которое проводится в рамках небольшого семинара.
Принципы лечения ХОБЛ стабильного течения [6, 8] следующие.
Хирургическое лечение
Роль хирургического лечения у больных ХОБЛ в настоящее время является предметом исследований. Сейчас обсуждаются возможности использования буллэктомии, операции по уменьшению легочного объема и трансплантации легких.
Показанием для буллэктомии при ХОБЛ является наличие у пациентов буллезной эмфиземы легких с буллами большого размера, вызывающими развитие одышки, кровохарканья, легочных инфекций и боли в грудной клетке. Эта операция приводит к уменьшению одышки и улучшению функции легких.
Значение операции по уменьшению легочного объема при лечении ХОБЛ изучено пока недостаточно. Результаты завершившегося недавно исследования (National Emphysema Therapy Trial) свидетельствуют о положительном влиянии этого хирургического вмешательства по сравнению с медикаментозной терапией на способность выполнять физическую нагрузку, качество жизни и летальность больных ХОБЛ, имеющих преимущественно тяжелую верхнедолевую эмфизему легких и исходно низкий уровень работоспособности [12]. Тем не менее эта операция остается пока экспериментальной паллиативной процедурой, не рекомендуемой для широкого применения [9].
Трансплантация легких улучшает качество жизни, функцию легких и физическую работоспособность больных. Показаниями для ее выполнения являются ОФВ1 ё25% от должного, РаСО2>55 мм рт. ст. и прогрессирующая легочная гипертензия. К числу факторов, лимитирующих выполнение этой операции, относятся проблема подбора донорского легкого, послеоперационные осложнения и высокая стоимость (110–200 тыс. долларов США). Операционная летальность в зарубежных клиниках составляет 10–15%, 1-3-летняя выживаемость, соответственно, 70–75 и 60%.
Ступенчатая терапия ХОБЛ стабильного течения представлена на рисунке.
Лечение легочного сердца
Легочная гипертензия и хроническое легочное сердце являются осложнениями ХОБЛ тяжелого и крайне тяжелого течения. Их лечение предусматривает оптимальную терапию ХОБЛ, длительную (>15 ч) оксигенотерапию, использование диуретиков (при наличии отеков), дигоксина (только при мерцательной терапии и сопутствующей левожелудочковой сердечной недостаточности, так как сердечные гликозиды не оказывают влияния на сократимость и фракцию выброса правого желудочка). Спорным представляяется назначение вазодилятаторов (нитратов, антагонистов кальция и ингибиторов ангиотензинпревращающего фермента). Их прием в ряде случаев приводит к ухудшению оксигенации крови и артериальной гипотензии. Тем не менее антагонисты кальция (нифедипин SR 30–240 мг/сут и дилтиазем SR 120–720 мг/cут), вероятно, могут применяться у больных с тяжелой легочной гипертензией при недостаточной эффективности бронхолитиков и оксигенотерапии [16].
Лечение обострений ХОБЛ
Обострение ХОБЛ характеризуется нарастанием у больного одышки, кашля, изменением объема и характера мокроты и требует изменений лечебной тактики. [7]. Различают легкие, средней тяжести и тяжелые обострения болезни (см. табл. 3).
Лечение обострений предусматривает использование лекарственных препаратов (бронхолитиков, системных глюкокортикоидов, по показаниям–антибиотиков), оксигенотерапии, респираторной поддержки.
В связи с трудностью дозирования и большим числом потенциальных побочных эффектов применение теофиллинов короткого действия при лечении обострений ХОБЛ является предметом дискуссии. Некоторые авторы допускают возможность их использования в качестве препаратов «второго ряда» при недостаточной эффективности ингаляционных бронхолитиков [6, 9], другие не разделяют эту точку зрения [7]. Вероятно, назначение препаратов этой группы возможно при соблюдении правил введения и определении концентрации теофиллина в сыворотке крови. Наиболее известный из них препарат эуфиллин, представляющий собой теофиллин (80%), растворенный в этилендиамине (20%). Схема его дозирования приведена в таблице 5. Следует подчеркнуть, что препарат должен вводиться только внутривенно капельно. Это уменьшает вероятность развития побочных эффектов. Его нельзя назначать внутримышечно и ингаляционно. Введение эуфиллина противопоказано у больных, получающих теофиллины длительного действия, из-за опасности его передозировки.
Инвазивная ИВЛ предусматривает интубацию дыхательных путей или наложение трахеостомы. Соответственно связь больного и респиратора осуществляется через интубационные или трахеостомические трубки. Это создает риск развития механических повреждений и инфекционных осложнений. Поэтому инвазивная ИВЛ должна использоваться при тяжелом состоянии больного и только при неэффективности других методов лечения.
Показания для инвазивной ИВЛ [8, 9]:
Больные с легкими обострениями могут лечиться амбулаторно.
Амбулаторное лечение легких обострений ХОБЛ [7–9] включает следующие этапы.
Пациенты с обострениями средней тяжести, как правило, должны госпитализироваться. Их лечение осуществляется по следующей схеме [7–9].
А. В. Емельянов, доктор медицинских наук, профессор
СПБ ГМУ, Санкт-Петербург
Обструктивный бронхит: что делать, если кашель не проходит?
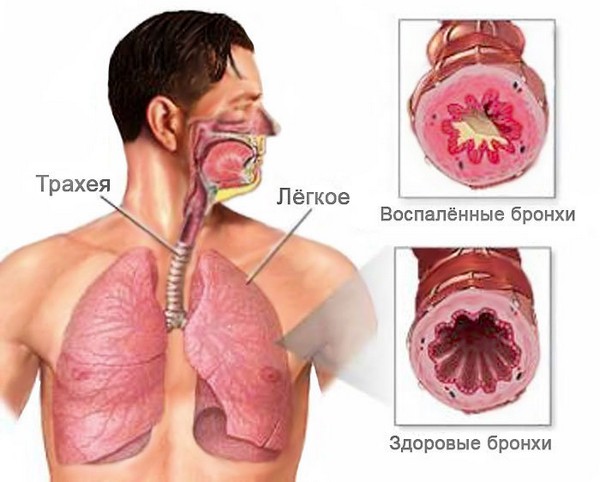
Бронхитом называется воспаление бронхов, которое может протекать остро или хронически. Если при этом отмечается сужение просвета бронхов, ухудшение их проходимости, то говорят об обструктивном бронхите.
Этот тип болезни требует особых подходов к терапии, так как относится к прогрессирующим и хроническим заболеваниям,
что требует тщательного наблюдения врача и лечения под контролем медицинского специалиста.
Чаще всего болезнь имеет затяжное течение и беспокоит человека на протяжении многих лет. Развитие обструкции, то есть сужения просвета бронхов, нарушения их свободной проходимости – главное отличие обструктивного бронхита от других форм заболевания. Синдром бронхообструкции встречается как у детей, так и у взрослых.
Причины возникновения
Патологический процесс чаще всего развивается вследствие действия нескольких факторов. К ним относятся:
Эти факторы ведут к нарушению мукоцилиарного клиренса – естественного механизма, функцией которого является очищение дыхательных путей и бронхов от патогенных микроорганизмов, продуктов их жизнедеятельности. Обострение хронического обструктивного бронхита может вызвать вирусная и реже бактериальная инфекция.
Как проявляется болезнь?
Симптомы обструктивного бронхита проявляются во время его обострения. К главным жалобам относятся:
При бактериальном воспалении чаще отмечается повышение температуры тела, мокрота приобретает гнойный характер, усиливаются симптомы интоксикации. Приступы кашля отмечаются преимущественно в ночное время, во время физической нагрузки или вследствие раздражающих веществ. Существует также острый обструктивный бронхит, который протекает более бурно, но может заканчиваться полным выздоровлением. Особенно часто эта форма встречается у детей младшего возраста, однако при правильном лечении она не оставляет после себя негативных последствий. В любом случае, чтобы предотвратить развитие осложнений, терапия обструктивного бронхита должна проводиться под контролем медицинского специалиста.
Диагностика
Начало диагностики состоит из тщательного сбора жалоб и истории заболевания. Информативным методом является выслушивание дыхания в легких при помощи фонендоскопа. Для обструкции характерно наличие рассеянных сухих или влажных хрипов. Кроме осмотра по необходимости врач может назначить дополнительные исследования:
После постановки диагноза врач должен рассказать о профилактике обострений обструктивного бронхита, назначить курс лечения.
Лечение
Терапия обструктивного бронхита должна быть комплексной. Чтобы уменьшить синдром обструкции используют бронходилятаторы – препараты, снимающие спазм и расширяющие просвет бронхов. Это облегчает дыхание и устраняет приступы одышки. Также назначаются препараты, разжижающие мокроту и облегчающие кашель. Если подтверждена бактериальная причина бронхита, необходим курс антибиотиков, который не даст инфекции перерасти в воспаление легких. Антигистаминные (противоаллергические) препараты используются, если обструкция вызвана аллергическим компонентом.
Профилактика
Для профилактики обострений хронического бронхита человек в первую очередь должен отказаться от курения, работы в условиях повышенного загрязнения воздуха. Также очень важен адекватный ответ местного иммунитета на вирусы и бактерии. Если такого ответа нет, требуется активация местного иммунитета, так как защитные факторы организма способны устранить большинство возбудителей, которые приводят к бронхиту.
Не так страшен бронхит?
По форме течения бронхиты делятся на острые и хронические.
Хронический бронхит – это хроническое воспаление ткани бронхов. Хроническим бронхит считается, если кашель продолжается не менее трех месяцев в году в течение двух лет подряд.
По этиологии (причинам возникновения) выделяются вирусные, бактериальные и аллергические бронхиты.
Более 80% бронхитов – вирусные, заражение происходит воздушно-капельным путем, и протекают как обычное ОРВИ с той разницей, что вирусы, вызывающие бронхит, предпочитают «селиться» в ткани бронхов.
Симптомы бронхита
Диагностика бронхита
Для диагностики бронхита не нужны ни рентгенологическое обследование, ни дополнительные анализы. Чтобы поставить диагноз, врачу достаточно просто провести аускультацию — послушать легкие с помощью фонендокопа — опытный педиатр сразу «услышит бронхит».
Дополнительные обследования назначают для того, чтобы определить тип бронхита – вирусный или бактериальный – от этого зависит назначение терапии. Как известно, на вирусы антибиотики на действуют, поэтому их назначают, только если врач считает, что бронхит имеет бактериальную природу. Об этом может сообщить анализ крови. Также тип бронхита педиатр определяет, собирая анамнез (историю болезни): как давно ребенок болеет, как протекает заболевание, давно ли болел прошлый раз, чем лечили и т. д.
Рентген при бронхите могут назначить для того, чтобы исключить пневмонию – возможное осложнение при этом заболевании. К сожалению, у маленьких детей сложно диагностировать пневмонию без рентгена – локальные изменения в некоторых сегментах легких не всегда можно услышать.
Как лечить бронхит
Нужны ли антибиотики при бронхите?
Можно ли применять противокашлевые препараты?
На что надо обратить особое внимание
В этих случаях обязательно покажите ребенка педиатру!
ОТДЕЛЬНО
Надо ли обращаться к врачу при обычном ОРЗ?
Маленькие дети могут болеть ОРЗ/ОРВИ 8-12 раз в год – и это нормально, так как у них формируется иммунитет, их организм только знакомится и учится противостоять множеству вирусов и бактерий. И родители, уже привыкшие к бесконечным простудам, зачастую лечат ребенка самостоятельно – потому что не видят смысла посещать врача каждый раз, когда ребенок заболел.
Но проблема в том, что только врач может определить – у вашего ребенка действительно банальное ОРЗ, не требующее медикаментозного лечения и вмешательства в его течение, или более серьезное состояние. У детей все процессы идут быстро, далеко не все заболевания имеют острое начало, и без контроля опытного врача можно очень легко пропустить осложнение или более серьезное заболевание: тот же бронхит, трахеит, пневмонию и пр. К тому же дети обычно даже при серьезном заболевании играют, прыгают и бегают, что может ввести родителей в заблуждении относительно действительной серьезности заболевания.
Поэтому если ребенок заболел – обязательно покажите его педиатру – ведь только врач может объективно оценить состояние вашего малыша!
Ингаляции: польза и вред
Сейчас среди родителей чрезвычайно популярны небулайзеры – устройства для проведения ингаляции. Врачи единогласно соглашаются, что ингаляции – дело хорошее. Используя этот аппарат, мы можем доставить лекарство напрямую в бронхи, что уменьшает нагрузку на желудочно-кишечный тракт и кровеносную систему и обеспечивает быстрое действие препарата. Но! Небулайзер можно применять только, когда к этому есть показания и при использовании определенных препаратов, назначенных врачом.
Небулайзеры разработаны для доставки лекарства в средние отделы дыхательной системы, то есть эффективны при бронхите и астме. Использовать их при заболевании верхних дыхательных путей (обычное ОРЗ или ОРВИ) стоит с осторожностью. Почему? Во-первых, потому что препараты, применяемые для лечения нижних отделов дыхательных путей не эффективны при воспалительном процессе в полости носа и глотке, во-вторых, для использования небулайзера при заболеваниях верхних дыхательных путей есть ряд условий и правил, о которых сообщить вам сможет только врач.
Терапия острого обструктивного синдрома у детей с острыми респираторными заболеваниями
Современная терапия острого обструктивного синдрома дыхательных путей (ООСДП) у детей включает, наряду с бронхолитическими препаратами, противовоспалительную терапию. В качестве противовоспалительных препаратов выбора при ООСДП у детей являются глюкокорти
Today therapy of acute obstructive syndrome of respiratory tract (AOSRT) of children includes antiphlogistic therapy together with bronchial spasmolytic drugs. Glukocorticosteroids are preparations of choice in treatement of AOSRT of children. Effectiveness of treatment defines both correct choice of preparations and optimal means of their release in respiratory tract. In resent years high-active pathogenetically justified effective and safe preparations have been introduced into clinical practice. They allow promptly reserve acute obstruction of upper and lower air passages and substantially control clinical course of disease and support relatively high quality of life.
Несмотря на современные достижения медицины, в ХХI веке распространенность инфекций не только не снижается, а все больше возрастает. Длительное время первое место в структуре инфекционной заболеваемости у детей занимают острые респираторные заболевания (ОРЗ) [1, 2]. Согласно данным государственного отчета Роспотребнадзора, в России заболеваемость ОРЗ у детей за 2012 год составила более 28 млн (28 423 135), или 19 896,3 случая на 100 тыс. детей [3]. Такая высокая распространенность ОРЗ в детском возрасте обусловлена как контагиозностью инфекционного фактора, так и анатомо-физиологическими особенностями детского организма. Значительное место в этиологической структуре ОРЗ отводится вирусным инфекциям. За последние десятилетия идентифицированы новые вирусы, определяющие тяжелое течение ОРЗ с обструкцией дыхательных путей, особенно у детей первых лет жизни. Особое внимание уделяется роли метапневмовируса, короновируса, бокавируса, риновируса, реассортантам вируса гриппа, респираторно-синцитиальному вирусу в развитии обструктивного синдрома дыхательных путей. Их роль в развитии острого обструктивного синдрома дыхательных путей (ООСДП) у детей неоспорима, вместе с этим существуют данные, свидетельствующие о возможной их роли в развитии бронхиальной астмы (БА) у генетически предрасположенных лиц [1, 4].
Острые обструктивные состояния дыхательных путей у детей встречаются достаточно часто и иногда протекают тяжело, сопровождаясь признаками дыхательной недостаточности. Самыми распространенными из них является острый стенозирующий ларинготрахеит (круп), обусловленный воспалением слизистой и подслизистого пространства гортани и трахеи, с вовлечением в процесс тканей и структур подсвязочного пространства и развитием стеноза гортани. Также достаточно часто причиной острых обструктивных состояний дыхательных путей на фоне острой респираторной вирусной инфекции (ОРВИ) у детей являются острый обструктивный бронхит, бронхиолит и БА [5].
Под термином «круп» понимают клинический синдром, сопровождающийся хриплым или сиплым голосом, грубым «лающим» кашлем и затрудненным (стенотическим) дыханием. В отечественной литературе это заболевание описывается под названием «стенозирующий ларинготрахеит», в Международной классификации болезней 10-го пересмотра (МКБ-10) — «острый обструктивный ларингит». Однако в практической работе наибольшее распространение получил термин «круп», который рекомендуется ведущими детскими инфекционистами использовать в качестве общей терминологии.
Бронхообструктивный синдром — это симптомокомплекс функционального или органического происхождения, клинические проявления которого складываются из удлиненного выдоха, свистящего, шумного дыхания, приступов удушья, кашля и др. Термины «бронхообструктивный синдром» и «круп» не могут быть использованы как самостоятельный диагноз.
Распространенность обструктивных состояний дыхательных путей на фоне ОРВИ достаточно высока, особенно у детей первых 6 лет жизни. Это связано с анатомо-физиологическими особенностями респираторного тракта у детей раннего возраста. Так, частота развития бронхиальной обструкции на фоне острых респираторных заболеваний у детей первых лет жизни составляет, по данным разных авторов, от 5% до 50%. Наиболее часто обструктивные состояния отмечаются у детей с отягощенным семейным анамнезом по аллергии. Такая же тенденция имеется и у детей, которые часто, более 6 раз в году, болеют респираторными инфекциями. В западной литературе в настоящее время принят термин «wheezing» — синдром «шумного дыхания», объединяющий ларинготрахеальные причины ООСДП и бронхообструктивный синдром. Отмечено, что свистящие хрипы и одышку хотя бы один раз в жизни имеют 50% детей, а рецидивирующее течение бронхообструкции характерно для 25% детей [2, 6, 7].
Проведенный нами анализ распространенности обструктивного синдрома у детей с ОРЗ, являющегося причиной госпитализации в отделение респираторных инфекций детской городской клинической больницы Святого Владимира г. Москвы, свидетельствует об увеличении в последние годы пациентов с обструктивным синдромом дыхательных путей. Согласно нашим данным, в 2011 г. в респираторное отделение поступило 1348, из них 408 детей — с достаточно тяжелым течением ООСДП на фоне ОРЗ. В последующие годы мы наблюдаем увеличение роли ООСДП, определяющего тяжесть ОРЗ, так, в 2012 г. количество госпитализаций достигло 1636, а детей с ООСДП увеличилось до 669. Следует отметить, что в 90% случаев возраст детей с ООСДП был менее 5 лет. Был проведен анализ причин недостаточной эффективности терапии обструктивных состояний у детей на догоспитальном этапе. Установлено, что основными среди них являются неадекватная оценка тяжести ООСДП и соответственно отсутствие своевременной и рациональной терапии ООСДП, позднее назначение противовоспалительной терапии, отсутствие контроля за техникой выполнения ингаляции.
Высокая частота возникновения ООСДП у детей обусловлена как особенностями инфекционного фактора в современном мире, так и анатомо-физиологическими особенности детского организма. Известно, что иммунная система детей первых лет жизни отличается незрелостью и недостаточными резервными возможностями. Так, ответ врожденной иммунной системы детей первых лет жизни отличается ограниченной секрецией интерферонов (ИФН), недостаточной активностью комплемента, снижением клеточной цитотоксичности. Особенности адаптивного иммунитета в этой возрастной группе пациентов обусловлены Th2-направленностью иммунного ответа, что нередко способствует развитию аллергических реакций, незрелостью гуморального звена иммунного ответа со снижением уровня секреторного иммуноглобулина (Ig) А на слизистых, преимущественной выработкой IgМ на инфекционные патогены. Незрелость иммунного ответа способствует частым ОРЗ и нередко определяет тяжесть их течения [1].
Часто развитие ООСДП у детей первых лет жизни обусловлено анатомо-физиологическими особенностями строения дыхательных путей этой возрастной группы пациентов. Среди них особенно важными являются наличие гиперплазии железистой ткани, секреция преимущественно вязкой мокроты, относительная узость дыхательных путей, меньший объем гладких мышц, низкая коллатеральная вентиляция, особенности строения гортани. Развитие крупа у детей с ОРВИ обусловлено малыми абсолютными размерами гортани, мягкостью хрящевого скелета, рыхлым и вытянутым надгортанником. Все это создает особые предпосылки для компонентов стеноза: спазма и отека. Кроме того, в связи с тем, что пластинки щитовидного хряща у детей сходятся под прямым углом (у взрослых он острый), голосовые связки (складки) становятся непропорционально короткими, и до 7 лет глубина гортани превышает ее ширину. Чем меньше ребенок, тем больше относительная площадь, занимаемая рыхлой соединительной тканью в подскладочном пространстве, что увеличивает объем отека слизистой гортани. У детей первых трех лет жизни гортань, трахея и бронхи имеют относительно меньший диаметр, чем у взрослых. Узость всех отделов дыхательного аппарата значительно увеличивает аэродинамическое сопротивление. Для детей раннего возраста характерны недостаточная ригидность костной структуры грудной клетки, свободно реагирующей втяжением уступчивых мест на повышение сопротивления в воздухоносных путях, а также особенности положения и строения диафрагмы. Недостаточна и дифференцировка нервного аппарата вследствие того, что слиты 1-я и 2-я рефлексогенные зоны на всем их протяжении и не оформлена 3-я рефлексогенная зона, рецепторы которой обильно разветвляются на всей слизистой подскладочного пространства, что способствует возникновению длительного спазма голосовой щели и стенозу гортани. Именно эти особенности способствуют частому развитию и рецидивам обструкции дыхательных путей у детей первых лет жизни, особенно на фоне ОРЗ [1, 5, 8].
Прогноз течения ООСДП может быть довольно серьезен и зависит от формы заболевания, ставшего причиной развития обструкции, и своевременного проведения патогенетически обусловленных схем терапии и профилактики.
Основными направлениями терапии ООСДП у детей являются собственно лечение респираторной инфекции и лечение обструкции дыхательных путей.
Согласно современным данным в механизме развития ООСДП основное место отводят воспалению. Развитие воспаления слизистой оболочки верхних и нижних дыхательных путей способствует гиперсекреции вязкой слизи, формированию отека слизистой оболочки респираторного тракта, нарушению мукоцилиарного транспорта и развитию обструкции. Соответственно, основным направлениям терапии ООСДП является противовоспалительная терапия [9–11].
Воспаление является важным фактором бронхиальной обструкции детей раннего возраста и может быть вызвано различными факторами. В результате их воздействия запускается каскад иммунологических реакций, способствующих выходу в периферический кровоток медиаторов 1-го и 2-го типов. Именно с этими медиаторами (гистамином, лейкотриенами, простагландинами) связаны основные патогенетические механизмы обструктивного синдрома — усиление проницаемости сосудов, появление отека слизистой оболочки бронхов, гиперсекреции вязкой слизи, развитие бронхоспазма.
У детей первых лет жизни именно отек и гиперплазия слизистой оболочки дыхательных путей являются основной причиной обструкции дыхательных путей на разном уровне. Развитые лимфатическая и кровеносная системы респираторного тракта ребенка обеспечивают ему многие физиологические функции. Однако в условиях патологии характерным для отека является утолщение всех слоев бронхиальной стенки (подслизистого и слизистого слоя, базальной мембраны), что ведет к нарушению проходимости дыхательных путей. При рецидивирующих бронхолегочных заболеваниях нарушается структура эпителия, отмечается его гиперплазия и плоскоклеточная метаплазия.
Другим не менее важным механизмом ООСДП у детей первых лет жизни является нарушение бронхиальной секреции, которое развивается при любом неблагоприятном воздействии на органы дыхания и в большинстве случаев сопровождается увеличением количества секрета и повышением его вязкости. Функция слизистых и серозных желез регулируется парасимпатической нервной системой, ацетилхолин стимулирует их деятельность. Такая реакция изначально носит защитный характер. Однако застой бронхиального содержимого приводит к нарушению вентиляционно-респираторной функции легких. Продуцируемый густой и вязкий секрет, помимо угнетения цилиарной активности, может вызвать бронхиальную обструкцию вследствие скопления слизи в дыхательных путях. В тяжелых случаях вентиляционные нарушения сопровождаются развитием ателектазов.
Немалая роль в развитии бронхообструктивного синдрома (БОС) отводится гиперреактивности бронхов. Гиперреактивность бронхов — это повышение чувствительности и реактивности бронхов к специфическим и неспецифическим раздражителям. Причиной гиперреактивности бронхов является нарушение равновесия между возбуждающими (холинергическая, нехолинергическая и α-адренергическая системы) и ингибирующими (β-адренергическая система) влияниями на тонус бронхов. Известно, что стимуляция β2-адренорецепторов катехоламинами, также как повышение концентрации цАМФ и простагландинов Е2, уменьшает проявления бронхоспазма. Согласно классической теории A. Szentivanyi (1968 г.) у больных с гиперреактивностью бронхов имеется дефект в биохимической структуре β2-рецепторов, сводящийся к недостаточности аденилатциклазы. У этих пациентов снижено число β-рецепторов на лимфоцитах, имеется дисбаланс адренорецепторов в сторону гиперчувствительности α-адренорецепторов, что предрасполагает к спазму гладких мышц, отеку слизистой оболочки, инфильтрации и гиперсекреции. Наследственно обусловленная блокада аденилатциклазы снижает чувствительность β2-адренорецепторов к адреномиметикам, что достаточно часто встречается у больных БА. В то же время некоторые исследователи указывают на функциональную незрелость β2-адренорецепторов у детей первых месяцев жизни.
Установлено, что у детей раннего возраста достаточно хорошо развиты М-холинорецепторы, что, с одной стороны, определяет особенности течения бронхообструктивных заболеваний у этой группы пациентов (склонность к развитию обструкции, продукция очень вязкого бронхиального секрета), с другой стороны, объясняет выраженный бронхолитический эффект М-холинолитиков у них.
Таким образом, анатомо-физиологические особенности детей раннего возраста определяет как высокую распространенность ООСДП у детей первых лет жизни, так и механизмы его развития с соответствующей клинической картиной «влажной астмы».
Терапия ООСДП должна быть начата непосредственно после выявления симптомов у постели больного. Необходимо безотлагательно начинать неотложную терапию и одновременно выяснять причины бронхообструкции.
Основные направления неотложной терапии ООСДП включают в себя мероприятия по бронхолитической, противовоспалительной терапии, улучшению дренажной функции бронхов и восстановлению адекватного мукоцилиарного клиренса. Тяжелое течение приступа бронхообструкции требует проведения оксигенации вдыхаемого воздуха, а иногда искусственной вентиляции легких.
Проведение неотложной терапии ООСДП у детей должно проводиться с учетом патогенеза формирования обструкции в различные возрастные периоды. В генезе БОС у детей раннего возраста преобладают воспалительный отек и гиперсекреция вязкой слизи, а бронхоспазм выражен незначительно. С возрастом увеличивается гиперреактивность бронхов и вместе с этим возрастает роль бронхоспазма.
Основными направлениями терапии острых обструктивных состояний верхних и нижних дыхательных путей у детей с ОРЗ являются лечение самой респираторной инфекции и лечение обструкции дыхательных путей [12]. Безусловно, лечение ОРЗ должно быть комплексным и индивидуальным в каждом конкретном случае.
Этиотропная терапия наиболее частых вирусных инфекций в настоящее время является затруднительной в силу узости спектра действия противовирусных препаратов, возрастного ограничения их применения у детей в первые годы жизни, недостаточности доказательной базы эффективности данной группы препаратов. В настоящее время активно используются в терапии ОРЗ вирусной этиологии препараты рекомбинантного интерферона и препараты, стимулирующие синтез эндогенного интерферона. Назначение антибактериальных препаратов показано в случае длительной лихорадки (более 3–4 суток), и/или наличии признаков дыхательной недостаточности при отсутствии БОС, и/или при подозрении на пневмонию, и/или выраженных изменений в клиническом анализе крови.
Современные стандарты терапии обструктивных состояний респираторного тракта определены в международных и национальных программных документах [5, 9, 13], согласно которым основными препаратами в терапии ООСДП являются бронхолитические препараты и препараты с противовоспалительным действием. В качестве эффективной противовоспалительной терапии рекомендуют широкое использование ингаляционных глюкокортикостероидов (ИГКС). ИГКС являются наиболее эффективным средством лечения острого стенозирующего ларинготрахеита, бронхиальной астмы и острого обструктивного бронхита. Механизм их лечебного действия связан с мощным противовоспалительным эффектом. Противовоспалительный эффект ИГКС связан с ингибирующим действием на клетки воспаления и их медиаторы, включая продукцию цитокинов (интерлейкинов), провоспалительных медиаторов и их взаимодействия с клетками-мишенями. ИГКС оказывают влияние на все фазы воспаления, независимо от его природы, при этом ключевой клеточной мишенью могут являться эпителиальные клетки дыхательных путей. ИГКС прямо или косвенно регулируют транскрипцию генов клеток-мишеней. Они увеличивают синтез противовоспалительных белков (липокортина-1) или снижают синтез провоспалительных цитокинов — интерлейкинов, фактора некроза опухолей и др. При длительной терапии ИГКС у больных с бронхиальной астмой значительно снижается количество тучных клеток и эозинофилов на слизистых дыхательных путей, происходит стабилизация клеточных мембран, мембран лизосом и уменьшается проницаемость сосудов.
Помимо уменьшения воспалительного отека слизистой оболочки и гиперреактивности бронхов ИГКС улучшают функцию β2-адренорецепторов как путем синтеза новых рецепторов, так и повышая их чувствительность. Поэтому ИГКС потенцируют эффекты β2-агонистов.
Ингаляционное применение ГКС создает высокие концентрации препаратов в дыхательных путях, что обеспечивает максимально выраженный местный противовоспалительный эффект и минимальные проявления системных (нежелательных) эффектов.
Однако эффективность и безопасность ИГКС в терапии ООСДП у детей во многом определяется способом доставки их непосредственно в дыхательные пути и техникой выполнения ингаляции [14, 16]. В качестве средств доставки в настоящее время имеются дозирующие аэрозольные ингаляторы (ДАИ), ДАИ со спейсером и лицевой маской (аэрочэмбер, бебихалер), ДАИ, активируемые вдохом пациента, порошковые ингаляторы и небулайзеры. В настоящее время признано, что оптимальной системой доставки лекарственных препаратов в дыхательные пути при ООСДП у детей раннего возраста является небулайзер. Его использование способствует наилучшей положительной динамике клинических данных, достаточному бронхорасширяющему эффекту периферических отделов бронхов, и техника его использования практически безошибочна. Основной целью небулайзерной терапии является доставка терапевтической дозы требуемого препарата в аэрозольной форме за короткий период времени, обычно за 5–10 мин. К ее преимуществам относятся: легко выполнимая техника ингаляции, возможность доставки более высокой дозы ингалируемого вещества и обеспечение проникновения его в плохо вентилируемые участки бронхов. У детей раннего возраста необходимо использовать маску соответствующего размера, с 3–4 лет лучше использовать мундштук, чем маску, т. к. применение маски снижает дозу ингалируемого вещества за счет его оседания в носоглотке.
В настоящее время в практической деятельности врача могут быть использованы следующие ИГКС: беклометазон, будесонид, флутиказона пропионат, мометазона фуроат и циклесонид. Необходимо отметить возрастные аспекты назначения ИГКС у детей. Так, у детей с 6-месячного возраста разрешен к применению в ингаляциях через компрессорный небулайзер препарат суспензия будесонида, с 12 месяцев — флутиказона пропионат через спейсер, беклометазона пропионат разрешен для использования в детской практике с 4 лет, циклесонид с 6 лет, а мометазона фуроат с 12-летнего возраста.
Для проведения небулайзерной терапии используются только специально предназначенные для этих целей растворы лекарственных средств, разрешенные Фармакологическим комитетом РФ для небулайзеров. При этом даже маленькая частица раствора в аэрозоле сохраняет все лекарственные свойства вещества, сами растворы для небулайзерной терапии не вызывают повреждения слизистой бронха и альвеол, а упаковка в виде флаконов или небул позволяет удобно дозировать препараты как в стационарных, так и в домашних условиях.
Совсем недавно в нашей стране была зарегистрирована целая линейка препаратов, предназначенных для небулайзерной терапии, включающая ИГКС — будесонид (Буденит Стери-Неб) и 3 бронхолитика: сальбутамол (Саламол Стери-Неб), ипратропия бромид (Ипратропиум Стери-Неб) и комбинацию сальбутамол/ипратропия бромид (Ипрамол Стери-Неб).
Препарат Буденит Стери-Неб (будесонид) является генериком оригинального препарата будесонида Пульмикорт суспензия. Согласно определению Управления по надзору за качеством пищевых продуктов и лекарственных средств США (Food and Drugs Administration of the United States, FDA), генерик (дженерик) — это лекарственный препарат, сравнимый с оригинальным лекарственным препаратом по лекарственной форме, силе действия, способу назначения, качеству, фармакологическим свойствам и показаниям к назначению. Для препаратов-генериков, соответствующих этому определению, характерно: соответствие фармакопейным требованиям, производство в условиях GMP (Good Manufacturing Practice — надлежащая производственная практика), почти полное соответствие оригинальному продукту по составу (вспомогательные вещества могут быть иными) и производимым эффектам, отсутствие патентной защиты, более доступная цена, чем у оригинального препарата.
Все вышеперечисленные характеристики можно отнести к Стери-Небам. Препараты в небулах созданы по передовой технологии 3-ступенчатого «горячего запечатывания, что позволяет достигать максимальной стерильности. В каждом Стери-Небе содержится одна доза лекарственного вещества, и препарат полностью готов к применению (не требует разведения), что исключает ошибки дозирования [15]. Пластиковые ампулы Стери-Неба легко открываются. Лекарственные препараты, находящиеся в Стери-Небах, не содержат бензалкония хлорида и прочих консервантов, что делает их более безопасными, а это очень важно при использовании, особенно в педиатрической практике.
Таким образом, основные принципы терапии бронхообструкции — противовоспалительное лечение и применение бронхолитиков. Именно ИГКС являются важной составляющей противовоспалительной терапии БОС. В настоящее время небулизированный будесонид при обострении БА рассматривается в качестве альтернативы системным глюкокортикостероидам [13]. Преимуществом будесонида при ингаляционном назначении является более быстрое действие ГКС (в течение 1–3 ч), максимальное улучшение бронхиальной проходимости через 3–6 часов, снижение гиперреактивности бронхов и гораздо более высокий профиль безопасности.
С учетом того факта, что в большинстве клинических исследований небулайзерной терапии будесонидом использовался оригинальный препарат Пульмикорт (суспензия), для оценки сопоставимости результатов этих исследований в отношении Буденита Стери-Неб было выполнено сравнение фармацевтической эквивалентности данных препаратов.
Прямое сравнение терапевтической эффективности и безопасности Буденита Стери-Неб (ТEVA, Израиль) и Пульмикорта (суспензии) (AstraZeneca, Великобритания) было проведено в многоцентровом рандомизированном плацебо-контролируемом исследовании в когорте детей (от 5 лет до 11 лет 8 мес), доставленных в отделения неотложной помощи в связи с обострением бронхиальной астмы (исследование III фазы в параллельных группах; 23 исследовательских центра набирали пациентов в 6 странах — Эстонии, Израиле, Латвии, Польше, Колумбии и Мексике). В исследование было включено 302 ребенка. Буденит Стери-Неб (0,5 мг/2 мл и 1 мг/2 мл) и Пульмикорт суспензия (0,5 мг/2 мл и 1 мг/2 мл) значимо не различались по компонентному составу, размеру частиц суспензии, распределению частиц генерируемого аэрозоля по размерам, количеству будесонида во вдыхаемой смеси. Таким образом, химико-фармакологические исследования Буденита Стери-Неб и оригинального препарата Пульмикорт выявили эквивалентность суспензии будесонида двух производителей по основным показателям, влияющим на терапевтический эффект ИГКС. Была продемонстрирована терапевтическая эквивалентность и схожий профиль безопасности Буденита Стери-Неб и оригинального препарата Пульмикорт (суспензия), что позволяет экстраполировать данные, полученные в исследованиях небулизированного будесонида [16].
Таким образом, согласно международным и национальным рекомендациям, наиболее оптимальным, доступным и эффективным препаратом противовоспалительной терапии острого стенозирующего ларинготрахеита, бронхообструктивного синдрома у детей с 6 месяцев жизни является суспензия будесонида с ингаляционным использованием через небулайзер. Появление на фармацевтическом рынке качественных генериков в форме Стери-Небов, в том числе и будесонида (Буденит Стери-Неб), расширяет выбор врача-педиатра при терапии острого стенозирующего ларинготрахеита и бронхообструктивного синдрома у детей. Раннее назначение данного препарата при ООСДП является залогом благоприятного прогноза и предупреждения осложнений.
Данные регламентирующих документов [5, 9, 13] и результаты собственных клинических наблюдений свидетельствуют, что назначение современных ИКС является высокоэффективным и безопасным методом терапии ООСДП тяжелого течения. У детей с 6-месячного возраста и старше наилучшим является ингаляционное введение будесонида через небулайзер в суточной дозе 0,25–1 мг/сутки (объем ингалируемого раствора доводят до 2–4 мл, добавляя физиологический раствор). Препарат можно назначать 1 раз в сутки, однако, как свидетельствует наш опыт, на высоте тяжелого приступа бронхообструкции или стенозе гортани 2–3 степени у детей первых лет жизни более эффективны ингаляции препарата 2 раза в сутки. У больных, ранее не получавших ИКС, целесообразно начать с дозы 0,5 мг через каждые 12 часов, а на 2–3 день, при хорошем терапевтическом эффекте, переходят на 0,25–0,50 мг 1 раз в сутки. Целесообразно назначать ИГС через 15–20 минут после ингаляции бронхолитика, однако возможно и одновременное использование обоих препаратов в одной камере небулайзера. Продолжительность терапии ингаляционными кортикостероидами определяется характером заболевания, длительностью и тяжестью течения обструкции, а также эффектом от проводимой терапии. У детей при остром обструктивном бронхите с тяжелой бронхиальной обструкцией необходимость в терапии ИКС обычно составляет 5–7 дней, а у детей с крупом — 2–3 дня.
Брнхолитическая терапия
В качестве препаратов бронхолитической терапии при БОС могут быть использованы β2-адреномиметики, антихолинергические препараты и их сочетание, а также теофиллины короткого действия.
Согласно национальным рекомендациям препаратами первого выбора являются β2-адреномиметики короткого действия (сальбутамол, тербуталин, фенотерол). Действие данной группы препаратов начинается через 5–10 минут после ингаляции и продолжаются 4–6 часов. Разовая доза сальбутамола, ингалируемого через ДАИ, составляет 100–200 мкг (1–2 дозы), при использовании небулайзера разовая доза может быть значительно увеличена и составляет 2,5 мг (небулы по 2,5 мл 0,1% раствора). Алгоритм неотложной терапии тяжелого БОС предполагает проведение трех ингаляций β2-агониста короткого действия в течение 1 часа с интервалом в 20 минут. Препараты этой группы высокоселективны, следовательно, имеют минимальные побочные эффекты. Однако при длительном бесконтрольном применении β2-агонистов короткого действия возможно усиление бронхиальной гиперреактивности и снижение чувствительности β2-адренорецепторов к препарату.
В качестве бронхолитической терапии с учетом патогенетических механизмов БОС могут быть использованы антихолинергические препараты (ипратропиума бромид). Эта группа препаратов блокируют мускариновые М3-рецепторы для ацетилхолина. Бронходилатирующий эффект ингаляционной формы ипратропиума бромида развивается через 15–20 минут после ингаляции. Через ДАИ со спейсером однократно ингалируют 2 дозы (40 мкг) препарата, через небулайзер — 8–20 капель (100–250 мкг) 3–4 раза в сутки. Антихолинэргические препараты в случаях БОС, возникших на фоне респираторной инфекции, несколько более эффективны, чем α2-агонисты короткого действия.
В настоящее время установлено, что физиологической особенностью детей раннего возраста является наличие относительно небольшого количества адренорецепторов, с возрастом отмечается увеличение их числа и повышение чувствительности к действию медиаторов. Чувствительность М-холинорецепторов, как правило, достаточно высока с первых месяцев жизни. Эти наблюдения послужили предпосылкой для создания комбинированных препаратов. Наиболее часто в комплексной терапии БОС у детей раннего возраста в настоящее время используется комбинированный препарат, сочетающий 2 механизма действия: стимуляцию адренорецепторов и блокаду М-холинорецепторов. При совместном применении ипратропия бромида и фенотерола бронхорасширяющий эффект достигается путем воздействия на различные фармакологические мишени [9, 11, 13].
Муколитическая и отхаркивающая терапия
Муколитическая и отхаркивающая терапия детям с ООСДП инфекционного генеза проводится с учетом возраста ребенка, тяжести течения респираторной инфекции, количества продуцируемой мокроты и ее реологических свойств. Основной целью является разжижение мокроты, снижение ее адгезивности и увеличение эффективности кашля.
При наличии у детей малопродуктивного кашля с вязкой мокротой целесообразно сочетать ингаляционный (через небулайзер) и пероральный путь введения муколитиков, наилучшими из которых являются препараты амброксола (Лазолван, Амбробене, Амброгексал и др.). Эти препараты хорошо зарекомендовали себя в комплексной терапии бронхообструктивного синдрома у детей. Они обладают выраженным муколитическим и мукокинетическим эффектом, умеренным противовоспалительным действием, увеличивают синтез сурфактанта, не усиливают бронхообструкцию, практически не вызывают аллергических реакций. Препараты амброксола при респираторной инфекции детям назначают по 7,5–15 мг 2–3 раза в сутки в виде сиропа, раствора и/или ингаляционно.
Детям с навязчивым малопродуктивным кашлем, отсутствием мокроты целесообразно назначение отхаркивающих лекарственных средств: щелочного питья, фитопрепаратов и др. Фитопрепараты детям с аллергией надо назначать с осторожностью. Можно рекомендовать препараты, созданные из натурального растительного сырья с использованием современных технологий (экстракт листьев плюща — Проспан, Бронхипрет и др.). Возможно сочетание отхаркивающих и муколитических лекарственных средств.
Таким образом, особенностью течения ОРЗ у детей первых лет жизни является частое развитие острых обструктивных состояний дыхательных путей. Основные причины острых обструктивных состояний дыхательных путей у детей с ОРВИ — острый стенозирующий ларинготрахеит, острый обструктивный бронхит, бронхиолит и бронхиальная астма. Эти состояния требуют неотложного проведения терапии. Основным способом доставки препаратов в период обострения заболевания является ингаляционный с использованием небулайзеров. Основными направлениями терапии при ООСДП являются назначение противовоспалительных препаратов, бронхолитических и муколитических препаратов. Препаратами выбора противовоспалительной терапии при ООСДП являются ИГКС. Своевременно назначенная рациональная терапия ООСДП — залог быстрого купирования ООСДП и предупреждения жизнеугрожающих состояний.
При информационной поддержке ООО «ТЕВА»
Литература
С. В. Зайцева, кандидат медицинских наук
С. Ю. Снитко
О. В. Зайцева, доктор медицинских наук, профессор
Э. Э. Локшина, кандидат медицинских наук
ГБОУ ВПО МГМСУ им А. И. Евдокимова МЗ РФ, Москва