можно ли лечить ангину левофлоксацином
Возможности клинического применения левофлоксацина
Антибактериальные препараты из группы фторхинолонов занимают одно из ведущих мест в лечении различных бактериальных инфекций, в том числе в амбулаторных условиях. Однако столь популярные в настоящее время ципрофлоксацин, офлоксацин, ломефлоксацин
Антибактериальные препараты из группы фторхинолонов занимают одно из ведущих мест в лечении различных бактериальных инфекций, в том числе в амбулаторных условиях. Однако столь популярные в настоящее время ципрофлоксацин, офлоксацин, ломефлоксацин, пефлоксацин обладают высокой активностью в отношении грамотрицательных возбудителей, умеренной активностью против атипичных возбудителей и малоактивны в отношении пневмококков и стрептококков, что значительно ограничивает их применение, особенно при респираторных инфекциях.
В последнее десятилетие в клиническую практику стали входить новые препараты из этой группы — т. наз. новые фторхинолоны, которые сохраняют высокую активность против грамотрицательных возбудителей, свойственную их предшественникам, и при этом значительно более активны против грамположительных и атипичных микроорганизмов. Одним из таких препаратов является левофлоксацин (таваник). По химической структуре он представляет собой левовращающий изомер офлоксацина. Широкий спектр антибактериальной активности, высокая безопасность, удобные фармакокинетические свойства обусловливают возможность его широкого применения при различных инфекциях.
Механизм действия
Левофлоксацин обладает быстрым бактерицидным действием, поскольку проникает внутрь микробной клетки и подавляет, так же как и фторхинолоны первого поколения, ДНК-гиразу (топоизомеразу II) бактерий, что нарушает процесс образования бактериальной ДНК. Ферменты клеток человека не чувствительны к фторхинолонам, и последние не оказывают токсического действия на клетки макроорганизма. В отличие от препаратов прежнего поколения новые фторхинолоны ингибируют не только ДНК-гиразу, но и второй фермент, ответственный за синтез ДНК, — топоизомеразу IV, выделенную у некоторых микроорганизмов, прежде всего грамположительных. Считается, что именно воздействием на этот фермент объясняется высокая антипневмококковая и антистафилококковая активность новых фторхинолонов.
Левофлоксацин обладает клинически значимым дозозависимым постантибиотическим эффектом, достоверно более длительным по сравнению с ципрофлоксацином, а также длительным (2-3 часа) субингибирующим действием.
Под действием левофлоксацина отмечено повышение функции полиморфноядерных лимфоцитов у здоровых добровольцев и ВИЧ-инфицированных пациентов. Показано его иммуномодулирующее воздействие на тонзиллярные лимфоциты у больных хроническим тонзиллитом. Полученные данные позволяют говорить не только об антибактериальной активности, но и о синергическом противовоспалительном и антиаллергическом действии левофлоксацина.
Спектр антимикробной активности
Левофлоксацин характеризуется широким антимикробным спектром, включающим грамположительные и грамотрицательные микроорганизмы, в том числе внутриклеточные возбудители (табл. 1).
При сравнении эффективности различных антибактериальных препаратов в отношении возбудителей респираторных инфекций было выявлено, что левофлоксацин в отношении противомикробной активности превосходит остальные препараты. К нему оказались чувствительны все штаммы пневмококка, в том числе пенициллинрезистентные, при сравнительно более низкой чувствительности пневмококков к препаратам сравнения: офлоксацин — 92%, ципрофлоксацин — 82%, кларитромицин — 96%, азитромицин — 94%, амоксициллин/клавуланат — 96%, цефуроксим — 80%. К левофлоксацину оказались также чувствительны все штаммы моракселлы катаралис, гемофильной палочки и метициллин чувствительного золотистого стафилококка, 95% штаммов клебсиеллы пневмонии.
Резистентность
Возможность широкого клинического использования левофлоксацина и других новых фторхинолонов заставляет задуматься об опасности развития резистентности к ним. Хромосомные мутации являются основным механизмом, обеспечивающим устойчивость микробов к фторхинолонам. При этом происходит постепенное накопление мутаций в одном или двух генах и ступенчатое снижение чувствительности. Развитие клинически значимой резистентности пневмококков к левофлоксацину наблюдается после трех мутаций, а следовательно, представляется маловероятным. Это подтверждается и экспериментальными данными: левофлоксацин вызывал спонтанные мутации в 100 раз реже, чем ципрофлоксацин, независимо от чувствительности тестируемых штаммов пневмококка к пенициллину и макролидам. Широкое использование препарата в последние годы в США и Японии не привело к росту резистентности к нему. По данным K. Yamaguchi et al., 1999, чувствительность бактерий к левофлоксацину за пять лет, т. е. с момента начала его широкого применения, не изменилась и превышает 90% как для грамотрицательных, так и для грамположительных возбудителей.
Больший риск развития антибиотикорезистентности связан не с пневмококками, а с грамотрицательными бактериями. В то же время, по некоторым данным, применение левофлоксацина в отделениях интенсивной терапии не сопровождается значимым ростом резистентности грамотрицательной кишечной флоры.
Фармакокинетика
Левофлоксацин хорошо всасывается в желудочно-кишечном тракте. Его биодоступность составляет 99% и более. Так как левофлоксацин почти не подвергается метаболизму в печени, это способствует быстрому достижению максимальной его концентрации в крови (значительно более высокой, чем у ципрофлоксацина). Так, при назначении добровольцам стандартной дозы фторхинолона значения его максимальной концентрации в крови при приеме левофлоксацина составляли 2,48 мкг/мл/70 кг, ципрофлоксацина — 1,2 мкг/мл/70 кг.
После приема разовой дозы левофлоксацина (500 мг) его максимальная концентрация в крови, равная 5,1 ± 0,8 мкг/мл, достигается через 1,3-1,6 часа, при этом бактерицидная активность крови против пневмококков сохраняется до 6,3 часа независимо от их чувствительности к пенициллинам и цефалоспоринам. Более длительное время, до 24 часов, сохраняется бактерицидное действие крови на грамотрицательные бактерии семейства Enterobacteriacae.
Период полувыведения левофлоксацина составляет 6-7,3 часа. Около 87% принятой дозы препарата выделяется с мочой в неизмененном виде в течение последующих 48 часов.
Левофлоксацин быстро проникает в ткани, при этом уровни тканевых концентраций препарата выше, чем в крови. Особенно высокие концентрации устанавливаются в тканях и жидкостях респираторного тракта: альвеолярных макрофагах, слизистой бронхов, бронхиальном секрете. Левофлоксацин также достигает высоких концентраций внутри клеток.
Длительный период полувыведения, достижение высоких тканевых и внутриклеточных концентраций, а также наличие постантибиотического действия — все это позволяет назначать левофлоксацин один раз в сутки.
Лекарственные взаимодействия
Биодоступность левофлоксацина снижается при одновременном приеме с антацидами, сукральфатом, препаратами, содержащими соли железа. Интервал между приемом этих лекарственных средств и левофлоксацина должен составлять не менее 2 часов. Других клинически значимых взаимодействий левофлоксацина выявлено не было.
Клиническая эффективность
Существует много публикаций, посвященных результатам клинических исследований эффективности применения левофлоксацина. Ниже представлены наиболее значимых из них.
В многоцентровом рандомизированном исследовании, включившем 590 пациентов, сравнивалась эффективность и безопасность двух режимов лечения: левофлоксацина в/в и/или перорально в дозе 500 мг в сутки и цефтриаксона в/в 2,0 г в сутки; и/или цефуроксима перорально 500 мг два раза в сутки в комбинации с эритромицином или доксициклином у больных с внебольничной пневмонией. Длительность терапии 7–14 дней. Клиническая эффективность составила 96% в группе левофлоксацина и 90% в группе, получавшей цефалоспорины. Эрадикация возбудителей была достигнута соответственно у 98 и 85% больных. Частота нежелательных действий в группе левофлоксацина составляла 5,8%, а в группе сравнения 8,5%.
В другом большом рандомизированном исследовании сравнивалась эффективность лечения больных с тяжелой пневмонией левофлоксацином 1000 мг в сутки и цефтриаксоном — 4 г в сутки. Первые дни левофлоксацин назначили в/в, затем перорально. Результаты лечения в обеих группах оказались сопоставимы, но в группе цефтриаксона наблюдалась достоверно более частая смена антибиотика в первые дни лечения — из-за недостаточного клинического эффекта.
Сопоставимые результаты были получены и при сравнении групп пациентов, получавших лечение левофлоксацином и коамоксиклавом.
Эффективность монотерапии левофлоксацином изучалась у более чем 1000 пациентов с внебольничной пневмонией. Клиническая и бактериологическая эффективность составляли здесь 94 и 96% соответственно.
Фармакоэкономические исследования показали, что общие затраты на лечение пациентов левофлоксацином и комбинацией цефалоспорина и макролида сопоставимы или даже несколько ниже в группе левофлоксацина.
У пациентов с обострением хронического бронхита сравнивалась эффективность лечения левофлоксацином в дозе 500 мг в сутки перорально и цефуроксимом аксетила внутрь 500 мг два раза в сутки. При этом клиническая и бактериологическая эффективность не различалась в зависимости от групп и составляла 77–97%.
Таким образом, в настоящее время можно считать доказанной высокую эффективность левофлоксацина при респираторных инфекциях нижних дыхательных путей. Результаты проведенных исследований позволили включить левофлоксацин как препарат первого ряда или альтернативный в схему лечения пациентов с внебольничной пневмонией и обострениями хронического бронхита (табл. 2).
В последние годы левофлоксацин стал более широко использоваться и при других инфекционных заболеваниях. Так, появились сообщения, касающиеся его успешного применения у больных с острыми синуситами. Левофлоксацин в 100% случаев активен против наиболее часто встречающихся бактериальных возбудителей этого заболевания; по эффективности он сопоставим с амоксициллином/клавуланатом в больших дозах и значительно превосходит цефалоспорины, котримоксазол, макролиды и доксициклин.
Среди возбудителей урологических инфекций наблюдается рост резистентности к широко используемым антибактериальным препаратам. Так, за период с 1992 по 1996 год отмечено увеличение устойчивости E. Coli и S. saprophyticus к котримоксазолу — на 8–16% и к ампициллину — на 20%. Устойчивость к ципрофлоксацину, нитрофуранам и гентамицину возрасла за этот же период на 2%. Применение левофлоксацина у пациентов с осложненными мочевыми инфекциями в дозе 250 мг в сутки оказалось эффективным у 86,7% пациентов.
Выше приводились фармакокинетические показатели высокого содержания левофлоксацина в тканях. Это наряду с антимикробным спектром препарата послужило основанием для его использования с целью профилактики инфекционных осложнений при эндоскопических методах лечения и диагностики, например при ретроградной холангиопанкреатографии и для периоперационной профилактики в ортопедии.
Применение левофлоксацина в этих ситуациях представляется перспективным и требует дальнейшего изучения.
Безопасность
Левофлоксацин считается одним из самых безопасных антибактериальных препаратов. Однако при его назначении существует ряд ограничений.
У пациентов с нарушением функции печени корригировать дозу препарата не нужно, но нарушение функции почек при снижении клиренса креатинина (менее 50 мл/мин) требует уменьшения дозы препарата. Дополнительный прием левофлоксацина после проведения гемодиализа или амбулаторного перитониального диализа не требуется.
Левофлоксацин не применяется у беременных и кормящих женщин, у детей и подростков. Препарат противопоказан пациентам, у которых в анамнезе имеются нежелательные реакции на лечение фторхинолонами.
У больных пожилого и старческого возраста при приеме левофлоксацина не выявлено повышенного риска развития нежелательных побочных реакций и не требуется коррекции доз.
Контролируемые клинические исследования показали, что побочные реакции при применении левофлоксацина возникают редко и большей частью не являются серьезными. Существует зависимость между дозой препарата и частотой развития НД: при суточной дозе 250 мг их частота не превышает 4,0–4,3%, при дозе 500 мг/ сут. — 5,3–26,9%, при дозе 1000 мг/сут. — 22–28,8%. Наиболее часто наблюдались симптомы желудочно-кишечной диспепсии — тошнота и диарея (1,1–2,8%). При внутривенном введении возможно покраснение места инъекции, иногда наблюдается развитие флебитов (1%).
Дозирование
Левофлоксацин выпускается в двух формах: для внутривенного введения и приема внутрь. Применяется по 250-500 мг один раз в сутки, при тяжелых инфекциях возможно назначение по 500 мг два раза в сутки. При внебольничной пневмонии длительность лечения составляет 10-14 дней, при обострении хронического бронхита — 5-7 дней.
Таблица 1. Спектр противомикробной активности левофлоксацина
Значение левофлоксацина (Таваника) при респираторных инфекциях
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Инфекции дыхательных путей являются самыми частыми инфекционными заболеваниями у человека. Несмотря на наличие в арсенале врача большого количества антибактериальных препаратов разных классов, результаты лечения этих заболеваний не улучшаются, более того за последние годы наблюдается отчетливая тенденция к увеличению смертности от пневмонии во всех развитых странах мира. Причина может быть связана, в частности, с ростом резистентности основных возбудителей внебольничных инфекций дыхательных путей ко многим антибактериальным препаратам. Этим объясняется интерес клиницистов к новым антибактериальным средствам, к которым отмечается меньший уровень резистентности бактерий.
В начале 80–х годов прошлого столетия в клинической практике появились первые препараты группы фторхинолонов, которые характеризовались широким спектром антимикробной активности, благоприятной тканевой фармакокинетикой (концентрации в большинстве тканей превышали сывороточные). Уникальность механизма действия фторхинолонов на микробную клетку (ингибирование ДНК–гиразы или топоизомеразы IV) объясняла отсутствие перекрестной устойчивости с другими классами антимикробных средств.
Наиболее хорошо изученными препаратами ранних фторхинолонов являются ципрофлоксацин (проявляет наиболее высокую активность in vitro против энтеробактерий и синегнойной палочки) и офлоксацин (наиболее высокая активность против хламидий). Фторхинолоны заняли ведущие позиции при лечении различных бактериальных инфекций, прежде всего нозокомиальных, основными возбудителями которых являются грамотрицательные бактерии.
Недостатком ранних фторхинолонов является невысокая природная активность против грамположительных микроорганизмов, главным образом Streptococcus pneumoniae, что не позволяло рекомендовать эти препараты для лечения внебольничных респираторных инфекций.
В конце 90–х годов в клинике появились препараты группы фторхинолонов, принципиально отличающиеся по антимикробным свойствам от ранних препаратов. Эти отличия характеризуются прежде всего значительно более высокой природной активностью против грамположительных бактерий (пневмококков, стафилококков, энтерококков) и атипичных микроорганизмов (хламидий, микоплазм). Эти препараты были названы «новыми фторхинолонами» или «респираторными фторхинолонами». Первым из респираторных фторхинолонов был левофлоксацин, в дальнейшем появились другие препараты (моксифлоксацин, гатифлоксацин, гемифлоксацин).
Благодаря высокой активности новых фторхинолонов в отношении грамположительных микробов, включая S. pneumoniae, резистентных к другим антибиотикам, они в основном позиционировались для лечения внебольничных инфекций дыхательных путей, в связи с чем их иногда называют «респираторными фторхинолонами». Нужно иметь в виду, что наряду с повышенной активностью против грамположительных бактерий все новые фторхинолоны сохраняют, а в ряде случаев превосходят высокую активность ранних фторхинолонов против грамотрицательных бактерий. В связи с этим в последние годы появляется все больше обоснований применения этих препаратов не только при лечении респираторных инфекций, но также инфекций кожи и мягких тканей и урогенитальных инфекций. Поэтому термин «респираторные фторхинолоны» в настоящее время не совсем точно отражает клиническое значение этих препаратов, но обозначает наиболее важное их место в медицине.
В настоящей работе будет обсуждено клиническое значение левофлоксацина при респираторных инфекциях. Левофлоксацин (Таваник) является наиболее хорошо изученным препаратом среди новых фторхинолонов и имеет наиболее широкие зарегистрированные показания (табл. 1).
Внебольничные респираторные инфекции включают пневмонию, острый бронхит, обострение хронического бронхита, синусит, острый тонзиллофарингит. Если острый бронхит и тонзиллофарингит у взрослых имеют преимущественно вирусную этиологию и в большинстве случаев не требуют антибиотикотерапии, то пневмония, обострение хронического бронхита и синусит – заболевания бактериальной этиологии (табл. 2).
Левофлоксацин характеризуется высокой природной активностью против всех возбудителей внебольничных респираторных инфекций, причем его активность в отношении грамположительных микроорганизмов в 2–4 раза превосходит активность ранних фторхинолонов – ципрофлоксацина, офлоксацина и пефлоксацина (табл. 3).
В последние годы серьезной проблемой стала широко распространенная устойчивость пневмококков к пенициллинам и макролидам, что лимитирует эффективность этих антибиотиков при респираторных инфекциях. В некоторых странах Европы и США уровень устойчивости S. pneumoniae к пенициллину и макролидам достигает 30–40% [3], в то же время устойчивость к левофлоксацину находится на минимальном уровне (0,1–1%) [4–5], причем она не нарастает на протяжении последних лет. Так, за три сезона респираторных инфекций (1999–2000, 2000–2001, 2002) исследовали чувствительность к левофлоксацину штаммов S. pneumoniae, выделенных у больных с респираторными инфекциями [6]. Отмечен низкий уровень устойчивости пневмококков к левофлоксацину (
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Можно ли лечить ангину левофлоксацином
(1) ФГБУ НКЦ оториноларингологии ФМБА России, Москва (2) ФГБОУ ДПО РМАНПО Минздрава России, Москва
Впрактике врача-оториноларинголога бывают ситуации, когда стартовая эмпирическая антибактериальная терапия не приводит к быстрому эффекту. В этом случае, оценивая состояние пациента через 72 часа, врачу необходимо сменить антибиотик на более сильный, с широким спектром действия. При этом нередко смену осуществляют на антимикробные средства класса хинолонов – фторхинолоны. Препаратам этой группы присущи хорошие фармакокинетические свойства, высокая степень проникновения в ткани и клетки как человека, так и микроорганизма.
Фторхинолоны выгодно отличаются от других антибиотиков своими свойствами: ингибированием фермента ДНК-гиразы – фермента бактериальной клетки, с широким спектром антимикробного действия (грамотрицательные и грамположительные аэробные бактерии, микобактерии, Mycoplasma pneumonia, Chlamydia pneumoniae); высокой степенью бактериальной активности; возможностью создания в тканях и клетках человека концентраций препаратов, близких к сывороточным или их превышающих; хорошей переносимостью и небольшой частотой побочных эффектов. Кроме того, длительный период полувыведения определяет удобный режим дозирования – 1–2 раза в сутки. Так, препарат этой группы левофоксацин при приеме внутрь имеет большой объем распределения и достигает высоких концентраций в тканях, фагоцитах и жидкостях организма, в частности в тканях околоносовых пазух, а также в макрофагах [1].
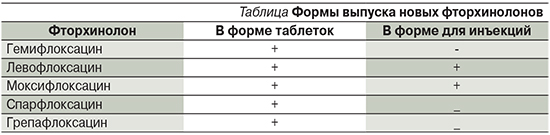
В настоящее время синтезированы новые препараты группы фторхинолонов, проявляющие более высокую активность в отношении грамположительных бактерий, прежде всего пневмококков, что позволило выделить их в отдельную подгруппу – 2-го поколения, или новые фторхинолоны (см. таблицу). При этом левофлоксацин и моксифлоксацин выпускают в двух формах: в таблетках и для внутримышечного введения, что позволяет использовать их в виде ступенчатой терапии, что снижает стоимость лечения.
Препараты этой группы оказывают выраженное действие на грамотрицательные бактерии (Moraxella catarrhalis, Legionella spp.), Haemophilus influenzae (включая штаммы, продуцирующие β-лактамазы) [2].
Препараты группы новых фторхинолонов обладают более высокой природной активностью в отношении Streptococcus pneumoniae по сравнению с ранними фторхинолонами (например, левофлоксацин – 1 мг/л). В связи с этим их целесообразно назначать при внебольничных инфекциях дыхательных путей. При этом активность новых фторхинолонов не различается в отношении пенициллинчувствительных и пенициллинрезистентных штаммов пневмококка. В настоящее время установлено, что резистентность пневмококков к новым фторхинолонам минимальная (менее 1%). Высокая активность фторхинолонов 2-го поколения в отношении S. pneumoniae крайне важна, т.к. острые и хронические заболевания в настоящее время достаточно часто вызывает этот патоген.
Препараты группы новых фторхинолонов превосходят ранние по активности в отношении других стрептококков (группы А и С) и стафилококков (Staphylococcus aureus). В отношении Pseudomonas aeruginosa самым активным фторхинолоном остается ципрофлоксацин, из новых фторхинолонов реальной антипсевдомонадной активностью обладает лишь левофлоксацин.
Установлено, что совместный прием ряда препаратов (антациды, сукральфат, соли висмута, кальция, препараты железа) уменьшает биодоступность фторхинолонов при их пероральном приеме, что может приводить к снижению эффективности последних. Следует иметь в виду, что прием пищи замедляет всасывание фторхинолонов.
Имеются ограничения применения препаратов этой группы для беременных и кормящих женщин, детей и подростков в возрасте до 16–18 лет. Это выявлено в эксперименте о повреждающем действии фторхинолонов в отношении хрящевой ткани неполовозрелых животных. Однако эти данные не подтверждены в клинике. Но такое противопоказание оправданно, т.к. строго ограничивает широкое нерациональное использование фторхинолонов в педиатрии до получения надежных доказательств их безопасности для пациентов этой категории.
Анализ базы данных фармаконадзора Италии показал, что относительный риск развития побочных эффектов при применении левофлоксацина не отличался от такового у пероральных антибиотиков других классов [3].
К наиболее частым побочным эффектам при применении фторхинолонов относятся симптомы со стороны желудочно-кишечного тракта (тошнота, рвота, диарея, боли в животе, изменения вкуса), однако в большинстве случаев они носят умеренный характер и не требуют отмены лечения.
В клинических исследованиях левофлоксацина наиболее распространенным побочным эффектом была диарея, встречавшаяся с частотой 4–6%, что существенно ниже, чем при применении пероральных пенициллинов или цефалоспоринов [4]. Побочные эффекты со стороны центральной нервной системы – ЦНС (головная боль, головокружение и нарушения сна), являющиеся классовым эффектом фторхинолонов, при лечении левофлоксацином (1%) наблюдались реже.
Все фторхинолоны примерно с одинаковой частотой вызывают реакции со стороны ЦНС (5–8%), минимальная нейротоксичность отмечена у офлоксацина и левофлоксацина. Реакции со стороны ЦНС характерны для всех препаратов этого класса. Однако их наблюдают нечасто, они, как правило, проявляются головной болью, головокружением, сонливостью, расстройством сна (эти симптомы обычно возникают в 1-й день лечения и исчезают сразу после отмены). Развитие судорог описано значительно реже. Они возникают в основном на 3–4-й день лечения у больных, имеющих предрасполагающие факторы (эпилепсию, мозговую травму, гипоксию, пожилой возраст, сочетанное применение с теофиллином или нестероидными противовоспалительными средствами) и саморазрешаются при отмене препарата [5].
Частота возникновения кожных сыпей при применении левофлоксацина составляет 0,2% [6]. Частота анафилактоидных реакций при лечении левофлоксацином сопоставима с таковой у большинства препаратов этой группы – 1,8–23,0 на 1 млн дней лечения [6]. Частота развития анафилаксии на 1 млн суточных доз составила для левофлоксацина 0,6 [7].
В клинических исследованиях левофлоксацина гепатобилиарные поражения встречались в 0,1–1,0% случаев [6]. Частота гепатита, некроза печени и печеночной недостаточности при лечении левофлоксацином, согласно данным Фармаконадзора Франции, составляет 500 мс, а также избегать сочетанного применения фторхинолонов с другими лекарственными средствами, вызывающими удлинение интервала QT [10, 11].
В эпидемиологических исследованиях частота развития тендинопатий при применении фторхинолонов составила 1:2000 [10], по данным FDA (Food and Drug Administration), 1,3–5,6 на 10 тыс. пациенто-лет [12]. Пятилетнее наблюдение за детьми (n=6000), принимавшими антибиотики, показало, что частота поражений сухожилий или суставов при применении левофлоксацина, составляет
1. Torres A., Liapikou A. Levofloxacin for the treatment of respiratory tract infections. Expert. Opin. Pharmacother. 2012;13(8):1203–12.
2. Яковлев С.В. Место фторхинолонов в лечении бактериальных инфекций. РМЖ. 2003;8:434–49.
3. Salvo F., Polimeni G., Cutroneo P.M., Leone R., Confortic A., Moretti U., Motola D., Tuccori M., Caputi A.P. Allergic reactions to oral drugs: a case/non-case study from an Italian spontaneous reporting database (GIF). Pharmacol. Res. 2008;58:202–7.
4. Stahlmann R., Lode H.M. Risks associated with the therapeutic use of fluoroquinolones. Expert. Opin. Drug. Saf. 2013;12(4):497–505.
5. Lipsky B.A., Baker C.A. Fluoroquinolone toxicity profiles: a review focusing on newer agents. Clin. Infect. Dis 1999;28(2):352–64.
6. Liu H.H. Safety profile of the fluoroquinolones: focus on levofloxacin. Drug. Saf. 2010;33:353–69.
7. Blanca-López N., Andreu I., Torres Jaén M.J. Hypersensitivity reactions to quinolones. Curr. Opin. Allergy. Clin. Immunol. 2011;11:285–91.
8. Carbon C. Effets indésirables de la lévofloxacine: données des études cliniques et de la pharmacovigilance. Therapie. 2001;56:35–40.
9. Owens R.C., Ambrose P.G. Antimicrobial safety: focus on fluoroquinolones. Clin. Infect. Dis. 2005;41(Suppl. 2):144–57.
10. Stahlmann R., Lode H.M. Risks associated with the therapeutic use of fluoroquinolones. Expert. Opin. Drug. Saf. 2013;12(4):497–505.
11. Zipes D.P., Camm A.J., Borggrefe M., et al. ACC/AHA/ESC 2006 guidelines for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death-еxecutive summary: A report of the American College of Cardiology/American Heart Association Task Force and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Develop Guidelines for Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death) Developed in collaboration with the European Heart Rhythm Association and the Heart Rhythm Society. Eur. Heart J. 2006;27(17):2099–114.
12. Arabyat R.M., Raisch D.W., McKoy J.M., Ben-nett C.L. Fluoroquinolone-associated tendon-rupture: a summary of reports in the Food and Drug Administration’s adverse event reporting system. Expert. Opin. Drug. Saf. 2015;14(11):1653–60.
13. Yee C.L., Duffy C., Gerbino P.G., Stryker S., Noel G.J. Tendon or joint disorders in children after treatment with fluoroquinolones or azithromycin. Pediatr. Infect. Dis. J. 2002;21(6):525–29.
14. Gilbert P., J. Das and I. Foley. Biofilms susceptibility to antimicrobials. Adv. Dent. Res. 1997;11:160–67.
15. Brooun A., Liu S., Lewis K. A dose-responsestudy of antibiotic resistance in Pseudomonas aeruginosa biofilms. Antimicrob. Agents Chemo-ther. 2000;44:640–46.
16. Lewis K., Spoering A.L., Kaldalu N., et al. Persisters: specialized cells responsible for biofilm tolerance. Biofilms, infection and antimicrobial therapy. Ed. by Pace J.L., Rupp M., Finch R.G. Taylor & Francis Group. 2005. P. 241–57.
17. Goto T., Nakame Y., Nishida M., Ohi Y. In vitro bactericidal activities of beta-laktamases, amikacin and fluoroquinolones against Pseudomonas aeruginosa biofilm in artificial urine. Urology. 1999;53(5):1058–62.
18. Bjarnsholt T. Biofilm infections. Springer. 2011. 314 p.
19. Trampuz A., Zimmerli W. Diagnosis and treatment of infections associated with fractu-refixation devices. Injury. 2006;37:59–66.
20. Costerton J.W., Montanaro L., Arciola C.R. Biofilm in implant infections: its production and regulation. Int. J. Artif. Organs. 2005;11:1062–68.
21. Catheter-Related Infections (Infectious Disease and Therapy). Ed. by Seifert H., Bernd J., Farr B.M. Marcel Dekker. 2005. 519 p.
22. Мележик И.А., Яворская Н.В., Шепелевич В.В., Кокозей В.Н. Роль боипленок Pseudomonas aeruginosa в развитии эндогенных инфекций. Бюллетень Оренбургского научного центра УрО РАН (электронный журнал)., 2013;3.
23. Бузолева Л.С., Пузь А.В., Синебрюхов С.Л., Гнеденков С.В., Ким А.В., Еськова А.И., Пономарева А.Л. Имптантат-ассоцииро-ванные инфекции, связные с проблемой биопленкообразования. Современные проблемы науки и образования. 2016;5. URL: https://science-education.ru/ru/article/view?id=25430.
24. Shehab N., Patel P.R., Srinivasan A., Budnitz D.S. Emergency department visits for antibiotic-associated adverse events. Clin. Infect. Dis. 2008;47:735–43.
25. Крюков А.И., Кунельская Н.Л., Гуров А.В., Туровский А.Б., Изотова Г.Н. Клиника, диагностика и лечение бактериального синусита. Метод. рекомендации №23. М., 2013. 27 с.
26. IMS Health National Sales Perspective (NSP), Y2014. Source File: NSP_2015-896 FQ AC 2014.