можно ли иметь детей при герпесе
Герпес и бесплодие у мужчин: в чем связь и что делать?
Связь герпесвирусов и мужского бесплодия — на сегодня одна из актуальных и важных проблем в медицине, учитывая, что вирусом простого герпеса (ВПГ) заражены около 40-60% взрослого населения. Речь идет о генитальной форме, при которой заболевание проявляется на слизистой наружных и внутренних половых органов. Ввиду актуальности проблемы предлагаем подробнее изучить, в чем же связь герпеса и бесплодия у мужчин.
Особенности генитального герпеса у мужчин
Еще недавно изучением генитального герпеса занимались дерматовенерологи. С течением времени стало ясно, что в случае с мужским здоровьем эта проблема касается также урологов и андрологов. У мужчин генитальный герпес имеет 2 клинические формы:
Во многих случаях единственным признаком генитального герпеса становится выделение вируса в отделяемом органов мочеполовой системы. Симптомы воспаления при этом минимальные и неспецифические, а по результатам анализов даже не удается выявить объективные признаки того, что в организме протекает воспалительный процесс. Все это подчеркивает сложность диагностики генитального герпеса. Чаще всего его выявляют по типичным клиническим проявлениям рецидивов.
Влияние вируса герпеса на репродуктивную функцию
У мужчин, имеющих диагноз «бесплодие», в 31% случаев инфекционно-активный ВПГ выявляется в эякуляте и в 30% во фракции подвижных сперматозоидов. Статистика для здоровых пациентов — это 17% и 8% соответственно. Это доказывает, что герпес опасен для мужчин и напрямую влияет на состояние репродуктивной системы. У пациентов с обнаруженным герпесвирусом наблюдаются:
В процессе обследования мужчин с ВПГ было выяснено, что вирус герпеса находится не только в семенной жидкости и на поверхности клеток, но и внутри сперматозоидов. Причем инфицированию подвергается и фракция спермиев с нормальным строением и размерами. Это и позволяет предположить, что оплодотворение яйцеклетки может произойти инфицированным сперматозоидом. Если здесь рассматривать, на что влияет герпес у мужчин, то нужно сказать, что при успешном зачатии высок риск, что беременность будет протекать с осложнениями, у плода и уже новорожденного ребенка могут развиться различные аномалии.
Вирусный простатит
Вирус герпеса может быть причиной развития простатита. В большинстве случаев заболевание вызывают бактерии, но абактериальную (вирусную) форму тоже нельзя исключать. По оценкам разных специалистов ВПГ вызывает или поддерживает развитие простатита в 2,9-21,8% случаев.
Простатит развивается как осложнение вирусного уретрита, т. е. поражения мочеиспускательного канала, которое чаще всего происходит половым путем. Из уретры вирус проникает в предстательную железу, т. е. в развитии простатита преобладает уретрогенный каналикулярный путь передачи — из уретры по семявыносящему протоку.
Заболевание может проявляться в виде изолированной формы. Тогда ВПГ не определяется в отделяемом уретры, а рецидивы герпеса отсутствуют. В таком случае вирус обнаруживают в секрете предстательной железы. Это важно, поскольку определение возбудителя — одно из решающих условий для проведения полноценного лечения.
Другим признаком вирусного простатита становятся выраженные фиброзные очаги в периферических зонах предстательной железы. Их обнаруживают на УЗИ как гиперэхогенные участки размером 3-9 мм. Это характерный признак, отличающий герпетический простатит от других абактериальных форм заболевания.
Как проявляется бесплодие и как его лечат
Как уже было сказано, герпес и бесплодие у мужчин имеют прямую связь. Проблема с зачатием из-за герпесвируас проявляется в виде вирусоспермии. Это один из видов патоспермии — патологического изменения эякулята, при которых наблюдаются различные отклонения от нормальных показателей.
Вирус простого герпеса — это пожизненное носительство. Поэтому лечение бесплодия направлено только на достижение стойкой ремиссии, которая позволит добиться беременности и рождения здорового ребенка. С этой целью мужчинам, у которых в секрете простаты был обнаружен ВПГ и диагностирована вирусоспермия, назначают противогерпетические препараты. Их принимают по супрессивной схеме, т. е. рецидивы отсутствуют только в течение курса приема. Чтобы добиться нормализации качества спермы, лекарство принимают не менее 2,5-3 месяцев.
Что в итоге
В связи с тем, что генитальный герпес и бесплодие имеют прямую связь, в парах, где планируется беременность или есть проблемы с зачатием, мужчине необходимо пройти вирусологическое обследование. Это важно, поскольку бессимптомные формы ВПГ-инфекции органов мочеполовой системы встречаются чаще, чем принято считать.
Для обследования вам необходимо записаться на первичную консультацию к урологу-андрологу. В клинике Dr. AkNer вы можете выбрать удобное время для приема. Для этого позвоните нам по контактному номеру или напишите в онлайн-чате, и специалист поможет вам с записью на любой день.
Медицинские интернет-конференции
Языки
Оценка состояния здоровья детей, рожденных от герпес-инфицированных матерей
Санталова Г.В., Гасилина Е.С., Валеева Г.Р., Шарыпова М.А., Ефимова И.Л., Плахотникова С.В., Сошникова Л.Н.
В последнее время вследствие высокой инфицированности населения вирусными инфекциями растет интерес к их возбудителям, в частности к вирусам семейства Herpes, под влиянием которых часто происходят внутриутробное инфицирование плода и повреждение плаценты. При хронических и рецидивирующих инфекциях частота внутриутробного инфицирования невелика, однако фетоплацентарная недостаточность и потери плода встречаются примерно с той же частотой, что и при острых формах. Исследования последних лет позволяют говорить о значимости внутриутробной инфекции в патогенезе патологических состояний, формирующихся в последующие годы жизни. Крайне важной остается проблема ранней диагностики внутриутробной инфекции и исхода её развития. В связи с этим не вызывает сомнения необходимость разработки комплексного подхода к решению вопроса о прогнозировании инфекции у новорожденного путем своевременной диагностики и проведения соответствующих лечебно–профилактических мероприятий с целью предупреждения формирования тяжелой соматической патологии и инвалидизации у детей.
Целью исследования явилось изучение состояния новорожденных детей, родившихся от герпес-инфицированных матерей.
Обследовано 216 новорожденных. Проведен анализ состояния здоровья детей; оценивалось состояние фетоплацентарной системы беременных. Новорожденные дети были распределены на 3 группы: в 1-ю вошли 73 ребенка от матерей с фетоплацентарной недостаточностью (ФПН) и латентным течением герпетической инфекции; 2-ю составили 68 детей от матерей с латентной герпетической инфекцией без признаков ФПН, 3-ю – 75 новорожденных от матерей, не имевших в анамнезе герпеса и с отрицательными результатами обследования на герпетическую инфекцию (ГИ).
У матерей с герпетической инфекцией недоношенными родились 28 (13,0%) детей, у неинфицированных – 8 (3,7%). Гестационный возраст во всех группах колебался от 29 до 42 недель; масса тела при рождении – от 1850 до 4300 граммов. Среди родившихся выявлено значительное число детей с синдромом внутриутробной задержки развития плода (ВЗРП): 44 (20,4%) – из I группы (чаще встречались дети с ВЗРП II и III степеней) и 10 (4,6%) – из III (преобладали дети с ВЗРП I степени). У большинства новорожденных были диагностированы перинатальное поражение ЦНС, синдром пролонгированной желтухи, синдром дыхательных расстройств, гипотрофия, анемия, дисбиоз кишечника, аномалии и пороки развития. У детей I и II групп эти изменения встречались чаще. Следует отметить, что такая патология, как кисты сосудистых сплетений головного мозга, кальцинаты вещества головного мозга, герпетическая экзема, врожденный хориоретинит, герпетический гепатит, нефрит, встречалась только у детей с подтвержденной на 2-8 день жизни герпетической инфекцией. Из I группы таких случаев было 44 (20,4%), из II – 9 (4,2%).
Таким образом, оценивая состояние здоровья новорожденных детей, родившихся от герпес-инфицированных матерей, важно учитывать состояние фетоплацентарного комплекса.
Клинические проявления ГЕРПЕТИЧЕСКОЙ ИНФЕКЦИИ У БЕРЕМЕННЫХ
Каковы возможные последствия инфицирования ВПГ во время беременности? Какие формы герпетической инфекции у беременной женщины наиболее опасны для плода и новорожденного? Каковы возможные варианты клинических проявлений герпетической инфекции у н
Каковы возможные последствия инфицирования ВПГ во время беременности?
Какие формы герпетической инфекции у беременной женщины наиболее опасны для плода и новорожденного?
Каковы возможные варианты клинических проявлений герпетической инфекции у новорожденных?
Частота распространенности вируса простого герпеса (ВПГ) среди беременных в США составляет 22-36%, в Европе — 14-19%. За период с 1966 по 1993 год частота случаев герпеса у новорожденных также возросла с 2,4 до 28,2 случаев на 100 тыс. новорожденных [19]. В России распространенность ВПГ среди популяции увеличилась в период с 1993 по 1997 год с 8,5 до 14,1 случаев на 100 тыс. населения [5]. Однако истинная частота врожденного герпеса и герпеса новорожденных остается неустановленной, так как в большинстве стран мира отсутствуют правила обязательной регистрации герпетической инфекции [17].
Герпетическая инфекция может протекать атипично, латентно, что представляет большие трудности для своевременного ее распознавания и является причиной диагностических ошибок.
Общепринятые бактериологические и микробиологические исследования не всегда позволяют выявить возбудителя в острой фазе заболевания, и нередко болезнь принимает хроническое течение, а женщины становятся носителями вирусной инфекции. Специфическая локализация ВПГ приводит к хроническим воспалительным процессам (эндометриту, цервициту, вульвовагиниту), а во время беременности – к поражению плаценты, плода и невынашиванию [2, 3, 7].
Внутриутробная герпетическая инфекция в ранний период беременности обычно заканчивается развитием уродства плода и самопроизвольным выкидышем. Инфицирование плода во II-III триместрах беременности может привести к развитию клинически манифестирующего герпеса у новорожденного в виде генерализованных или локальных проявлений (поражение ЦНС, глаз, кожи, ротовой полости) и латентного носительства [2, 4, 7, 10].
Влияние герпетической инфекции на течение беременности и состояние плода обусловлено двумя основными механизмами.
Во-первых, возможно инфицирование плаценты, околоплодных вод и оболочек, а также самого плода. Это может привести к повреждению плаценты, оболочек, тератогенным изменениям в тканях эмбриона и плода, к развитию локальных или генерализованных поражений, а также к латентной инфекции плода, с последующими клиническими проявлениями в постнатальном периоде.
Во-вторых, возможно влияние ГИ с развитием у беременной лихорадки, нарушений функции фетоплацентарной системы, гомеостаза, гормонального баланса. Указанные причины могут приводить к ранним и поздним выкидышам, задержке развития беременности, преждевременным родам, антенатальной гипотрофии, гипоксии, уродствам и гибели плода, развитию врожденных форм инфекции у новорожденных [6, 8, 11].
Многообразие клинических проявлений обусловлено длительностью и формой манифестации инфекции у беременной, свойствами и вирулентностью вируса, состоянием плацентарного барьера и защитных сил как матери, так и плода [6].
Изучение влияния герпетической инфекции на течение беременности, развитие плода и новорожденного показало, что наиболее серьезную опасность в любом триместре беременности представляют генерализованные формы ГИ у женщин и первичная инфекция во время родов.
Частота инфицирования новорожденного при наличии у беременной первичной герпетической инфекции достигает 40-50%, тогда как при рецидивирующей – 5% [12, 15, 20]. Такое различие обусловлено тем, что при рецидивирующей форме инфекции интенсивность и продолжительность выделения вируса меньше, чем при первичной. Кроме того, защитное действие оказывают специфические антитела, пассивно передающиеся новорожденному от матери, страдающей рецидивирующей формой герпетической инфекции. Следует иметь в виду, что внутриутробное инфицирование плода может происходить как при первичной, так и при рецидивирующей герпетической инфекции. При массивной вирусемии создаются благоприятные условия для трансплацентарного проникновения ВПГ в плод.
| Герпетические инфекции у беременных относятся к числу самых распространенных заболеваний, определяющих внутриутробное инфицирование, эмбрио- и фетопатии, акушерскую патологию. В последние годы отмечена тенденция к увеличению инфицирования беременных вирусом простого герпеса и способностью ГИ, при определенных условиях, к эндемическому распространению |
Поскольку беременность сопровождается иммуносупрессией, она может быть одним из естественных предрасполагающих факторов реактивации латентной герпетической инфекции и способствовать более частому рецидивированию, диссеминации ВПГ в организме, развитию генерализованной инфекции. Основные функциональные системы оказываются в “режиме предельной загруженности” и не могут адекватно и надежно реагировать на развитие инфекции. Решающее значение в этом сложном патологическом процессе, по-видимому, принадлежит состоянию иммунологической реактивности организма беременной.
По особенностям клинической картины течения заболевания выделяют: первичный (острый) и рецидивирующий (хронический) герпес [1].
Первичный генитальный герпес в типичных случаях начинается с локальных симптомов: болей, высыпаний на коже больших и малых половых губ, промежности, слизистой влагалища и шейке матки, дизурии, уретральных и вагинальных выделений, болезненности в паху. Инкубационный период, как правило, колеблется от трех до семи суток. Очень высок процент (до 60%) атипичного течения, когда единственным симптомом инфекции являются вагинальные выделения. Изменения могут проявляться в виде зуда, жжения, эритемы, отечности, единичных или сгруппированных везикул и папул, эрозии и язв, которые разрешаются к 6–12 дню. После отторжения корочек происходит эпителизация пораженных участков без существенных изменений кожи и слизистых оболочек. Иногда в области пузырьков некоторое время сохраняется гиперемия и пигментация [1, 6].
Больные с генитальным герпесом нередко жалуются на плохое общее самочувствие, быструю утомляемость, головные боли, бессонницу, субфебрильную температуру. Эти симптомы максимально выражены в продроме и в первые два дня после появления элементов поражений, и постепенно ослабевают в течение первой недели заболевания.
Средняя продолжительность активного выделения ВПГ из шейки матки и уретры — 5–6 дней от момента появления элементов поражения. В то же время следует иметь в виду, что выделение вируса может происходить достаточно длительно и при отсутствии видимых изменений слизистой оболочки.
Рецидивирующий герпес характеризуется длительным и упорным течением. Постоянные обострения процесса чередуются с периодами ремиссии различной продолжительности. Обострение рецидивирующего герпеса происходит после различного рода внешних воздействий или снижения защитных сил организма.
Частота рецидивов и продолжительность ремиссий весьма вариабельна: от одного раза в два-три года до ежемесячных обострений.
Клиническая картина при рецидивирующем генитальном герпесе напоминает вариант острого его течения. При рецидивах обычно слабее, чем при первичной острой инфекции, выражены экссудативные процессы, более длительно протекает заживление [1, 5, 6].
Многолетнее течение генитального герпеса может обусловить возникновение стойких локальных изменений в виде гиперпигментации кожи и слизистых оболочек. Частые рецидивы генитального герпеса, сопровождающиеся зудом, чувством жжения, болями, наиболее тяжело переносятся больными и нередко приводят к развитию невротических состояний. В зависимости от локализации генитальной герпетической инфекции выделяют следующие уровни герпетического поражения органов малого таза:
Клинические проявления герпетических поражений внутренних половых органов не имеют специфических особенностей по сравнению с воспалительными процессами невирусной этиологии. Больные отмечают боль и чувство тяжести внизу живота и в крестце, умеренные серозные выделения из половых путей. Как первичный, так и рецидивирующий генитальный герпес могут сочетаться с другими видами герпетической инфекции. Однако первичная инфекция во время беременности представляет большую угрозу для жизни самой женщины и плода, поскольку возрастает риск диссеминации ВПГ и развития герпетического энцефалита, гепатита.
Наиболее тяжело протекает генерализованная форма герпетической инфекции, характеризующаяся множественным поражением органов и систем организма.
Анализ наблюдений свидетельствует о том, что генерализованная герпетическая инфекция у женщин развивается преимущественно в III триместре беременности и почти всегда ассоциируется с первичным заражением вирусом простого герпеса. Генерализация инфекции происходит постепенно. Первыми вовлекаются в патологический процесс половые органы, влагалище и шейка матки, являющиеся входными воротами инфекции. В 1/3 случаев первичный очаг локализуется на губах, в полости рта, гортани, иногда на коже [1, 3].
От момента первичного заражения или peaктивации латентной герпетической инфекции до генерализации проходит от одного-двух дней до недели и более. Такая вариабельность сопоставима с основными этапами патогенеза ВПГ-инфекции: миграцией вируса, вирусемией различной продолжительности и интенсивности, поражением кожи или слизистой оболочки. Клиническая картина генерализованного герпеса характеризуется бурным и полиморфным течением. Однако четко можно выделить выраженные симптомы общей интоксикации: лихорадку, озноб, мышечные боли, общую слабость.
Почти всегда первой поражается печень. Развивающийся гепатит (в 80–90% случаев), по-видимому, характеризует классическое течение генерализованного герпеса и требует внимательного отношения при проведении дифференциального диагноза с вирусными гепатитами, холециститом и поражением печени на фоне нефропатии. Редко выявляются клинические признаки миокардита, панкреатита, энцефалита, нефрита [13, 18, 21].
Часто генерализованная герпетическая инфекция во время беременности сопровождается умеренной лейкопенией на фоне нейтрофилеза, тромбоцитопенией, повышением уровня ферментов печени. При отсутствии специфической терапии летальность очень высока (до 70 – 85%).
Герпетическая инфекция у новорожденного может быть проявлением как внутриутробного (врожденная), так и перинатального (интра- и постнатального) инфицирования. В результате анте-, интра- или постнатального инфицирования может развиться генерализованная или локальная форма заболевания, проявляющиеся симптомами поражения ЦНС, глаз, кожи, ротовой полости. Врожденная герпетическая инфекция характеризуется широким полиморфизмом и выявляется при рождении либо в первые 24 – 48 ч жизни новорожденного.
Инкубационный период герпетической инфекции, приобретенной новорожденным во время или после родов, колеблется от 2 до 30 дней [1, 12].
Локализованные поражения кожи, слизистой оболочки глаз или полости рта обычно проявляются на 10 – 11-е сутки после рождения и составляют 20 – 30% всех форм манифестации герпетической инфекции у новорожденных. При локализованной форме болезни имеются единичные или сгруппированные везикулярные высыпания, располагающиеся чаще на коже лица и конечностей. Везикулы быстро вскрываются, и образуются мелкие эрозии. Кроме везикулярных повреждений, может быть пятнистая эритема. Иногда наблюдается повторное появление свежих высыпаний.
Кожные проявления герпетической инфекции у новорожденных обычно протекают благоприятно, однако в ряде случаев (до 20%) наблюдаются неврологические нарушения. При этом клинические признаки поражения ЦНС отчетливо выявляются в более поздние сроки. Поражения глаз проявляются кератоконъюнктивитом и хориоретинитом. Герпетические проявления инфекции в полости рта у недоношенных наблюдаются в три раза чаще, чем у новорожденных, родившихся в срок. При этом в большинстве случаев характерным является поражение слизистой оболочки неба в виде участков поверхностного некроза эпителия, которые преимущественно локализуются на границе твердого и мягкого неба, симметрично с обеих сторон, реже – на небных дужках. Инкубационный период заболевания колеблется от 2 до 12 дней. У некоторых детей герпес в полости рта может проявляться в более поздние сроки — от 10 до 30 дней [8, 19, 22].
Элементы поражения могут локализоваться также на слизистой оболочке десен, на красной кайме губ, на небных дужках, крайне редко — на языке в виде единичных везикулярных высыпаний. Эрозии эпителизируются на слизистой оболочке полости рта на 4 – 8-й день от начала их появления. Температурная реакция, как правило, отсутствует, редко имеет место субфебрильная температура.
Локализованные поражения ЦНС встречаются у 30 – 35% новорожденных, проявляются в основном в 15 – 17-дневном возрасте и характеризуются более высокой летальностью – до 50 – 70%. Сочетание симптомов поражения герпетической инфекцией ЦНС с локализованными формами является неблагоприятным прогностическим признаком.
Особенно тяжело протекает генерализованная герпетическая инфекция у недоношенных детей. Летальность достигает 80 – 95%. При этой форме заболевания выявляются повреждения практически в каждом органе ребенка, однако наиболее выражены они в головном мозге, печени, легких, надпочечниках. Примерно у 60 – 70% детей генерализованная инфекция характеризуется поражением ЦНС.
При анализе клинической картины генерализованной герпетической инфекции и локализованного поражения ЦНС у новорожденных необходимо учитывать тот факт, что 20% из них могут не иметь никаких признаков поражения кожи, а это в значительной степени затрудняет диагностику заболевания.
Таким образом, у беременных с герпетической инфекцией должен быть предусмотрен комплекс диагностических, профилактических и лечебных мероприятий, направленных на исключение или уменьшение случаев возникновения врожденной внутриутробной инфекции, что должно быть обязательным условием создания эффективной системы профилактики и охраны здоровья матери и ребенка.
Роль герпесвирусов при мужском бесплодии
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Поиск этиопатогенетических факторов бесплодия является актуальной медико-социальной задачей. Наблюдали 23 мужчин с абактериальным хроническим простатитом, состоящих в бесплодном браке. Герпесвирусы 4–6 типов были выявлены в урогенитальных образцах (мазки из уретры, эякулят, секрет предстательной железы) у 8 из 23 мужчин, которым проводили лечение валацикловиром 500 мг 2 р/сут 3 мес. и препаратом интерферона α-2b в комплексе с антиоксидантами (витаминами Е и С) в форме ректальных суппозиториев. Исходя из личного опыта авторов, пациентам была назначена следующая схема использования препарата: 3 млн МЕ 2 раза в день — 10 дней, затем 3 раза в неделю (также 2 раза в день) в течение последующих 3 нед. Остальным 15 пациентам, у которых вирусы не были обнаружены, проводили лечение: левофлоксацин 500 мг — 30 дней, тамсулозин 0,4 мг — 90 дней, диклофенак свечи 50 мг — 10 дней. К концу терапии электронно-микроскопическое и вирусологическое исследования показали снижение концентрации и числа вирус-положительных урогенитальных проб, а также снижение числа сперматозоидов с вирусными капсидами. В течение 6 мес. от начала терапии наблюдали наступление беременности у супруг 6 из 8 мужчин с герпесвирусами и у 4 из 11 мужчин без вирусов (р=0,026). Таким образом, получены данные о роли герпесвирусов 4–6 типов при мужском бесплодии. Достигнут хороший репродуктивный эффект терапии валацикловиром и препаратом интерферона α-2b в комплексе с антиоксидантами у большинства пациентов.
Ключевые слова: герпесвирусы, вирус Эпштейна — Барр, цитомегаловирус, вирус герпеса человека 6 типа, мужское бесплодие.
Для цитирования: Ковалык В.П., Гомберг М.А., Брагина Е.Е. и др. Роль герпесвирусов при мужском бесплодии. РМЖ. Медицинское обозрение. 2021;5(3):123-129. DOI: 10.32364/2587-6821-2021-5-3-123-129.
1 Federal Research and Clinical Center of the Federal Medical Biological Agency,
Moscow, Russian Federation
2 Moscow Scientific and Practical Center of Dermatovenereology and Cosmetology,
Moscow, Russian Federation
3 A.N. Belozersky Research Instituteof Physico-Chemical Biology MSU, Moscow,
Russian Federation
4 National Research Center for Epidemiology and Microbiology named after Honorary
Academician N.F. Gamaleya, Moscow, Russian Federation
Nowadays, the search for etiopathogenetic factors of infertility is an urgent medical and social task. 23 men with chronic abacterial prostatitis in a barren marriage underwent the follow-up. Herpesviruses of types IV–VI were detected in urogenital samples (urethra, ejaculate, prostate secretions) in 8 of 23 men who were treated with valacyclovir (500 mg 2 times a day for 3 months) and interferon α-2b in combination with antioxidants — vitamins E and C (rectal suppositories). Based on the personal experience of the authors, the patients were prescribed the following drug use regimen: 3 million IU twice a day — 10 days, then 3 million IU twice a day — 3 times per week for the next 3 weeks. The remaining 15 patients without any detected viruses were prescribed the following: levofloxacin 500 mg — 30 days, tamsulosin 0.4 mg — 90 days, diclofenac 50 mg — 10 days. By the end of therapy, electron microscopy and virology showed a decrease in the concentration and number of virus-positive urogenital samples, as well as a decrease in the number of spermatozoa with viral capsids. Within 6 months from the therapy initiation, the onset of pregnancy was observed in the married couples of 6 out of 8 men with herpesviruses vs. in 4 out of 11 without viruses (p=0.026). Thus, we obtained the data on the role of herpesviruses of types IV–VI in male infertility. A good reproductive effect was achieved with valacyclovir and interferon α-2b in combination with antioxidants in most patients.
Keywords: herpesviruses, Epstein-Barr virus, cytomegalovirus, human herpes virus type VI, male infertility.
For citation: Kovalyk V.P., Gomberg M.A., Bragina E.E. et al. Herpesvirus role in male infertility. Russian Medical Inquiry. 2021;5(3):123–129. DOI: 10.32364/2587-6821-2021-5-3-123-129.
Введение
Бесплодие является актуальной медицинской и социальной проблемой. В России каждая пятая семейная пара бесплодна [1]. При этом мужской фактор отвечает за половину из этих случаев. Это связано с прогрессивным снижением репродуктивной функции. Существуют многочисленные данные о негативном влиянии вирусов на состояние репродуктивной системы мужчин. В человеческой популяции широко распространены вирусы герпеса человека (ВГЧ) [2].
Герпесвирусы вызывают пожизненное инфицирование и являются причиной множества заболеваний, половина из которых имеет рецидивирующее течение. ВГЧ инфицированы от 95% до 100% населения, а в разные периоды жизни человек инфицируется хотя бы одним, а чаще — несколькими типами вирусов, относящимися к семейству герпесвирусов. Во второй половине жизни практически все люди имеют антитела к большинству ВГЧ [3]. 8 типов герпесвирусов патогенны для человека.
Типы вирусов герпеса человека
ВГЧ 3 типа — Varicella-zoster virus, вирус варицелла зостер (ВВЗ) — открыт в 1911 г. Н. Aragao и представляет собой ДНК-содержащий вирус. Является возбудителем ветряной оспы и опоясывающего лишая, может поражать кожу, слизистые оболочки, эндотелий сосудов, клетки крови, печень, центральную и периферическую нервную систему.
ВГЧ 4 типа — вирус Эпштейна — Барр (ВЭБ) был выделен в 1964 г. Эпштейном и Барр. ВЭБ обладает тропизмом в основном к В-лимфоцитам, эпителию верхних дыхательных путей и эпителию ЖКТ. Может выступать этиологическим агентом при инфекционном мононуклеозе и лимфоме Беркитта.
ВГЧ 5 типа — цитомегаловирус (ЦМВ) был выделен в 1956 г. М.G. Smith, содержит двухспиральную ДНК, окруженную гликопротеиновой оболочкой. Может поражать практически любые клетки организма человека, вызывая широкий спектр заболеваний.
ВГЧ 6 типа (розеоловирус) был идентифицирован в 1986 г., ассоциирован с внезапной экзантемой и фебрильными судорогами у детей.
ВГЧ 7 типа (розеоловирус) был выделен в 1990 г. из CD4 + Т-лимфоцитов периферической крови. Вирус связывают с различными заболеваниями ЦНС и кожи аутоиммунной природы.
ВГЧ 8 типа ассоциирован с саркомой Капоши и был открыт в 1994 г., является новым трансформирующим вирусом человека, который способствует злокачественному перерождению клеток.
Вирусы простого герпеса 1 и 2 типа и вирус варицелла зостер
ВПГ поражают кожу и слизистые, являясь основной причиной генитальных язв. ВПГ 1 и 2 типов часто выявляют в спермоплазме, на поверхности и внутри сперматозоидов [5].
Снижение концентрации нейтральной α-глюкозидазы и цитрата свидетельствует, что бесплодие возникает вследствие нарушения функции придатка яичка и простаты под воздействием ВПГ.
В ряде исследований оценивалась распространенность ЦМВ. Так, во многих странах в образцах спермы человека этот показатель составил от 0% до 62,5% [11].
ЦМВ входит в семейство ВГЧ, может быть причиной разнообразных тератогенных повреждений у новорожденных и клинических случаев болезни у взрослых по типу инфекционного мононуклеоза. Его наличие и персистенцию в сперме описывали в различных исследованиях [9, 12–14]. ЦМВ вызывает асимптомную инфекцию у здоровых лиц, в т. ч. инфекцию урогенитального тракта. Подобно всем вирусам герпеса, ЦМВ имеет свойство реактивироваться и вызывать хроническое воспаление [15, 16].
Содержание ЦМВ в эякуляте здоровых доноров обычно колеблется в пределах 3–5%, в эякуляте пациентов с бесплодием — от 1,4% до 56,5% [11].
В проведенном М. Habibi et al. скрининге эякулятов пациентов с инфекционным воспалением предстательной железы методом ПЦР установлено, что ЦМВ чаще встречается у инфертильных мужчин с хроническими воспалительными заболеваниями мочеполовой системы, причем ДНК ЦМВ ассоциирована с клеточной фракцией эякулята. Распространенность вирусной ДНК составила 3,4% для ВЭБ, 5,2% — для ЦМВ, 6,5% — для ВГЧ-6, 0,43% — для ВЭБ + ЦМВ, 0,87% — для ВЭБ + ВГЧ-6, 1,3% — для ЦМВ + ВГЧ-6. Выявление ЦМВ было значительно чаще в группе пациентов с бесплодием и ассоциировалось со снижением количества сперматозоидов. Полученные результаты свидетельствуют о том, что как ЦМВ, так и ВГЧ-6 могут способствовать развитию инфекционного воспаления предстательной железы и мужскому бесплодию [9].
Концентрация ЦМВ в сперме может варьировать от 110 до 12 млн. При этом возможна тенденция к снижению подвижности сперматозоидов и концентрации нейтральной α-глюкозидазы — маркера повреждения придатка яичка. Таким образом, ЦМВ может иметь влияние на качество спермы вследствие поражения придатка яичка [17, 18].
Более убедительные результаты получены в работе М. Mohseni et al. В этом исследовании определяли частоту обнаружения ЦМВ с помощью real-time ПЦР у 100 бесплодных мужчин, которые обратились в клинику экстракорпорального оплодотворения с низкими показателями подвижности (менее 40%) или концентрации сперматозоидов (менее 15 млн/мл), анамнезом бесплодия более 5 лет, при этом их жены были здоровы и без видимых причин бесплодия. В контрольную группу вошли 100 здоровых доноров спермы. Частота выявления ЦМВ в исследуемой группе оказалась 23%, в группе контроля — 7%, разница достоверно значима (р 5 копий/мл. Прямой метод диагностики хромосомной интеграции — флуоресцентная гибридизация in situ — малодоступен и трудоемок. Косвенное подтверждение такого состояния возможно с помощью детекции ВГЧ-6 в луковицах волос и ногтях, т. е. в пробах, в которых ВГЧ-6 обычно не обнаруживается [25]. Генетическая интеграция вируса происходит в концевых участках хромосом — теломерах, что крайне настораживает в отношении влияния на клеточное деление и апоптоз. Интегрированный вирус передается потомкам по законам Менделя, т. е. половина детей наследует хромосомную интеграцию ВГЧ-6 [26].
Влияние ВГЧ-6 на репродуктивную функцию изучали в нескольких исследованиях. Так, в работе V. Evdokimov et al. (2016) ВГЧ-6 был достоверно более часто ассоциирован с инфекциями вспомогательных половых желез у мужчин (19% против 6,3% в контрольной группе) [27]. В данном исследовании медианная концентрация ВГЧ-6 составляла всего 250 копий/мл, таким образом, при хромосомной интеграции ВГЧ-6, когда вирусная нагрузка измеряется миллионами копий на миллилитр, можно ожидать значительных нарушений параметров спермы [28].
Как мы видим, в литературе нет однозначного мнения о влиянии ВГЧ на сперматозоиды, и некоторые исследователи не могут установить связь между наличием вирусов в эякуляте и ухудшением показателей спермограммы, другие отмечают снижение концентрации и подвижности сперматозоидов в эякулятах, положительных на ВГЧ [11, 29].
Возможно, имеют место разные варианты инфицирования сперматозоидов вирусом. В первом варианте развития событий уже зрелые гаметы инфицируются ВГЧ при их прохождении по половым путям. Во втором возможно инфицирование на стадии созревания сперматозоидов, при котором повреждающее воздействие вирусов будет более значимым [11].
Таким образом, имеются важные свидетельства влияния различных ВГЧ на качество спермы и достоверные ассоциации этих вирусов как этиологического фактора в развитии инфекций добавочных половых желез, приводящих к бесплодию у мужчин. Тем не менее требуются дальнейшие исследования в этом направлении для определения точных механизмов патогенеза вирусных инфекций в качестве этиологических агентов инфекций вспомогательных половых желез и бесплодия у мужчин.
Собственные результаты
Нами было проведено исследование, в которое были включены 287 мужчин с хроническим простатитом / синдромом хронической тазовой боли IIIA, у 23 из которых имелось бесплодие. Диагнозы верифицировали согласно критериям Европейской урологической ассоциации [30].
Помимо стандартных диагностических процедур проводили детекцию ВГЧ 4–6 типов в пробах из уретры, секрета предстательной железы и эякулята.
При выявлении ВГЧ пациентам с бесплодием (группа 1) назначали валацикловир 1000 мг/сут в течение 3 мес. и препарат ВИФЕРОН ® (интерферон α-2b в комплексе с антиоксидантами (витаминами Е и С)) в форме ректальных суппозиториев. Исходя из личного опыта авторов, пациентам была назначена следующая схема использования препарата: 3 млн МЕ 2 раза в день — 10 дней, затем 3 раза в неделю (также 2 раза в день) в течение последующих 3 нед. Контроль вирусной нагрузки проводили к концу 3-месячного лечения. Остальным пациентам, у которых не было обнаружено ВГЧ 4–6 типов (группа II), назначали левофлоксацин 500 мг на 30 дней, тамсулозин 0,4 мг — на 3 мес., суппозитории диклофенак 50 мг — на 10 дней.
Помимо ациклического нуклеозида, обладающего прямым антигерпетическим действием и назначаемого при терапии абактериального простатита, ассоциированного с герпесвирусами, был выбран ВИФЕРОН ® как препарат, способный обеспечить долгосрочный антивирусный эффект. Препарат содержит интерферон α-2b, это человеческий рекомбинантный аналог вещества, вырабатываемого в любых клетках организма. Он обладает противовирусными, иммуномодулирующими, антипролиферативными свойствами, подавляет репликацию РНК- и ДНК-содержащих вирусов. Интерферон α-2b в клетках запускает последовательность реакций, приводящих к супрессии синтеза вирусных белков, сборки и выхода вирионов в межклеточный матрикс. Помимо влияния на протеиновый синтез, интерфероны обладают эпигенетической активностью, активируя сотни генов, играющих важную роль в антивирусной защите клетки [31]. Кроме того, интерферон α-2b лимитирует распространение вирусных частиц путем активации так называемого «стража генома» — белка p53, что ведет к апоптотической смерти инфицированной клетки [32]. Аскорбиновая кислота и α-токоферола ацетат, входящие в состав препарата, являются высокоактивными антиоксидантами, обладают противовоспалительным, мембраностабилизирующим, а также регенерирующим свойствами.
У 11 пациентов с выявленными герпесвирусами проводили электронно-микроскопическое исследование сперматозоидов (JEM 1400, JEOL, Япония).
Нами было отмечено, что из 103 пациентов с обнаруженными ВГЧ 4–6 типов у 8 имелось бесплодие (группа I), в то время как среди 184 пациентов без герпесвирусов инфертильность была верифицирована у 15 (группа II).
Из 24 урогенитальных проб от 8 пациентов группы I было получено 12 вирус-положительных проб: 7 — эякулят, 1 — мазки из уретры, 4 — секрет предстательной железы. ЦМВ и ВЭБ обнаружены в 4 и 3 образцах соответственно, включая образцы с сочетаниями 2 ВГЧ. Значительно чаще встречался ВГЧ-6 — суммарно в 7 образцах из всех 12. Медианная вирусная нагрузка герпесвирусов 4–6 типов составила 1770 копий на 100 000 клеток.
В результате противовирусного лечения к концу 3-го месяца контрольные исследования обнаружили вирус только у 5 из 8 пациентов группы I, у которых выявляли герпесвирусы в 5 биопробах. При этом медианная вирусная нагрузка в них снизилась до 48 копий на 100 000 клеток.
В результате терапии в течение 6 мес. после окончания лечения наблюдали наступление беременности у супруг 10 из 23 мужчин, которые распределились по группам следующим образом: 6 из 8 из группы I и 4 из 10 из группы II. Статистический анализ показал, что различия в частоте наступления беременности достигают достоверной значимости между группами I и II (значение критерия χ 2 составляет 4,960, критическое значение χ 2 при уровне значимости p=0,05 составляет 3,841, уровень значимости р=0,026).
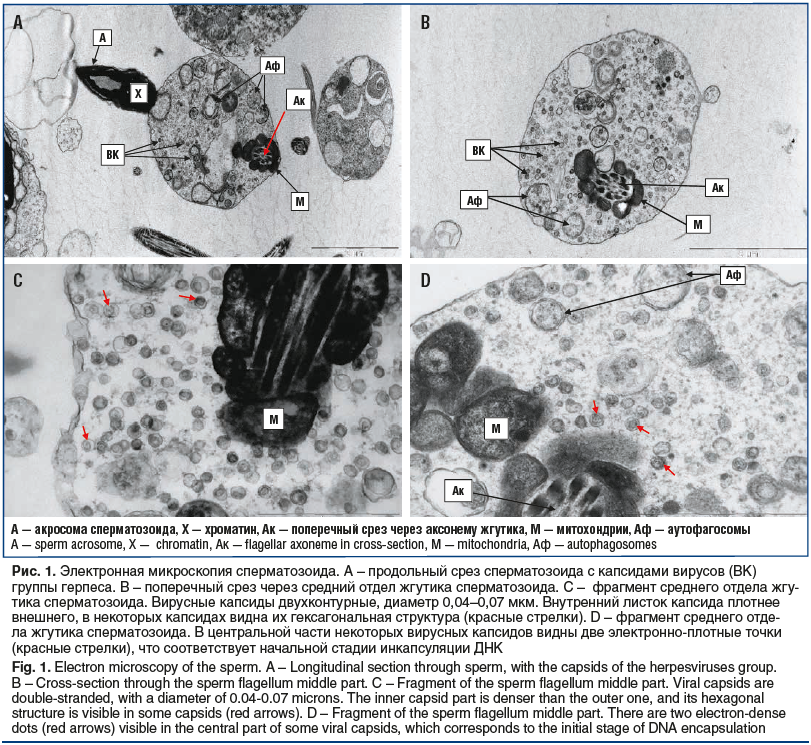
Влияние курса противовирусной терапии оценивали также методом электронной микроскопии. Изучение сперматозоидов 11 пациентов с бесплодием показало, что если до лечения капсиды ВГЧ 4–6 типов обнаруживали у 8 пациентов, то после лечения у 4 из этих пациентов вирусные капсиды в сперматозоидах более не выявляли, а у 3 других пациентов количество сперматозоидов с капсидами в среднем уменьшилось более чем в 2 раза: с 12% до 5% инфицированных гамет в эякуляте (рис. 1).
Обсуждение
Лечение бесплодия не являлось главной целью для 23 мужчин этого исследования. Они обратились по поводу хронического простатита / синдрома хронической тазовой боли и получили хороший терапевтический ответ в виде снижения баллов по шкале NIH-CPSI, что было нами ранее описано [33]. Тем не менее на примере этих 23 пациентов удалось проследить улучшение их репродуктивного потенциала в результате терапии. Достоверно чаще беременность наступала у женщин, чьи мужчины были инфицированы ВГЧ 4–6 типов и получили противовирусную терапию.
Впервые концентрация вируса нами была представлена в количестве копий на единицу клеток, что позволяет сравнить вирусные концентрации у пациентов с различным содержанием сперматозоидов. При этом показано, что применение противовирусных препаратов привело к прекращению активности вирусов у всех пациентов: ВЭБ, ЦМВ и ВГЧ-6 либо не обнаруживали, либо их титры были незначительными ( Литература
Только для зарегистрированных пользователей