можно ли иметь детей без яичников
Прорыв в лечении бесплодия
Прорыв в лечении бесплодия
Овуляция и дальнейшее оплодотворение возможны при наличии в яичниках женщины абсолютно жизнеспособных фолликулов
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Процент женщин, лишенных радости материнства, с каждым годом возрастает. Среди причин бесплодия всё чаще выделяют первичную недостаточность яичников (ПНЯ). Данная патология заключается в отсутствии фолликулов или нарушении их созревания в ответ на гормональную стимуляцию. Решение проблемы эндокринного бесплодия вследствие синдрома истощения яичников предложили ученые из США и Японии. Им удалось активировать фолликулы яичников в условиях in vitro и имплантировать фрагменты ткани в верхний отдел фаллопиевых труб, что дает женщине шанс стать матерью.
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Лучшее новостное сообщение».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Корни проблемы
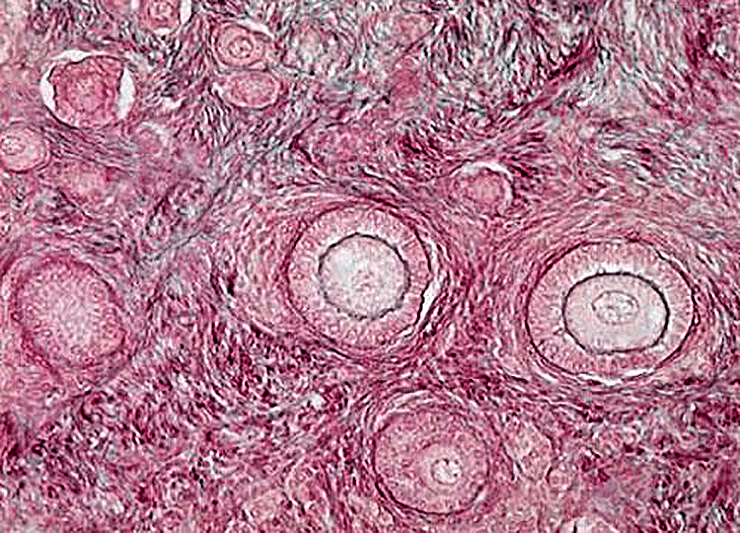
Яичник — уникальная эндокринная система, в которой ежемесячно возникает новая секреторная структура — граафов фолликул (рис. 1). Он развивается из микроскопического примордиального фолликула, потенциальная функциональность которого и определяет регулярность менструального цикла женщины.
Рисунок 1. Фолликулы яичников
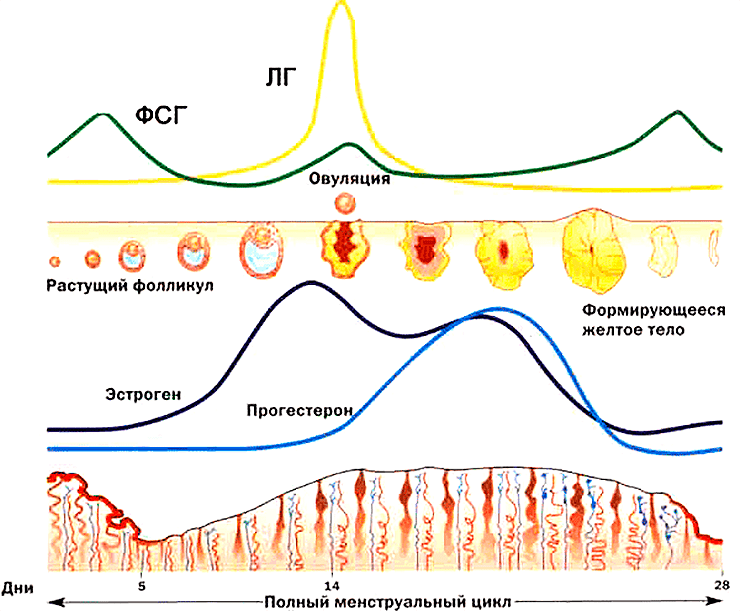
Функция яичников регулируется двумя гормонами гипофиза: фолликулостимулирующим гормоном (ФСГ) и лютеинизирующим гормоном (ЛГ) (рис. 2). В свою очередь, яичники продуцируют гормоны, регулирующие секрецию ФСГ и ЛГ по принципу отрицательной обратной связи: эстрогены, ингибины и прогестерон [1].
Рисунок 2. ФСГ стимулирует рост и созревание фолликула в яичнике. ЛГ стимулирует выход созревшей яйцеклетки из фолликула (овуляцию).
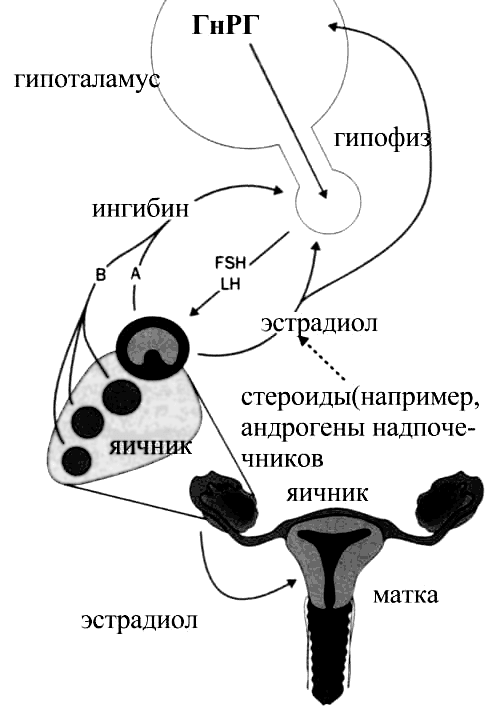
При недостаточности функции яичников для поддержания снижающейся концентрации яичниковых гормонов происходит резкое повышение секреции гонадотропинов. За их выработку отвечает гипоталамус (рис. 3).
Рисунок 3. Связь функционирования яичников с эндокринной системой
Причины, приводящие к развитию первичной недостаточности яичников (ПНЯ), весьма гетерогенны: генетические, ферментативные, аутоиммунные, инфекционно-токсические, психогенные. Кроме того, в эту группу относят и дефекты в структуре гонадотропинов. В последние годы большое внимание исследователей уделяется молекулярно-генетическим аспектам этой патологии яичников, поскольку выявлен определенный набор генов, который может отвечать за развитие ПНЯ.
Стоит отметить, что термин «первичная недостаточность яичников» в настоящее время применяется для определения состояния, которое ранее называли «преждевременной менопаузой». Ключевое различие заключается в том, что термин «ПНЯ», предложенный еще в 1942 году, характеризует нарушение функции яичников в динамике, а не конечное состояние, что наблюдается при менопаузе [1].
Диагностика
Яичниковая недостаточность диагностируется по повышенному уровню ФСГ и ЛГ в крови при сниженном уровне эстрогенов. Самый чувствительный гормон — ФСГ; он является самым ранним маркером преждевременного старения яичников. При двукратном превышении уровня ФСГ (20 Ед/л) наступление и благополучный исход беременности маловероятны.
Клинические характеристики состояния: аменорея (отсутствие менструации) ≥4 месяцев у женщин моложе 40 лет, бесплодие и повышение уровня ФСГ до менопаузальных значений (дважды с промежутком не менее 1 месяца).
Частота спонтанной недостаточности яичников у женщин с хромосомным набором 46 ХХ составляет около 1%; при этом эпидемиологические исследования указывают на тесную связь данного нарушения с возрастом. Так, у женщин в возрасте до 20 лет ПНЯ встречается с частотой 1:10000, а в возрасте от 30 до 40 — 1:1000.
Что происходит на гормональном уровне
Один из половых гормонов — 17β-эстрадиол (рис. 4), который играет важную роль в выполнении репродуктивной функции женщины, — вырабатывается преимущественно в яичниках из мужских половых гормонов — андростендиона и тестостерона [2]; небольшое количество этого гормона также вырабатывается надпочечниками. В процессе угасания функций яичников количество растущих фолликулов в них уменьшается, что приводит к значительному понижению выработки 17β-эстрадиола. Поэтому у женщин с так называемым синдромом истощения яичников наблюдается нехватка этого гормона, которая частично компенсируется большей выработкой 17β-эстрадиола в надпочечниках. Так как менструации становятся нерегулярными, уровень 17β-эстрадиола начинает колебаться, и с прекращением менструаций резко понижается, что приводит к повышению фолликулостимулирующего гормона (ФСГ).
Рисунок 4. β-эстрадиол (кристаллы). Поляризация LM X100.
Механизм активации незрелых фолликулов
Для женщин, страдающих бесплодием по причине рассмотренного заболевания, существует единственная возможность материнства — имплантация оплодотворенной донорской яйцеклетки. Однако группа специалистов из Стэнфордского университета (США) и Медицинского факультета Университета им. Святой Марианны (Япония) предложили альтернативу — метод, позволяющий исключить известные хирургические вмешательства для стимуляции овуляции, такие как клиновидная резекция яичников или лазерное сверление. Врачи удалили яичники у участниц исследования, поделили их на несколько частей, а затем воздействовали на фрагменты яичников препаратами, стимулирующими рост. Спустя несколько дней некоторые из фрагментов ткани были имплантированы в фаллопиевы трубы женщин. Затем специалисты наблюдали за развитием фолликулов. У некоторых участниц исследования сформировались зрелые яйцеклетки, что позволило провести им стандартную процедуру экстракорпорального оплодотворения (ЭКО [3]). Результаты исследования опубликованы в журнале Proceedings of the National Academy of Sciences [4].
Важно отметить, что возможность провести подобное лечение возникла благодаря изучению сигнального клеточного пути под названием Hippo [5], который представляет собой один из ключевых компонентов регуляции таких важных процессов, как контактное ингибирование роста клеток и связанного с ним контроля размера внутренних органов [6]. Первоначально белковый комплекс Hippo был открыт у дрозофил. Мухи, у которых его функционирование было нарушено, буквально увеличивались в размерах (из-за чего регулятор и получил своё название: «Hippo» происходит от слова «гиппопотам»). Затем его обнаружили и у млекопитающих.
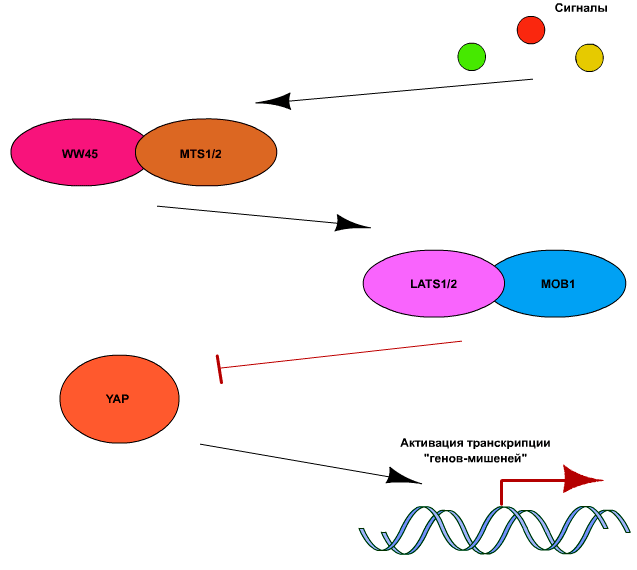
Ключевым компонентом пути Hippo является киназа Yap (Yes-activated protein), которая в активном состоянии способна связывать ряд факторов транскрипции, таких как p73, p53-binding protein-2 (p53BP2), RUNX2, SMAD7, ERBB4, PEBP2а и TEAD/ТЕF [7]. Регуляция активности YAP осуществляется в основном за счет ингибирующего действия киназ LATS1 и 2 (large tumor supressor-1 и −2). Они, в свою очередь, активируются киназами МSТ1 и МSТ2 (mammalian sterile-20-like kinases). Для полной активации LATS и МSТ необходимо также, чтобы они были связаны с адапторными белками WW45 и МОB1, соответственно. Вышеописанная часть сигнального пути Hippo является высококонсервативной у млекопитающих, в то время как сигналы активации или ингибирования LATS и МSТ могут быть достаточно разнообразными. В общих чертах сигнальный путь Hippo представлен на рис. 5.
Рисунок 5. Схематичное изображение работы сигнального белкового регулятора Hippo
Развитие эмбриона, деление эмбриональных клеток и рост тканей и органов эволюционно контролируются работой различных регуляторов. По словам одного из авторов исследования Арона Сюэ (Aaron Hsueh) — акушера-гинеколога из Стэнфордского Университета в Калифорнии — у женщин с синдромом истощения яичников наблюдается повышенная активность регулятора Hippo [8]. Другими словами, он блокирует созревание практически всех фолликулов яичника, что минимизирует возможность наступления овуляции и дальнейшего оплодотворения.
Ученые нарушили работу сигнального пути Hippo в удаленных яичниках и, таким образом, предотвратили преждевременную остановку развития фолликулов. Далее специалисты стимулировали активность другого сигнального пути, называемого Akt, что способствовало ускорению роста фолликулов [9], [10].
Клинические исследования проводились сначала на лабораторных животных. На следующем этапе в эксперименте согласились принять участие 27 женщин, страдающих от первичной дисфункции яичников. В ходе исследования выяснилось, что у некоторых женщин в яичниках не было фолликулов. В яичниках 13 пациенток обнаружили незрелые фолликулы; из них у восьми женщин применение нового метода лечения способствовало росту жизнеспособных фолликулов. Для 14 женщин лечение оказалось неэффективным.
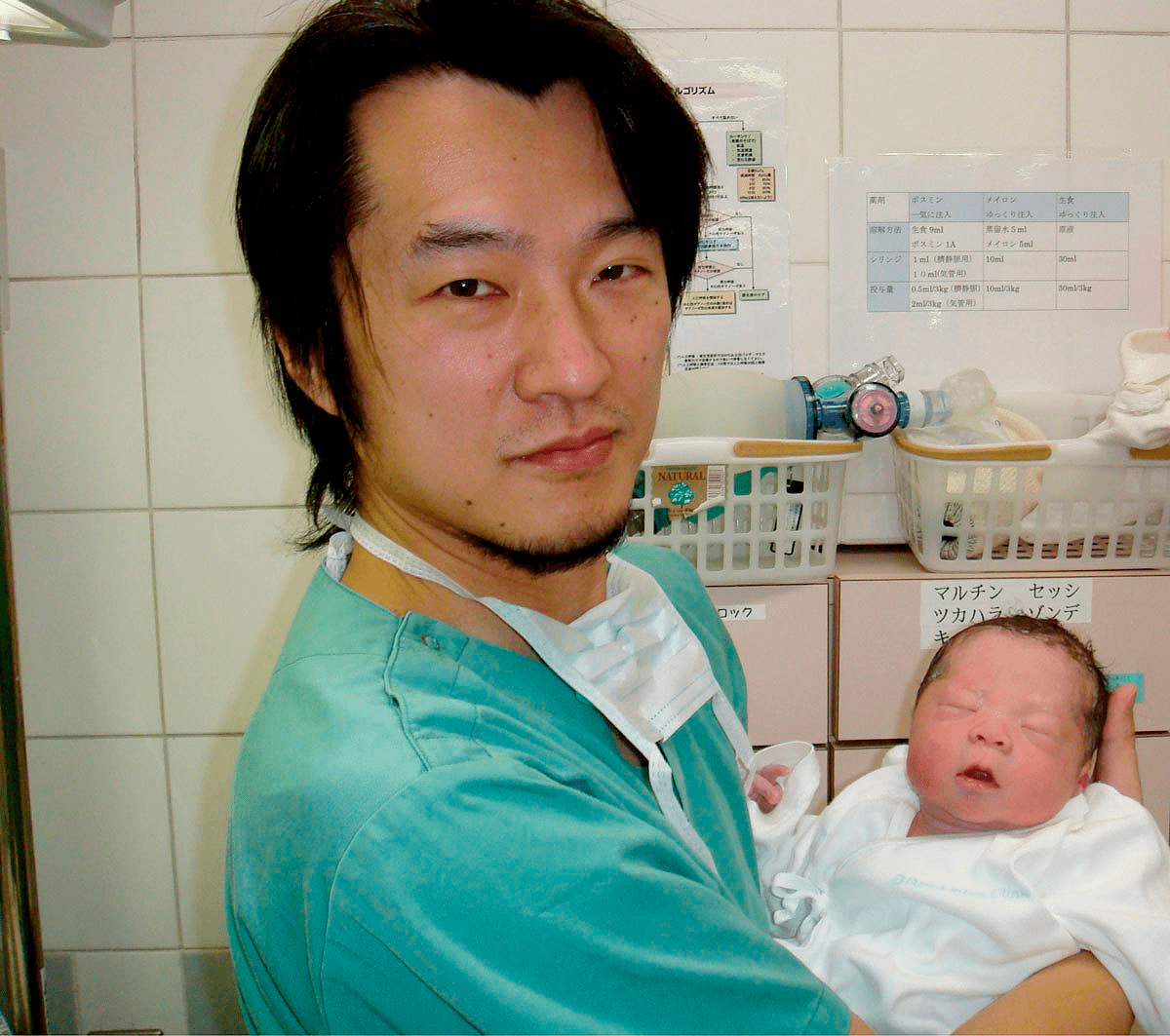
В результате зрелые яйцеклетки были получены у пяти женщин и использованы для ЭКО. Одна из пациенток в возрасте 29 лет во время курса лечения на 37 неделе беременности родила ребенка весом 3,3 кг (рис. 6). Научная группа надеется, что эффективность нового метода лечения достигнет 30%. И, более того, по их словам, этот метод может также помочь женщинам, перенесшим лучевую или химиотерапию, и пациенткам в возрасте лет с нерегулярным менструальным циклом [11].
Рисунок 6. Казухиро Кавамура (Kazuhiro Kawamura) — один из ученых, участвовавший в исследовании — держит на руках новорожденного мальчика, которого родила первоначально бесплодная женщина
Мнения и прогнозы
По мнению Марчелле Цедарса (Marcelle Cedars) — специалиста в области репродуктивной онкологии из Университета Калифорнии в Сан-Франциско — исследователи поторопились апробировать новый метод лечения бесплодия на человеке: «Ученые продемонстрировали рождение здорового потомства при проведении предварительных исследований на мышах, но не было получено доказательств роста, развития и/или плодовитости этого поколения» [12].
Авторы исследования полагают, что метод подходит бесплодным женщинам среднего возраста, а также тем, кому диагностировали первичную недостаточность яичников, вследствие которой в более чем 50% случаев беременность не наступает. Однако не все эксперты разделяют их оптимизм. Руководитель врачебной группы, изучающей оплодотворение, из Университета Южной Калифорнии Ричард Паульсон (Richard Paulson) убежден, что ключевое условие эффективности разработанного механизма лабораторной «активации» фолликула — наличие в нем здоровой яйцеклетки. Кроме того, Паульсон заостряет внимание на том, что неразумно сопоставлять результаты лечения женщины в возрасте 29 лет с результатами лечения женщины в 40 лет, поскольку гормональная стимуляция роста и развития фолликулов в разные возрастные периоды происходит с различной интенсивностью.
Рассмотренный консервативный метод стимуляции овуляции путем блокировки сигнального пути Hippo в отдельных фрагментах ткани яичников может быть полезен женщинам, больным раком или проходящим процедуры стерилизации. Но все же главное достижение ученых — это рождение ребенка у женщины, которая без их участия никогда не смогла бы стать матерью.
Вторичное бесплодие у женщин
«Год назад нам с мужем захотелось завести второго ребенка. С тех пор мы регулярно занимаемся сексом, не пользуемся никакими средствами контрацепции, но я не могу забеременеть. Не пойму, в чем проблема, ведь первая беременность наступила очень быстро, я ее хорошо выносила, родила здорового малыша. Вроде бы, я пока еще не старая, до менопаузы мне далеко. Что со мной, доктор? Может быть, я заболела чем-то страшным? Есть ли у меня шансы на вторую беременность?»
Врачам-репродуктологам часто приходится сталкиваться с подобными жалобами. По некоторым данным, с этой проблемой к ним обращаются до 40% пациенток.
Данное состояние называется вторичным бесплодием, и оно встречается так же часто, как и первичное – когда женщина ни разу в жизни не смогла забеременеть. У этих состояний практически одинаковые причины, и их лечат одними и теми же методами. В большинстве случаев врачи могут помочь таким женщинам забеременеть. В зависимости от того, какое расстройство вызвало проблему, ее можно лечить препаратами, стимулирующими овуляцию (созревание и выход яйцеклетки их яичника), прибегнуть к хирургическому вмешательству или экстракорпоральному оплодотворению.
Для начала определимся с терминологией.
Вторичное бесплодие – это неспособность женщины зачать или выносить беременность, несмотря на то, что ранее она уже хотя бы один раз смогла забеременеть или родить ребенка. Таким образом, в это понятие входят не только случаи, когда женщина регулярно занималась сексом в течение 6–12 месяцев без контрацепции и не смогла забеременеть, но и беременности, закончившиеся выкидышами или мертворождениями. Важно заметить: предыдущая беременность должна была наступить сама, без медикаментозных препаратов и ЭКО. В противном случае это будет первичное бесплодие.
Почему развивается первичное бесплодие?
Проблемы с количеством и качеством яйцеклеток. Мужской организм производит сперматозоиды регулярно, а вот женские яйцеклетки закладываются еще во время внутриутробного развития один раз на всю жизнь. Со временем их количество уменьшается, новые не образуются, и репродуктивные возможности женщины снижаются. Если женщина родила первого ребенка в 25 лет и обратилась к врачу с проблемой бесплодия после 35, то высока вероятность, что виноват возраст и естественное снижение овариального резерва. Иногда количество пригодных для оплодотворения яйцеклеток уменьшается из-за других причин, например, генетических и аутоиммунных заболеваний, перенесенной лучевой терапии, химиотерапии, операций на репродуктивной системе.
Проблемы со стороны матки становятся причиной женского бесплодия в 15–25% случаев. Существует множество таких состояний. К вторичному бесплодию чаще всего приводят рубцы и спайки после абортов, кесарева сечения, инфекций. Наступлению и вынашиванию беременности могут помешать доброкачественные новообразования: миомы, полипы матки.
Трубное бесплодие связано с нарушением проходимости фаллопиевых труб, по которым яйцеклетка в норме попадает из яичника в полость матки. Чаще всего причиной бесплодия становятся рубцы и спайки, к формированию которых приводят инфекции органов таза, например, хламидиоз, гонорея.
Синдром поликистозных яичников – заболевание, связанное с гормональными нарушениями. При этом в яичниках появляются многочисленные кисты, обычно размером 2–6 мм, в крови повышается содержание мужских гормонов-андрогенов, месячные становятся нерегулярными, длительными или редкими, иногда вообще пропадают. Бесплодие возникает из-за того, что в яичниках нарушается созревание яйцеклеток в результате гормонального дисбаланса.
Эндометриоз – заболевание, при котором ткань слизистой оболочки матки находится в нехарактерных местах, например, на поверхности яичников, брюшины. На ранних стадиях репродуктивная функция женщины может быть в норме, а при тяжелой степени эндометриоза развивается бесплодие.
Избыточная масса тела и ожирение. Жировая ткань – не просто хранилище жира, она вырабатывает биологически активные вещества, которые влияют на обменные процессы в организме, вызывая гормональный дисбаланс. Из-за этого нарушается процесс созревания яйцеклеток, менструальные циклы становятся нерегулярными, и женщина может столкнуться с проблемой бесплодия. Еще в 1997 году в Великобритании было проведено исследование влияния индекса массы тела (ИМТ) на женскую фертильность. В нем приняли участие 5799 женщин в возрасте 33 лет. Когда участницы прекратили применять средства контрацепции, в течение последующих 12 месяцев удалось забеременеть 81,4% женщинам с нормальным весом и только 66,4% женщинам с ожирением. Иногда при ожирении яйцеклетки и вовсе перестают созревать – развивается ановуляция. По статистике, женщины с ИМТ 27 и выше (ИМТ рассчитывается как масса тела в кг, деленная на рост в метрах, возведенный в квадрат) в три раза чаще по сравнению с женщинами с нормальным весом не могут забеременеть из-за того, что у них не происходят овуляции.
Образ жизни. На репродуктивную функцию женщин влияют многие привычки и внешние факторы. Зачастую они накладываются на состояния, описанные выше, но могут мешать наступлению беременности и самостоятельно. К негативным факторам относят курение, частое употребление алкоголя, некоторые диеты, лекарственные препараты, хроническое недосыпание, различные заболевания, воздействие химических соединений или излучения на рабочем месте, хронический стресс.
Иногда точный диагноз не удается установить. В таких случаях диагностируют бесплодие неясного генеза, или идиопатическое бесплодие.
Как разобраться в причинах вторичного бесплодия?
В первую очередь врач, к которому обратилась женщина с подозрением на вторичное бесплодие, должен тщательно собрать анамнез: расспросить пациентку о предыдущих беременностях и родах, состоянии ее менструального цикла, перенесенных заболеваниях, в том числе инфекционных, репродуктивном здоровье ближайших родственниц, образе жизни, вредных привычках, профессии и т. д. В ходе беседы у врача появятся предположения о возможных причинах проблемы, и он назначит необходимые виды диагностики.
Обследование при подозрении на вторичное бесплодие может включать разные процедуры:
Обследование должна пройти не только женщина с подозрением на вторичное бесплодие, но и мужчина, от которого она пытается зачать. Возможно, у него тоже есть нарушения репродуктивной функции, и это может повлиять на выбор методов лечения.
Методы лечения
Методы лечения вторичного бесплодия зависят от заболевания, которое стало его причиной. Если нарушена овуляция, ее можно стимулировать с помощью таких препаратов, как кломифен, летрозол.
При полипах, миомах, спайках, рубцах и других патологиях в полости матки прибегают к гистероскопическим хирургическим вмешательствам. Их выполняют без разрезов на коже с помощью инструментов, введенных через влагалище. При непроходимости маточных труб, эндометриозе и спайках в малом тазу выполняют лапароскопические операции через проколы в брюшной стенке. Для лечения миомы матки в настоящее время широко применяют эмболизацию маточных артерий (ЭМА). Во время этой процедуры в кровеносный сосуд, питающий миому, вводят микроскопические эмболизирующие частицы, в результате чего миоматозный узел перестает получать кислород, погибает и замещается соединительной тканью.
В ряде случаев единственным выходом становится экстракорпоральное оплодотворение. Если женщина не может самостоятельно выносить беременность, врач порекомендует суррогатное материнство. А если у женщины отсутствуют собственные яйцеклетки, можно воспользоваться донорскими.
Иногда женщина заранее знает, что ей грозит бесплодие, например, если у всех ее родственников была ранняя менопауза, если ей предстоит хирургическое удаление яичников, химиотерапия, лучевая терапия. В подобных случаях стоит заблаговременно «застраховать» свою репродуктивную функцию – сохранить яйцеклетки в специализированном банке половых клеток. Если вы проходите ЭКО и планируете в будущем еще родить детей, можно разместить в криобанке неиспользованные эмбрионы. В Репробанке вы сможете сохранить яйцеклетки для себя и использовать их в любое время. А еще у нас есть отличное предложение для молодых женщин до 35 лет: станьте донором яйцеклеток, и часть из них мы сохраним для вас бесплатно.
Остались вопросы?
Всю актуальную и подробную информацию вы можете получить, позвонив по телефону: +7 (499) 653-66-09 или записавшись на консультацию к врачу-консультанту.
Можно ли забеременеть после удаления шейки матки
Удаление шейки матки (трахелэктомия) — операция, которая часто требуется на ранних стадиях рака шейки матки, чтобы не допустить его распространения. Также она может помочь при различных патологиях шейки матки после тяжелых родов, хронических воспалительных процессов, в результате врожденных аномалий или других гинекологических заболеваний.
Некоторые женщины боятся ее, потому что думают, что забеременеть после не получится. Но на самом деле это не так, потому что удаление шейки матки как раз сохраняет возможность иметь детей.
Шансы на успех — 70%
Результаты многих исследований говорят о том, что беременность после удаления шейки матки и части ткани вокруг нее (это необходимо, чтобы снизить риск рецидива) может быть успешной. Обзор 2016 года, в котором суммарно были проанализированы данные 2777 пациенток после лечения рака шейки матки с помощью хирургического вмешательства, показал, что 70% женщин, которые пытались забеременеть после операции, преуспели в этом.
Риски, о которых нужно знать
При этом врачи сходятся во мнении, что женщины, которые планируют беременность, должны быть в курсе имеющихся рисков. В их числе — стеноз шейки матки и цервикальная недостаточность, которые могут привести к трудностям с зачатием и бесплодию, увеличить риск невынашивания и преждевременных родов. Также специалисты рекомендуют подождать 6–12 месяцев, прежде чем пытаться забеременеть, чтобы все полностью зажило. И сходить на контрольный осмотр, чтобы исключить любые риски.
Что делать, если не получается
Если после удаления шейки матки врач ставит вам диагноз «бесплодие», это не повод опускать руки. Важно понимать, что в вашем организме есть все необходимое, чтобы выносить малыша, — просто ему нужно немного помочь, потому что некоторые функции после перенесенной операции нарушились.
Здесь в дело вступают вспомогательные репродуктивные технологии. В зависимости от ситуации врач порекомендует ЭКО или ИКСИ и назначит те тесты, результаты которых ему нужны, чтобы подобрать оптимальную схему лечения.
Особенности ЭКО в естественном цикле
Однако, к сожалению, в силу множества факторов, часто желанная беременность не наступает слишком долго. В таких случаях не стоит отчаиваться, так как медицина шагнула далеко вперед, и сегодня стало возможно зачатие ребенка методом ЭКО. Примечательно, что проведение процедуры в каждом случае индивидуально, и осуществляется после тщательного сбора всей необходимой информации, а также подбора самого щадящего метода.
Сегодня на ЭКО в естественном цикле падает выбор многих пар, которое подразумевает проведение процедуры без стимуляции яичников. В данном случае гормональная нагрузка на организм женщины сведена к минимуму, в то время как традиционными протоколами ЭКО предполагается использование гонадотропных стимуляторов.
Щадящее ЭКО без стимуляции в естественном цикле – это метод оплодотворения клетки in vitro без дополнительной гормональной стимуляции. Важно помнить, что проведение ЭКО такого рода возможно в том случае, если циклы женщины овуляторные. Для более сложных случаев бесплодия данный метод не подходит, и необходимо дополнительное медикаментозное воздействие.
Плюсы проведения ЭКО в естественном цикле
ЭКО в естественном цикле, как уже говорилось, является щадящим методом, при котором яйцеклетка самостоятельно созревает в женском организме, и медикаментозная нагрузка на организм практически отсутствует. Основными же плюсами, которыми обладает ЭКО в естественном цикле, являются:
Минусы проведения ЭКО в естественном цикле
В то же время, как и при любых сложных медицинских процедурах, при ЭКО в естественном цикле есть минусы, и о них стоит знать заранее:
Также есть один большой существенный недостаток, который заключается в том, что количество ооцитов в натуральном цикле ограничено. Как результат, можно получить одну яйцеклетку, а значит, нет возможности выбрать наиболее жизнеспособный эмбрион.
Таким образом, дать положительный ответ на вопрос, у кого получилось ЭКО в естественном цикле с первого раза, могут далеко не все. Для того, чтобы определиться., подходит ли данный метод конкретной женщине, необходимы индивидуальные показания и предварительная оценка шансов на успех в том или ином случае.
Показания к ЭКО без гормональной стимуляции
Существует ряд основных показаний для проведения ЭКО в естественном цикле, при которых вероятность успешного исхода процедуры велика, и они таковы
Противопоказания к ЭКО со стимуляцией
Несмотря на то, что ЭКО со стимуляцией является более результативным, к нему существует ряд противопоказаний, и тогда оплодотворения без гормональной стимуляции является альтернативой.
Противопоказания к ЭКО без стимуляции яичников
Нужно понимать, что существует ряд ситуаций, при которых супружеской паре стоит отказаться от естественного протокола. Основными среди них являются:
случаи, когда женщина старше 35 лет;
наличие мужского бесплодия, при котором качество спермы низкое для получения жизнеспособного эмбриона;
нерегулярный цикл и ановуляторные циклы.
Такие образом, перед тем, как решиться на ЭКО в естественном протоколе, полное обследование должна пройти как женщина, так и мужчина. Так как метод позволяет получить только один жизнеспособный эмбрион, вероятность успеха будет невелика при наличии проблем у мужчины.
Этапы процедуры ЭКО в естественном цикле
Для успешной реализации программы ЭКО в естественно цикле важно строгое соблюдение поэтапности процедуры. Как же происходит ЭКО в естественном цикле? Общий план мероприятий таков:
То, на какой день цикла делают ЭКО в естественном цикле, решают специалисты с помощью УЗИ с 7-8 дня отслеживая уровень ЛГ.
Как подготовиться к не стимулированному ЭКО
Для того, чтобы подготовиться к не стимулированному ЭКО и значительно повысить шансы на успех при проведении процедуры, стоит выполнить ряд простых рекомендаций:
Естественно, что каждая пара рассматривается специалистами в индивидуальном порядке, и потому нужно выполнять все предписания, данные врачами.
Рекомендации после процедуры ЭКО в ЕЦ
После того, как произошел забор яйцеклетки, а также была выполнена подсадка эмбриона, важно соблюдать рекомендации врачей. В первую очередь, в течение 1.5 часа нужно находиться в лежачем положении, однако так как на этом этапе женщина находится в пределах медицинского учреждения, с выполнением задачи не возникает проблем. Что касается следующих рекомендаций, то их женщина должна выполнять сама со всей ответственностью:
При выполнении всех мер предосторожности шансы на успех процедуры значительно повышаются.
Цена ЭКО в естественном цикле
Всех тех, кого интересует данная процедура, в первую очередь также волнует такой вопрос, как стоимость ЭКО в естественном цикле. Расчет производится в индивидуальном порядке для каждой пары, и зависит от того, какое количество попыток понадобится для успеха. В «Центр ЭКО» Калуга стоимость программы составляет 83900 руб. на настоящий момент.
График работы:
Пн-Пт: с 9:00 до 21:00
Сб-Вск: с 9:00 до 18:00
Copyright © 2021 ООО «Центр ЭКО Калуга».
При копировании материалов активная ссылка на сайт обязательна