митохондриальная дисфункция что это такое у взрослых
Психические расстройства при дисфункции митохондрий
Существует значительная фенотипическая изменчивость, даже среди родственников, из-за изменяющегося генотипа, скорости гетероплазмии (отношение митохондрий к мутанту в норме в клетках) и «порогового эффекта» (доля пораженного митохондриала, необходимая для проявления симптомов) в различных тканях. У большинства пациентов на начальном этапе заболевания наблюдаются симптомы с хронически повышенным уровнем лактата. Однако во время повышенного потребления энергии, такого как инфекция, лихорадка, тяжелые физические нагрузки, голодание и перепады температуры, у пациентов повышается уровень лактата и возникает метаболический ацидоз, что приводит к усилению выраженности (или появлению) симптомов, часто в сочетании с изменением психического статуса. По мере течения болезни наблюдается ремиттирующий паттерн с постепенным ухудшением и частичными ремиссиями. Клинический опыт показывает, что семейный анамнез в этих случаях положителен для нескольксоматических, неврологических и психических расстройств и, часто, расстройств, связанных с употреблением психоактивных веществ, создавая у врача впечатление «проклятой» семьи.
Эпидемиология
Диагностику лучше всего проводить в специализированных центрах и обычно она включает в себя: выявление повышенного соотношения лактата/ пирувата, уровня аланина в сыворотке и соотношения ацил / свободного карнитина в сыворотке, а также повышенных концентраций в сыворотки и мочи органических кислот. В зависимости от фенотипа может быть указано множество дополнительных тестов (ЭМГ, ЭКГ, ЭЭГ пр.). Золотым стандартом диагностики в большинстве случаев является генетическое исследование кожи или мышечная биопсия (постмитотическая ткань), которая обычно проводится в специализированных лабораториях.
Психические расстройства
Лечение
В настоящее время не существует «лекарства» от этих расстройств. Реальные цели лечения состоят в том, чтобы облегчить симптомы и замедлить прогрессирование заболевания.
Профилактика обострений
Общие профилактические меры, такие как минимизация воздействия алкоголя, табака и химических психоактивных веществ, предотвращение высокой температуры и недосыпания, своевременное лечение инфекции, лихорадки и обезвоживания, важны для предотвращения рецидивов в медицине вообще и в психиатрии, в частности, у пациентов с митохондриальными заболеваниями. В общем, особые соображения необходимо соблюдать для анестезии, хирургии и иммунизации этих пациентов.
Митохондриальные заболевания
Митохондриальные заболевания (МЗ) — группа наследственных заболеваний, связанных с дефектами в функционировании митохондрий, приводящими к нарушениям энергетических функций в клетках.
Историческая справка:
Понятие «митохондриальные болезни» сформировалось в медицине в конце ХХ века. В первую очередь были изучены болезни, связанные с мутациями митохондриальной ДНК, открытой в начале 60-ых годов. Полная первичная структура митохондриальной ДНК человека была опубликована в 1981 го¬ду и уже в конце 80-ых годов была доказана ведущая роль ее мутаций в развитии ряда наследственных заболеваний. К последним относятся: наследственная атрофия зрительных нервов Лебера, синдром NARP (нейропатия, атаксия, пигментный ретинит), синдром MERRF (миоклонусэпилепсия с «рваными» красными волокнами в скелетных мышцах), синдром MELAS (митохондриальная энцефаломиопатия, лактат-ацидоз, инсультоподобные эпизоды), синдром Кернса-Сейра (пигментный ретинит, наружная офтальмоплегия, блокада сердца, птоз, мозжечковый синдром), синдром Пирсона (поражение костного мозга, панкреатическая и печеночная дисфункции) и многие другие.
В меньшей степени изучены наследственные митохондриальные дефекты, связанные с повреждением ядерного генома.
Патогенез.
Митохондрии отвечают за выработку большей части энергии, необходимой для функционирования клеток. Фактически они являются настолько важным источником энергии, что в каждой клетке их сотни. При МЗ могут «выключиться» как часть митохондрий, так и все они, что приводит к прекращению выработки необходимой энергии
Поскольку наиболее энергоемкими являются нервные и мышечные клетки, при МЗ наиболее распространены мышечные и неврологические проблемы, такие, как мышечная слабость, непереносимость физических нагрузок, потеря слуха, нарушения баланса и координации, эпиприступы.
Когда клетка заполнена дефектными митохондриями, она не только лишена АТФ, но в ней могут накапливаться неиспользуемые молекулы топлива и кислород, что приводит к катастрофическим последствиям. В этом случае избыточные молекулы топлива используются для синтеза АТФ неэффективно, в результате чего могут образовываться потенциально опасные продукты, такие, как молочная кислота (Это также происходит, когда клетки испытывают недостаток кислорода, например – мышечные клетки при усиленных физических нагрузках). Накопление молочной кислоты в крови – лактатацидоз – ассоциировано с мышечной усталостью, и может вызывать повреждение нервной и мышечной тканей.
При этом неиспользуемый в клетке кислород может трансформироваться в разрушительные соединения, именуемые реактивными формами кислорода, включая т. н. свободные радикалы (Они являются мишенью для т. н. антиоксидантных препаратов и витаминов).
Синтезированная в митохондриях АТФ – основной источник энергии для сокращения мышечных и возбуждения нервных клеток (т. к. клетки этих тканей наиболее метаболически активны, энергетически зависимы). Таким образом, нервные и мышечные клетки особенно чувствительны к дефектам митохондрий. Комбинированный эффект от потери энергии и накопления токсинов в этих клетках, надо полагать, и вызывает развитие симптомов митохондриальных миопатий и энцефаломиопатий
Клиника
Характерные признаки митохондриальных цитопатий:
•скелетные мышцы: низкая толерантность к физической нагрузке, гипотония, проксимальная миопатия, включающая фациальные и фарингеальные мышцы, офтальмопарез, птоз
•сердце: нарушения сердечного ритма, гипертрофическая миокардиопатия
•центральная нервная система: атрофия зрительного нерва, пигментная ретинопатия, миоклонус, деменция, инсультоподобные эпизоды, расстройства психики
•периферическая нервная система: аксональная нейропатия, нарушения двигательной функции гастроинтестинального тракта
•эндокринная система: диабет, гипопаратиреоидизм, нарушение экзокринной функции панкреас, низкий рост
Таким образом, типичны для митохондриальных заболеваний вовлеченность разных органов и одновременное проявление внешне не связанных между собой аномалий. Примерами служат:
1. Мигрени с мышечной слабостью
2. Наружная офтальмоплегия с нарушением проводимости сердечной мышцы и мозжечковой атаксией
3. Тошнота, рвота с оптической атрофией и кардиомиопатией
4. Низкорослость с миопатией и инсультоподобным и эпизодами
5. Экзокринная дисфункция поджелудочной железы с сидеробластной анемией
6. Энцефало- миопатия с диабетом
7. Диабет с глухотой
8. Глухота с наружной офтальмоплегией, птозом и ретинопатией
9. Задержка развития или потеря навыков и офтальмоплегия, офтальмопарез
Характер и тяжесть клинических проявлений митохондриальных болезней определяется:
• тяжестью мутации мтДНК;
• процентным содержанием мутантной мтДНК в конкретных органах и тканях;
• энергетической потребностью и функциональным резервом органов и тканей, содержащих мтДНК (их “порогом чувствительности” к дефектам окислительного фосфори лирования).
Миопатия
Основные симптомы митохондриальной миопатии – истощение мышц и их слабость, и непереносимость физических нагрузок.
У некоторых индивидов слабость наиболее выражена в мышцах, контролирующих движения глаз и век. Два наиболее частых следствия такой слабости – это постепенный паралич движения глаз (прогрессирующая наружная офтальмоплегия, ПНО), и опущение верхних век (птоз). Зачастую люди автоматически компенсируют ПНО движениями головы для того, чтобы смотреть в различных направлениях, и могут даже не подозревать о каких либо проблемах. Птоз потенциально более неприятен, поскольку может ухудшить зрение, а также придает лицу апатичное выражение, но он может быть скорректирован хирургическим путем, либо использованием специальных очков с устройством для подъема века
Митохондриальные миопатии могут также вызывать слабость других мышц лица и шеи, что приводит к заплетающейся речи и трудностям с глотанием. В этих случаях могут помочь речевая терапия (занятия с логопедом) или включение в рацион питания таких продуктов, которые легче проглатываются.
Энцефаломиопатия
Митохондриальная энцефаломиопатия, как правило, включает некоторые из вышеупомянутых симптомов миопатии, дополненными одним или несколькими неврологическими симптомами. Также как и при миопатии, наблюдается значительная вариабельность симптомов обоего типа и тяжести течения у разных индивидов.
Среди наиболее частых симптомов митохондриальной энцефаломиопатии – нарушения слуха, мигренеподобные головные боли и эпиприступы. По крайней мере, в одном синдроме головные боли и эпиприступы часто сопровождается инсультоподобными эпизодами
Дополнительно к поражению глазных мышц, митохондриальная энцефаломиопатия может поражать как сами глаза, так и участки головного мозга, ответственные за зрение. Например, потеря зрения вследствие оптической атрофии (дегенерации зрительного нерва) или ретинопатии (дегенерации некоторых клеток, выстилающих глазное дно) – обычные симптомы митохондриальной энцефаломиопатии. По сравнению с мышечными проблемами, эти эффекты с большей вероятностью приводят к серьезным нарушениям зрения
Довольно часто митохондриальная энцефаломиопатия вызывает атаксию, или сложности с балансом и координацией.
Диагностика.
Ни один из отличительных симптомов митохондриального заболевания – мышечная слабость, непереносимость нагрузок, ухудшение слуха, атаксия, эпиприступы, неспособность к обучению, катаракта, диабет и низкорослость – не является уникальным именно для такого заболевания. Однако комбинация трех или более из этих симптомов у одного индивида свидетельствует в пользу митохондриального заболевания, особенно если симптомы затрагивают более одной системы организма
Физикальное обследование обычно включает в себя тесты на силу и выносливость, такие например, как повторяющиеся сжатия-разжатия кулака, или подъем и спуск по небольшой лестнице. Неврологическое обследование может включать в себя проверку рефлексов, зрения, речи и базовых когнитивных способностей.
Существует ряд рутинных клинических методов исследования, которые можно использовать при подозрении на митохондриальную цитопатию:
•лактатный ацидоз является практически постоянным спутником митохондриальных болезней (только этот признак является недостаточным для постановки диагноза, так как он может выявляться и при других патологических состояниях; в этом отношении может быть полезным измерение уровня лактата в венозной крови после умеренной физической нагрузки, например на велоэргометре)
•ЭЭГ – данные ЭЭГ не является достаточно специфическими
Образцы мышечных биоптатов целесообразно делить на три части – одна для микроскопического исследования (гистология, гистохимия и электронная микроскопия), вторая для энзимологического и иммунологического анализа (изучение характеристик компонентов дыхательной цепи) и третья – непосредственно для молекулярно-генетического анализа. Поиск известных мутаций на мышечном материале позволяет в большинстве случаев успешно осуществлять ДНК-диагностику болезни. При отсутствии из вестных мутаций мтДНК в мышечной ткани следующим этапом является развернутый молекулярно-генетический анализ – секвенирование всей цепи мтДНК (или кандидатных генов ядерной ДНК) с целью выявления нового варианта мутации.
Лечение.
Что касается терапии митохондриальных цитопатий, то речь может идти пока только о симптоматической.
Лечение митохондриальных болезней проводится обычно по двум основным направлениям:
•предупреждение повреждения митохондриальных мембран свободными радикалами с помощью антиоксидантов (витамин Е, a-липоевая кислота) и мембранопротекторов.
В практику входят всё новые препараты комбинированного действия, такие, например, как идебенон (Нобен) – улучшенный структурный аналог коэнзима Q10, благоприятно влияющий на активность дыхательного пути и обладающий выраженным антиоксидантным, антиапоптотическим и нейротрофическим действием.
Очевидно, что расширение терапевтического арсенала при митохондриальных болезнях диктует настоятельную необходимость того, чтобы практические врачи различных специальностей (неврологи, психиатры, педиатры, генетики, гематологи и др. ) были хорошо знакомы с алгоритмом диагностики этих заболеваний.
Особенности митохондриальных заболеваний
Митохондриальные заболевания – особый класс наследственных патологий, в основе которых лежит нарушение функционирования митохондрий, клеточных структур, чьей основной функцией принято считать выработку энергии в виде АТФ путем окислительного фосфорилирования. К дефектам работы митохондрий могут приводить как мутации в ДНК самих этих органелл(мтДНК), так и мутации генов ядерной ДНК (яДНК), продукты которых задействованы в метаболизме митохондрий. Клинически, дефекты в функционировании митохондрий по-разному проявляются со стороны конкретных органов и тканей, однако, в первую очередь страдают наиболее энергозависимые ткани, коими являются нервная и мышечная. Установлено, что митохондриальные заболевания относятся к наиболее частым наследственным неврологическим расстройствам. По некоторым мутациям частота встречаемости достигает 1 на 400 человек в европейской популяции, хотя фенотипически мутация проявляется значительно реже, примерно 1 на 8000 человек [1].
Мутации митохондриальной ДНК
В настоящее время выявлено более 400 точковых мутаций мтДНК, а также различных делеций и перестроек мтДНК. Известно более 200 заболеваний, вызванных этими мутациями [2]. Для митохондриальных заболеваний свойственна клиническая и генетическая гетерогенность. Одни мутации приводят к строго определенным клиническим признакам. Так, например, мутация 11778 G→A приводит только к наследственной оптической нейропатии Лебера (LHON). Другая мутация, например 3243 A→G, вызывает огромное количество клинических проявлений, которые могут затрагивать центральную нервную систему, периферическую нервную систему, эндокринную систему, сердце, глаза, уши, желудочно-кишечный тракт, почки и кожу. Причем, все эти органы и системы органов могут поражаться как в совокупности, так и индивидуально. Третьим вариантом гетерогенности является синдром Лея, который могут вызывать около 30 мутаций мтДНК, а также мутации более чем в 20 генах ядерной ДНК, кодирующей белки биогенеза митохондрий.
Особенностью митохондриальных заболеваний, обусловленных мутациями мтДНК, является материнский тип наследования (в норме митохондрии передаются только через ооциты). Стоит отметить, однако, что митохондриальное наследование, на первый взгляд, можно спутать с X-сцепленным рецессивным наследованием – в обоих случаях болеют дети больной женщины. Разница же заключается в соотношении полов больного потомства: при митохондриальном наследовании все дети имеют равный шанс заболеть, в то время как при X-сцепленном рецессивном наследовании мутация клинически проявляется лишь у мужского пола. Отдельно стоит выделить спорадические случаи – мутация, возникшая в мтДНК de novo, также может спутать понимание характера наследования. Таким образом, анализ родословных является неотъемлемой частью постановки диагноза.
Исследование митохондриальной ДНК
В отличие от яДНК, которая представлена в большинстве клеток человека в двух копиях, мтДНК насчитывает от сотен до тысяч копий на клетку. С практической точки зрения, огромное число копий мтДНК является несомненным преимуществом при анализе структуры этой молекулы, поскольку позволяет работать с минимальным количеством имеющегося биологического материала. Другой, не менее важной особенностью, являющейся следствием многокопийности мтДНК, является феномен гетероплазмии, то есть состояние, когда в рассматриваемой системе (клетка, орган, организм) наблюдается сосуществование мутантной и нормальной мтДНК, в отличие от гомоплазмии, когда все мтДНК идентичны. Интересно, что состояние гетероплазмии является одним из критериев патогенности мутации. Величина гетероплазмии, а также распределение мутантных мтДНК в организме, во многом определяет фенотипическое проявление мутации мтДНК, на практике – клиническую картину заболевания.
Для того чтобы патогенная мутация проявилась фенотипически, количество мтДНК, содержащее эту мутацию (уровень ее гетероплазмии) должны превысить определенное критическое значение. Считается, что превышение 70% барьера приводит к клиническому проявлению той или иной патогенной мутации мтДНК, и носит название порогового эффекта. Тем не менее, определенные мутации могут иметь довольно низкий пороговый эффект, что может привести к сложностям в выявлении таких мутации некоторыми молекулярно-генетическими методами (например, ПДРФ-анализом). Таким образом, существует необходимость точной оценки количества мутантных мтДНК [2]. Следует заметить, что оценка уровня гетероплазмии уже включает детекцию мутаций, в то время как некоторые используемые в лабораторной практике методы обнаружения мутации не всегда учитывают уровень ее гетероплазмии.
Диагностика наследственного заболевания
Молекулярно-генетическое подтверждение, в идеале, является конечным этапом дифференциальной диагностики любого наследственного заболевания, однако, в случае митохондриальной патологии лишь меньше, чем в половине случаев удается обнаружить патогенную мутацию. Для установления вердикта «митохондриальное заболевание», однако, достаточно выявить «рваные красные волокна» в биоптатах скелетных мышц и повышение уровня лактата и пирувата в крови и/или ликворе (лактатный ацидоз). С другой стороны, оба этих признака сами по себе не являются специфическими для митохондриальных заболеваний. В качестве диагностического критерия может быть наличие, на первый взгляд, не связанных между собой клинических признаков. Определение активности комплексов окислительного фосфорилирования также является одним из ключевых моментов дифференциальной диагностики [3, 4].
Свои особенности имеет биохимический профиль биологических жидкостей при митохондриальных патологиях. Сразу стоит отметить, что лабораторная диагностика митохондриальных заболеваний – это подчас весьма специфические исследования, которые может позволить себе не каждая лаборатория. В плазме и спинномозговой жидкости выявляют повышенный уровень таких аминокислот как аланин, глицин, пролин, саркозин и тирозин. Со стороны органических кислот наблюдаются следующая картина: повышен уровень компонентов цикла трикарбоновых кислот, этилмалоновой кислоты, 3-метилглутаконовой кислоты и бикарбоновых кислот. В крови наблюдается снижение уровня общего карнитина.
Возможно ли лечение?
Несмотря на значительный прогресс диагностике и понимании молекулярного патогенеза данного класса заболеваний, к настоящему времени, митохондриальные заболевания остаются неизлечимы. Используемые в клинической практике стратегии симптоматического лечения включают применение фармакологических средств, специальных диет, а также физических нагрузок. В некоторых случаях применяется хирургическое вмешательство. Также в настоящее время разрабатываются различные экспериментальные подходы, направленные на устранение дефектов дыхательной цепи митохондрий на молекулярном уровне [2, 5].
На сегодняшний день наиболее приемлемым методом предотвращения митохондриального заболевания остается предотвращение передачи мутантных генов следующему поколению [6]. Основными стратегиями предотвращения передачи дефектов генетического материала потомству принято считать пренатальную диагностику (ПНД) и преимплантационную генетическую диагностику (ПГД). Для мутаций ядерного генома такие процедуры считаются приемлемыми. Применение же подобных процедур к дефектам митохондриального генома имеет известные ограничения. Главным образом для большинства мутаций мтДНК это связано с плохой корреляцией между уровнем гетероплазмии и тяжестью заболевания, неравномерным распределением мутантной ДНК в тканях организма, и изменением уровня гетероплазмии в течение жизни человека [7].
Список литературы:
1. Turnbull H.E., Lax N.Z., Diodato D., Ansorge O., Turnbull D.M. The mitochondrial brain: From mitochondrial genome to neurodegeneration // Biochim. Biophys. Acta. 2010. V. 1802. P. 111–121.
2. Мазунин И.О., Володько Н.В., Стариковская Е.Б., Сукерник Р.И. Митохондриальный геном и митохондриальные заболевания человека // Мол. Биол. 2010. Т. 44. №. 5. С. 755– 772.
3. Иллариошкин С.Н. Алгоритм диагностики митохондриальных энцефаломиопатий // Атмосфера. Нервные болезни. 2007. Т. 3. С. 23–27.
4. Haas R.H., Parikh S., Falk M.J., Saneto R.P., Wolf N.I., Darin N., Wong L.J., Cohen B.H., Naviaux R.K. The in-depth evaluation of suspected mitochondrial disease // Mol. Genet. Metab. 2008. V. 94. P. 16–37.
5. Finsterer J. Treatment of mitochondrial disorders // Eur. J. Paediatr. Neurol. 2010. V. 14. P. 29–44.
6. Мазунин И.О., Володько Н.В. Митохондрии: жизнь в клетке и ее последствия // ПРИРОДА. 2010. № 10. С. 3–14.
Кардиомиопатии при первичной митохондриальной патологии. Подходы к лечению
Чем характеризуются митохондриальные заболевания? Какие диагностические критерии позволяют предположить развитие КМ, связанных с энергетической несостоятельностью митохондрий? Какие препараты используются для коррекции кардиомиопатии при первичной ми
Чем характеризуются митохондриальные заболевания?
Какие диагностические критерии позволяют предположить развитие КМ, связанных с энергетической несостоятельностью митохондрий?
Какие препараты используются для коррекции кардиомиопатии при первичной митохондриальной патологии?
Кардиомиопатии (КМП) у детей относятся к тяжелым заболеваниям миокарда с непрерывно прогрессирующим течением и с высокой смертностью 3. До последнего времени научные разработки по этой патологии были направлены на совершенствование методов диагностики заболевания, определение стадий клинического течения и поиск новых лекарственных препаратов для лечения недостаточности кровообращения 5.
Достижения медицинской науки за последние десятилетия в области медицинской генетики, биохимии и клинической морфологии помогли идентифицировать среди ранее недифференцированных патологических состояний новый класс митохондриальных заболеваний, обусловленных глубокими дефектами структуры и функции митохондрий [9, 10]. Развитие представлений о митохондриальной патологии позволило значительно расширить современные воззрения на патогенез заболеваний миокарда. Появилась возможность выделить особую группу метаболических митохондриальных КМП, что способствовало разработке дифференцированной специфической терапии.
Митохондриальные заболевания характеризуются полиорганностью поражения и проявляются в первую очередь поражением скелетных мышц, вовлечением в патологический процесс других органов и тканей (мозга, сердца, печени, почек) вариабельно, что приводит к гетерогенной клинической картине 9. Описаны КМП при типичных митохондриальных заболеваниях: синдромах MERRF [11, 13, 14], MELAS 17, Кернса-Сейра [17, 18], митохондриальной миопатии [19]. Вместе с тем митохондриальная дисфункция может быть не только причиной развития полиорганной патологии, но и проявляться преимущественным поражением миокарда.
Экспериментальными и клиническими исследованиями последних лет установлено, что при так называемых «идиопатических» кардиомиопатиях происходят нарушения окислительного фосфорилирования, связанные со снижением активности митохондриальной электронно-транспортной системы вследствие мутации митохондриальной или ядерной ДНК. Существует предположение, что митохондриальная дисфункция может являться патогенетической основой кардиомиопатий, считающихся «идиопатическими» [14, 20-23]. Митохондриальные КМП могут быть определены как заболевания миокарда, сопровождающиеся структурными, количественными и функциональными нарушениями митохондрий либо комбинацией этих нарушений [14, 20-23]. Установлено, что основой формирования митохондриальных КМП являются мутации митохондриальной ДНК [20, 24-27]. Делеция, или точковая мутация, митохондриальной ДНК была выявлена в исследовании, проведенном Ито Т. (1992) [24] среди больных с гипертрофической или дилатационной кардиомиопатией и синдромом MELAS (митохондриальная миопатия, лактат-ацидоз, инсультоподобные эпизоды). Суомалайнен (1992) [26] приводит наблюдения за женщиной и ее сыном с дилатационной кардиомиопатией, обусловленной мутацией митохондриальной ДНК. Casali с соавт. (1995) [27] описывает новую мутацию митохондриальной ДНК в позиции 4300 tRNA(Ile), ассоциирующейся с ГКМП и материнским наследованием.
Мутации митохондриальной ДНК приводят к нарушению транспорта электронов вследствие патологии комплексов цепи дыхательных ферментов, что фенотипически проявляется КМП. Так, описаны КМП при дефиците цитохром С-оксидазы [28], снижении активности I и IV или II и III комплексов цепи дыхательных ферментов митохондрий [29], низкой активности пальмитоил-коэнзим А дегидрогеназы, связанной со снижением функции ацетил-коэнзим А дегидрогеназы длинных цепей [30].
В отечественной детской кардиологической практике митохондриальные КМП при жизни диагностируются недостаточно достоверно или остаются нераспознанными. Отсутствуют критерии дифференцированного подхода к обследованию больных с КМП для выявления митохондриальной недостаточности, не разработаны пути метаболической коррекции нарушений клеточной энергетики.
Мы наблюдали 16 больных с митохондриальными синдромами Кернса-Сейра (8 детей), Барта (1), MELAS (2), MERRF (1), гистиоцитарной КМП (1), карнитиновой КМП (2), с дефицитом II комплекса цепи дыхательных ферментов КМП (1 больной).
Программа исследования включала электрокардиографию, рентгенографию грудной клетки, суточное холтеровское мониторирование, допплер-эхокардиографию, позитронно-эмиссионную томографию (ПЭТ) сердца, неинвазивную оценку перфузии и метаболизма миокарда, морфологический анализ биоптатов скелетной мышцы, биохимическое определение в крови уровня лактата и пирувата. По показаниям проводились электромиография и электроэнцефалография.
Синдром Кернса-Сейра впервые описан Кернсом в 1946 году как заболевание с характерным клиническим симптомокомплексом: прогрессирующая наружная офтальмоплегия, пигментная ретинопатия, КМП с нарушением проводящей системы и развитием полного атриовентрикулярного блока. Более детальное изучение этого заболевания принадлежит Сейру, в связи с чем с 1956 года этот симптомокомплекс получил называние синдрома Кернса-Сейра. Пониманию природы синдрома способствовали молекулярно-генетические исследования и обнаружение мутаций митохондриальной ДНК [23, 31-34]. Впервые гистохимические и ультраструктурные изменения мышечных волокон в виде феномена «рваных» красных волокон (RRF), являющиеся важным критерием митохондриальной патологии, при синдроме Кернса-Сейра были обнаружены в 1972 году в работе Олсона и соавт. [35].
По нашим данным, при синдроме Кернса-Сейра при световой биопсии скелетных мышц феномен RRF определяется в 25% мышечных волокон. Обнаруживаются и другие маркеры митохондриальной патологии: субсарколемальные скопления липидов, гликогена, кальция. Электронная микроскопия выявляет нарушения структуры митохондрий: отсутствует часть митохондриальных крист, нарушено их обычное расположение (рис. 1).
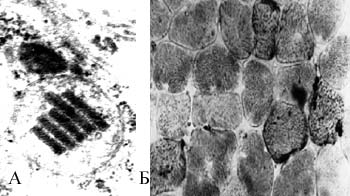 |
| Рисунок 1. Синдром Кернса-Сейра. А. Крупная митохондрия с деструкцией большинства крист и наличием сегмента параллельно лежащих, регенирирующих крист. ЭМ.х110 000 Б. Наличие субсарколеммальных полос продуктов реакции на СДГ в поперечно срезанных мышечных волокнах. Феномен RRF. Ув. 250 |
Клиническая манифестация синдрома Кернса-Сейра относится ко второму или даже третьему десятилетию жизни. Этот феномен объясняется тем, что суммарная функция митохондрий в течение длительного времени может оставаться удовлетворительной [36]. При этом, чем раньше проявляется заболевание, тем оно носит более генерализованный характер и имеет худший прогноз. Диффузные патологические изменения в митохондриях различных органов и тканей объясняют мозаичность клинической картины с вовлечением различных органов и систем. Отмечается задержка физического и полового развития. Изменения со стороны кожи проявляются ихтиозом с очагами гиперпигментации. Нарушения со стороны опорно-двигательного аппарата характеризуются вальгусной девиацией голеней и высоким сводом стопы. Наиболее выраженной является патология со стороны глаз. Характерны наружная офтальмоплегия с птозом различной степени выраженности, пигментный ретинит или пигментная дегенерация сетчатки. Птоз — наиболее типичный признак [10]. Один из наиболее частых симптомов — мозжечковая атаксия. У многих больных наблюдается умственная отсталость, однако степень снижения интеллекта варьирует от умеренно выраженной до прогрессирующей деменции. Описан случай инфаркта мозга у больного с синдромом Кернса-Сейра [37]. Нарушения со стороны эндокринной системы включают дефицит гормона роста, гипоганодизм, сахарный диабет, гипопаратиреоз, нарушение адреналового обмена [31, 38 ].
Изменения сердечно-сосудистой системы являются облигатной составляющей клинического симптомокомплекса синдрома Кернса-Сейра. Варианты и степень выраженности нарушений со стороны сердечно-сосудистой системы определяют тяжесть течения и прогноз синдрома Кернса-Сейра. Эти изменения в большинстве случаев затрагивают проводящую систему сердца. В исследованиях Мюллера с соавт. [39] обосновано преимущественное поражение проводящей системы сердца по сравнению с миокардиальными нарушениями у больных с синдромом Кернса-Сейра, большей представленностью мутаций митохондриальной ДНК в проводящей системе сердца в отличие от клеток сократительного миокарда. Так, частота мутаций митохондриальной ДНК у пациентов с синдромом Кернса-Сейра в клетках проводящей системы составляет 35-40% по сравнению с клетками сократительного миокарда — 10-20% [40]. Поражение проводящей системы сердца чаще всего характеризуется полным атриовентрикулярным блоком. В ряде случаев патология со стороны сердечно-сосудистой системы при синдроме Кернса-Сейра долгое время остается нераспознанной [41]. Иногда врачи проявляют серьезную озабоченность только при появлении полной атриовентрикулярной блокады, приводящей к резкой брадикардии, длительным паузам сердечного ритма с развитием синкопальных состояний — приступов Морганьи-Адамса-Стокса. Наличие полного атриовентрикулярного блока, не купированного своевременно имплантацией искусственного водителя ритма, является непосредственной причиной гибели этих пациентов [38, 41]. С другой стороны, даже имплантация искусственного водителя ритма не гарантирует благополучного прогноза. Так, Н. А. Белоконь с соавт. (1988) [42] обследовали ребенка с синдромом Кернса-Сейра, у которого на фоне полной атриовентрикулярной блокады частота сердечных сокращений уменьшалась до 28 в минуту, что сопровождалось развитием синкопальных состояний и потребовало имплантации искусственного водителя ритма. Однако, несмотря на это, больной умер через 9 лет от прогрессирующей сердечной недостаточности при удовлетворительном функционировании пейсмекера. Полная атриовентрикулярная блокада помимо угрозы возникновения приступов Морганьи-Адамса-Стокса приводит к возникновению миокардиальной дисфункции с последующим возможным развитием недостаточности кровообращения [38, 41]. Акэйк М. с соавт. (1997) подчеркивают, что высокий риск возникновения миокардиальной недостаточности на фоне полного атриовентрикулярного блока диктует необходимость имплантации пейсмекера типа DDD в ранние сроки, не дожидаясь опасных для жизни нарушений в проводящей системе сердца [43].
Под нашим наблюдением находилось 8 пациентов с синдромом Кернса-Сейра. Изменения со стороны проводящей системы не всегда манифестируют полным атриовентрикулярным блоком, возможно постепенное нарастание изменений со стороны проводящей системы сердца, что наблюдалось в 4 случаях. Степень поражения сердечно-сосудистой системы широко варьирует от дистального нарушения проведения по правой или левой ножке пучка Гиса до полной атриовентрикулярной блокады. Поражения проводящей системы сердца носят непрерывно прогрессирующий характер — они начинаются с дистальной блокады ножек пучка Гиса, распространяясь на атриовентрикулярный и синусовый узлы с развитием полной атриовентрикулярной блокады и синдрома слабости синусового узла.
Нарушения проводящей системы сердца при синдроме Кернса-Сейра могут сочетаться с изменениями в миокарде по типу КМП. Возможно формирование как дилатационной (3 из 8 наблюдений), так и гипертрофической симметричной необструктивной кардиомиопатии (2 из 8). Наиболее тяжелое поражение сердечно-сосудистой системы отмечено у девочки 15 лет с синдромом Кернса-Сейра. Наблюдалось диффузное прогрессирующее поражение проводящей системы сердца, начиная с дистальной двухпучковой блокады ножек пучка Гиса и транзиторной атриовентрикулярной блокады 1-й степени с последующим развитием блокады правой и левой ножек пучка Гиса до полной атриовентрикулярной блокады с длительностью периодов асистолии от 3 до 4 секунд и возникновением жизнеугрожающих синкопальных состояний — приступов Морганьи-Адамса-Стокса, что потребовало экстренной трансплантации искусственного водителя ритма. После имплантации ЭКС частота сердечного ритма составила 86 ударов в минуту. Нарушения проводящей системы сердца сопровождались развитием КМП, сочетающей как дилатацию полости левого желудочка, так и симметричную гипертрофию левого желудочка без обструкции. Особенности данного процесса следующие: развитие выраженной миокардиальной дисфункции, резкое снижение контрактильной способности миокарда и наличие обширных ишемических изменений в области переднебоковой стенки левого желудочка (деформация желудочкового комплекса по типу QS V1-5). Развитие миокардиальной дисфункции, снижение сократительной способности миокарда, распространенные ишемические изменения резко ухудшают прогноз течения синдрома Кернса-Сейра.
Синдром MELAS (митохондриальная миопатия — энцефалопатия — лактат-ацидоз, инсультоподобные эпизоды)
В основе патогенеза синдрома лежат точковые мутации митохондриальной ДНК. Мутация наиболее часто встречается в скелетной и сердечной мышцах, печени, почках, поджелудочной железе, мозжечке и коре больших полушарий [14]. Дебют заболевания вариабелен, наиболее часто это происходит между 6 и 10 годами. Экстракардиальными клиническими симптомами являются судороги, рецидивирующие головные боли, рвота, анорексия, непереносимость физических нагрузок, инсультоподобные эпизоды, деменция, миопатический симптомокомплекс, признаки периферической невропатии. При компьютерной томографии головного мозга выявляются зоны инфарктов, преимущественно в области гемисфер, что и обусловливает неврологическую симптоматику.
Под нашим наблюдением находились два пациента с синдромом MELAS. В одном из этих случаев наследственность отягощена. Старший ребенок умер в возрасте 10 лет (отмечались атрофия зрительного нерва, периодическая рвота, частые мигренеподобные головные боли, выраженная мышечная слабость, утомляемость, косоглазие), у матери — частые головные боли, непереносимость физических нагрузок. Дебют заболевания в том и другом случае относился к 8 годам. Первые симптомы — частые мигренеподобные головные боли, сопровождающиеся тошнотой и рвотой. Изменения неврологического статуса характеризовались мышечной слабостью, повышенной утомляемостью при физической нагрузке, нарушением походки: пошатывание при ходьбе, неуверенность при выполнении координационных проб. Впоследствии развились атаксия, нарушение речи (дизатрия, моторная дислалия), частые мигренеподобные головные боли, двустороннее снижение слуха, судорожные подергивания левой половины лица, сонливость. В 9 лет появились эпизоды тошноты, рвоты, снижения аппетита, усилились мигренеподобные головные боли. В 10 лет на фоне подъема температуры возник эпилептический статус, затем приступы стали чаще сопровождаться потерей сознания, клоническими подергиваниями левых конечностей и заведением левого глазного яблока кнаружи. Частота приступов в течение года нарастала, и в 12 лет возник инсультоподобный эпизод, в левых конечностях развился стойкий гемипарез. В одном случае отмечалось снижение остроты зрения. На ЭЭГ определялась пароксизмальная активность в виде групп острых волн с преимущественной локализацией в левой теменно-затылочной области. МРТ мозга: ишемические очаги в области головки хвостатого ядра и в белом веществе головного мозга кнаружи от внутренней капсулы слева. Нарушения зрения больше были характерны для девочки — отмечались снижение остроты зрения и частичная атрофия зрительного нерва. В 10 лет появились расходящееся косоглазие, птоз левого века, мелкоамплитудный горизонтальный нистагм, слабость конвергенции с обеих сторон. По данным аудиометрии, отмечалась двусторонняя нейросенсорная тугоухость.
 |
| Рисунок 2. ЭхоКГ — дилатация полости левого желудочка (КДДлж = 56 мм), снижение сократительной способности миокарда (фр. выброса 0,34) |
В одном случае изменения со стороны сердца характеризовались симметричной ГКМП (Тзслж = Тмжп = 11 мм при норме 7 мм). Отмечались нарушения ритма — эктопический предсердный ритм, суправентрикулярная экстрасистолия — по типу три- и квадригеминии, нарушение процессов реполяризации. Наиболее тяжелое течение заболевания отмечено у девочки 12 лет с дилатационной КМП. По данным ЭКГ, резко выраженная синусовая тахикардия, нарушение процессов реполяризации миокарда. Результаты ЭхоКГ выявили дилатацию левого желудочка (КДД = 56 мм при норме 40 мм), снижение контрактильной способности миокарда (ФВ = 0,34 при норме 0,60) (рис. 2). По данным позитронно-эмиссионной томографии, отмечена дилатация полостей левого и правого желудочков, резкое снижение метаболизма глюкозы в миокарде (накопление FDG18 стенками миокарда резко снижено во всем миокарде, невозможно выделить стенки и полости левого желудочка К FDG18= 0,6-1,1 при норме 2,5, реакция на нагрузку глюкозой отсутствует) на фоне нормальной перфузионной способности миокарда (рис. 3). Зафиксировано выраженное снижение активности цикла Кребса.
 |
| Рисунок 3. Нарушение метаболизма глюкозы в миокарде, по данным позитронно-эмиссионной томографии при синдроме Барта. Перфузия миокарда в пределах нормы. Снижение метаболизма глюкозы — накопление FDG18 снижено (К FDG18 =1,4 при норме 2,5) |
По данным биохимического анализа крови, в том и другом случае отмечалось повышение содержания молочной и пировиноградной кислот: содержание молочной кислоты в исходе — 2,8 ммоль/л, через час после нагрузки глюкозой — 3,0, через 3 часа — 3,2 ммоль/л ; содержание пировиноградной кислоты в исходе — 0,34 ммоль/л (норма 0,05-0,09), через час — 0,28, через 3 часа — 0,24 ммоль/л; рН — 7,38. По данным биопсии скелетной мышцы, размеры большинства мышечных волокон не изменены, имелись участки атрофии — до 20%, в них отмечены регионарные некрозы и локальные участки повышения регенераторной активности по интраволоконному типу. В 35% мышечных волокон при окраске на сукцинатдегидрогеназу определяется выраженный позитивный феномен RRF (рис. 3). При электронной микроскопии выявляются типичные участки пролиферирующих митохондрий. Гликоген и липиды распределены равномерно, в значительном количестве определяются конгломераты кальция. Цитохимическое исследование обнаружило снижение активности СДГ в лимфоцитах периферической крови — 13 ед. (норма 19-22 ед.).
Cиндром MERRF (миоклонус-эпилепсия и инфаркт мозга, RRF-волокна)
Сочетание миоклонус-эпилепсии с «рваными» красными волокнами скелетных мышц обнаружили в 1973 году Циарис с соавторами, но в качестве синдрома MERRF он был описан Фукухарой и его соавторами в 1980-м. В основе синдрома MERRF лежит точковая мутация в позиции 8344 в гене лизиновой tРНК. При этом снижается синтез белка, кодируемый митохондриальной ДНК, в первую очередь это касается субъединиц цитохромоксидазы. Заболевание наследуется по митохондриальному (материнскому) типу. Дебют MERRF вариабелен — от 3 до 63 лет. Экстракардиальными симптомами, доминирующими в клинической картине, являются миоклонус-эпилепсия, атаксия, деменция, потеря слуха и мышечная слабость. С этих же симптомов заболевание может манифестировать. При компьютерной томографии головного мозга выявляются множественные церебральные инфаркты. Именно эти изменения и обусловливают основную неврологическую симптоматику. В биоптатах скелетных мышц обнаруживаются типичные RRF. Ферментно-гистохимический анализ выявляет недостаточность цитохром С-оксидазы. При электронной микроскопии наблюдаются увеличение размеров митохондрий, их деформация, липидные включения [13].
Под нашим наблюдением находился ребенок с синдромом MERRF. Изменения со стороны сердца характеризовались симметричной гипертрофической КМП (Тзслж = Тмжп = 12 мм при норме 7 мм). Отмечался синдром Вольфа-Паркинсона-Уайта, что создавало предпосылки для возникновения жизнеугрожающих состояний.
Синдром Барта (кардиомиопатия с нейтропенией и гипостатурой)
В последнее десятилетие постоянно расширяется реестр митохондриальных болезней. В 1983 году П. Г. Барт и соавторы описали Х-сцепленный рецессивный фенотип, проявляющийся сочетанием скелетной миопатии, кардиомиопатии, задержки роста с нейтропенией в раннем возрасте. Наследование заболевания Х-сцепленное рецессивное. О митохондриальной природе заболевания говорят резко выраженные нарушения строения митохондрий мышечной, сердечной ткани и других органов. Заболевание возникает в раннем возрасте, на 5-7-м месяце жизни. Дети с данной патологией имеют низкий вес при рождении и в дальнейшем инфантильный соматотип (весо-ростовые показатели соответствуют 3-5 центилям), характерно отставание костного возраста от паспортного на 1-2 года. Заболевание манифестирует миопатическим синдромом. Изменения со стороны сердца могут характеризоваться как симметричной гипертрофической, так и дилатационной кардиомиопатией. Именно степень поражения сердечной мышцы определяет тяжесть и прогноз заболевания.
Нами наблюдался мальчик с синдромом Барта. Впервые изменения со стороны сердца были выявлены в 1,5 года в виде симметричной необструктивной гипертрофической КМП. По данным эхокардиографии, толщина межжелудочковой перегородки — 12 мм, задней стенки левого желудочка — 10 мм при норме 5 мм. При обследовании через год отмечено нарастание степени гипертрофии миокарда (толщина задней стенки левого желудочка — 13 мм, толщина межжелудочковой перегородки — 11,8 мм при норме 5,5 мм). На ЭКГ — повышение электрической активности левого желудочка, снижение процесса реполяризации в миокарде (рис 4).
 |
| Рисунок 4. Нарушение метаболизма миокарда, по данным позитронно-эмиссионной томографии при синдроме MELAS. Нормальная перфузия. Накопление FDG18 резко снижено. Снижение активности цикла Кребса. Снижение энергетического метаболизма вне связи с его кровоснабжением |
Основными клиническими симптомами являлись задержка физического (рост Рисунок 5. Карнитиновая ДКМП. ЭхоКГ. Высокий вольтаж QRS, смещение ST, высокий положительный двугорбый Т больше зубца R, гипертрофия желудочков КДДлж= 65 мм, атриомегалия, фракция выброса — 0,20, гипокинез и дискинез, митральная регургитация 2-3-й ст.
Нами наблюдались 2 больных с карнитиновой КМП. Приводим одно из наблюдений. Больной А. 9 лет с карнитиновой недостаточностью, вызвавшей развитие дилатационной кардиомиопатии. В возрасте 7 лет стал жаловаться на повышенную утомляемость, слабость, потливость, появились жалобы на частые боли в животе, выраженный миопатический синдром. Тогда же отмечались признаки недостаточности кровообращения: одышка, сердцебиения, гепатомегалия. При рентгенологическом обследовании выявлено увеличение размеров сердца, в основном за счет левых отделов, КТИ до 56%. По данным ЭКГ, выявлено повышение электрической активности миокарда левого желудочка. В стационаре по месту жительства был поставлен диагноз: ДКМП. Назначено лечение: преднизолон, мочегонные, ККБ и поляризующая смесь. Однако терапия оказалась неэффективной, нарастали явления недостаточности кровообращения. Увеличивалась дилатация левого желудочка, границы сердца расширены влево до переднеаксиллярной линии; на ЭКГ — синусовая тахиаритмия, гипертрофия левых отделов сердца, резко выраженные ишемические нарушения в виде «гигантских» зубцов Т. На ЭхоКГ — расширение полости левого желудочка (КДДлж = 66 мм при норме 41 мм), снижение сократительной способности миокарда (ФВ = 0,32), симметричная гипертрофия стенок левого желудочка (Тзслж = Тмжп = 12 мм при норме 8 мм), легочная гипертензия. УЗИ брюшной полости: гепатомегалия, расширение печеночных вен. На основании выраженного миопатического синдрома, снижения толерантности к физической нагрузке, гепатомегалии, рефрактерной к применению дигоксина и мочегонных препаратов, изменений со стороны сердца в виде сочетания дилатации левого желудочка, снижения контрактильной способности миокарда с явлениями гипертрофии стенок левого желудочка, усиления сигнала от эндокарда и специфических изменений на ЭКГ в виде «гигантских» зубцов Т возникло подозрение о развитии карнитиновой кардиомиопатии (рис. 5). В целях верификации диагноза был определен уровень карнитина в плазме. Он был снижен до 18 ммоль/мл при норме 25 ммоль/мл. В связи с этим в стандартную терапию дигоксином и мочегонными препаратами был подключен L-карнитин (элькар раствор) из расчета 75 мг/кг. На фоне данной терапии состояние значительно улучшилось, уменьшились явления недостаточности кровообращения до 1-й степени, сократились размеры полости левого желудочка (КДДлж уменьшилась с 66 мм до 52 мм), увеличилась контрактильная способность миокарда (фракция выброса выросла с 0,32 до 0,49).
Гистиоцитарная кардиомиопатия
Гистиоцитарная кардиомиопатия впервые была описана Д. Вотом в 1963 году как «арахноцитоз» сердечной мышцы. Было установлено, что гистиоцитарная кардиомиопатия — это типичное клиническое проявление дефицита цитохрома-В [21]. Клиническая симптоматика заболевания проявляется с 3-недельного возраста, как правило, до 1 года, характеризуется внезапным возникновением тахиаритмий (желудочковой или наджелудочковой локализации), частым развитием фибрилляции желудочков. Чаще болеют девочки в соотношении 5:1. Несмотря на интенсивную терапию, больные погибают через несколько недель после начала приступов желудочковой тахикардии. При аутопсии обнаруживаются сочетание гипертрофии миокарда с дилатацией полости левого желудочка, фиброэластоз сердца, при световой микроскопии отмечаются необычные очаги «обесцвеченного» миокарда главным образом в желудочках, в субэндо- и субэпикарде, меньше интрамурально, реже изменения могут наблюдаться и в предсердиях, иногда группы трансформированных клеток встречаются в основании створок митрального, трехстворчатого и аортального клапанов. Эти очаги содержат удлиненные мышечные волокна, похожие на миофибрилы, так называемые гистиоцитоподобные пенистые или онкоцитарные клетки. В цитоплазме гистиоцитоидных клеток содержится большое количество липидов и гликогена. При электронной микроскопии в гистиоцитоидных клетках наблюдается большое количество митохондрий причудливой формы с низким содержанием цитохрома-В.
Приводим клиническое наблюдение больной 1 года 2 месяцев с гистиоцитарной кардиомиопатией. Изменения со стороны сердца характеризовались дилатационной и гипертрофической симметричной необструктивной кардиомиопатией, фиброэластозом эндокарда, синдромом Вольфа-Паркинсона-Уайта, пароксизмальной суправентрикулярной тахикардией.
Гистологическое исследование миокарда выявило крупные комплексы гистиоцитоподобных пенистых клеток с обилием липидных включений в цитоплазме среди пучков нормальных кардиомиоцитов. Наличие липидов указывало на резкое снижение окислительной способности миокарда, на его жировую дистрофию и гипофункцию. Такое состояние свидетельствует о резком снижении активности митохондриальных ферментов и предположительно указывает на наличие врожденной первичной митохондриальной патологии. Таким образом, данное наблюдение демонстрирует развитие кардиомиопатии, сочетающей черты дилатационной и гипертрофической с фатальным нарушением сердечного ритма у ребенка с гистиоцитарной кардиомиопатией. Найденные морфологические изменения в виде большого содержания липидов и гликогена в сердечной мышце, изменения структуры митохондрий в совокупности с литературными данными о дефиците при этой патологии III ферментного комплекса цепи дыхательных ферментов митохондрий позволяют предположить, что данные изменения обусловлены митохондриальной патологией.
Кардиомиопатии при дефиците П-комплекса цепи дыхательных ферментов
Сукцинат-конзимQ-оксиредуктаза является важным ферментным комплексом как цикла трикарбоновых кислот, так и респираторной цепи митохондрий. Комплекс состоит из 4 полипептидов: 2 больших полипептида представляют сукцинатдегидрогеназу и 2 малых — b тип цитохрома. П-комплекс кодируется ядерной ДНК; наследование аутосомно-рецессивное, Х-сцепленное рецессивное или доминантное с неполной пенентрантностью (Ангелини, 1993).
Клинический фенотип дефицита П-комплекса характеризуется прогрессирующей офтальмоплегией, энцефаломиопатией, атаксией, миоклоническими подергиваниями, миопатией и/или энцефалопатией, вторичным дефицитом карнитина, лактат-ацидозом. Изменения со стороны сердца проявляются кардиомиопатией. В 1993 году Ангелини описывал двух братьев с митохондриальной миопатией и гипертрофической кардиомиопатией. У 25-летнего пациента на ЭКГ отмечались желудочковая тахикардия, фибрилляция предсердий, клиника отека легких. Синусовый ритм был восстановлен только на фоне применения верапамила. Отмечалась кардиомегалия. По данным эхокардиографии, обнаружилась необструктивная гипертрофическая кардиомиопатия с преимущественной гипертрофией межжелудочковой перегородки. Отмечались изменения опорно-мышечного аппарата в виде сколиоза, проксимального лордоза, слабости мышц плечевого пояса. Миография подтвердила миогенный паттерн. Второй брат 19 лет предъявлял жалобы на загрудинные боли. В возрасте 8 месяцев у него был отмечен эпилептический приступ. Эхокардиография выявила асимметричную необструктивную КМП, толщина межжелудочковой перегородки составляла 30 мм, задней стенки левого желудочка — 19 мм. В неврологическом статусе отмечены атаксия и гипотония мышц плечевого пояса. Электромиография подтвердила миогенный паттерн. У матери этих пациентов также выявлен миогенный паттерн, по данным электромиографии. Анализ mt-ДНК не выявил значимых изменений. При биопсии мышцы выявлены ragged-red волокна, отложения липидов. Структура митохондрий нарушена: дезориентация в расположении крист. Гистоферментный анализ биоптатов скелетной мышцы установил снижение активности сукцинатдегидрогеназы на 35% по сравнению с нормой и сукцинат-цитохромС-редуктазы на 47% по сравнению с контролем. Уровень карнитина был нормальным в первом наблюдении и сниженным до 62% от нормы во втором.
Под нашим наблюдением находился больной с гипертрофической симметричной кардиомиопатией, необструктивной формой со вторичной дилатацией левого желудочка на фоне выраженной миокардиальной дисфункции, с распространенным кардиосклерозом, рефрактерной сердечной недостаточностью НК Пб Ш ст., недиференцированным объемным образованием в полости левого желудочка (тромб), диффузными дистрофическими изменениями в печени, задержкой физического и психического развития, которые обусловлены системной митохондриальной патологией.
Мальчик родился массой 3400 г, длиной 52 см, закричал сразу с оценкой по Апгар 8/8. Раннее развитие без особенностей. Манифестация заболевания относится к 9 годам, когда появились жалобы на повышенную утомляемость, нарушения походки. Отмечались задержка физического и психического развития, головные боли. На фоне перенесенного ОРВИ отмечены резкое снижение физической активности, отсутствие аппетита, миопатический синдром, резкое снижение массы тела, состояние продолжало ухудшаться, появились симптомы недостаточности кровообращения П Б степени. На ЭКГ — признаки гипертрофии левого желудочка, блокада передней левой ножки пучка Гиса, ишемические изменения в миокарде. На ЭхоКГ — симметричная гипертрофия миокарда, митральная регургитация 2-й степени, дилатация полости левого желудочка, снижение сократительной способности миокарда (Тзслж = Тмжп = 28, КДД ЛЖ = 47 мм, ФВ = 0,40). Косвенные признаки легочной гипертензии — расчетное давление в полости правого желудочка 60 мм рт. ст., объемное образование в полости левого желудочка (тромб) (рис. 6). Присоединение выраженной миокардиальной дисфункции у ребенка с ГКМП привело к резкому снижению сократительной способности миокарда и развитию дилатационной кардиомиопатии. Учитывая инфантильный соматотип ребенка, отставание в физическом и психическом развитии, выраженную гепатомегалию, рефрактерную к проводимой терапии, миопатический синдром, было выдвинуто предположение о миторхондриальном генезе заболевания. В терапию на фоне мочегонных препаратов были включены капотен, предуктал, эссенциале, аплегин. На этом фоне состояние несколько улучшилось, уменьшилась тахикардия, одышка, печень сократилась до 4 см. Гистоферментный анализ биоптатов скелетной мышцы выявил значительное снижение сукцинат-цитохромС-редуктазы — на 43% по сравнению с контролем.
 |
| Рисунок 6. Аномалия 2-го комплекса цепи дыхательных ферментов. ЭхоКГ. Концентрическая симметричная гипертрофия миокарда Тзслж = Тмжп = 28, митральная регургитация 2-й ст., дилатация полости левого желудочка, снижение фракции выброса (ФВ = 0,40) |
Разработаны диагностические критерии, позволяющие предположить развитие кардиомиопатий, связанных с энергетической несостоятельностью митохондрий.
Экстракардиальными критериями являются:
Особенностями кардиомиопатий, протекающих на фоне первичной митохондриальной патологии, являются:
По вопросам литературы обращайтесь в редакцию
