метасиликат натрия что это такое
Силикат натрия, применение в промышленности
Силикат натрия — это натриевая соль кремниевой кислоты. Входит в состав пищевых продуктов в качестве эмульгатора как добавка Е550.
Силикат натрия — распространенное в природе вещество.
Силикат натрия известен под названием жидкое стекло.
Является составной частью различных минералов, почв, полевого шпата.
Химическая формула Na2SiO3.
Виды силикатов натрия:
В лабораторных условиях жидкое стекло было в первый раз получено немецким профессором минералогии и химии Непомуком фон Фуксом в 1818 году.
Химико-физические свойства жидкого стекла
Силикат натрия представляет собой порошок белого цвета, не имеет вкуса и запаха.
Жидкое стекло растворимо в холодной воде, образует густой коллоидный раствор. Водные растворы силиката натрия имеют сильную щелочную реакцию. Выпариванием жидкости из раствора силиката натрия получают твердое аморфное вещество. Из перенасыщенного раствора жидкого стекла получают гидрофильный сорбент — силикагель.
Водный густой раствор силиката натрия имеет свойство при нагревании до трехсот градусов увеличивать свой объем в восемь раз.
Производство силиката натрия
На предприятиях жидкое стекло получают в результате химической реакции гидроксида натрия с диоксидом кремния, которая происходит при температуре в 1000 градусов Цельсия. Другие способы получения жидкого стекла состоят в кристаллизации расплавов из стекол или осаждении из газовой фазы и растворов, содержащих силикат натрия.
Где используется жидкое стекло
Силикат натрия применяют во многих сферах производства:
Силикат натрия используют в лакокрасочном и бумажном производстве. Кроме того, из жидкого стекла делают цемент, бетон, многие строительные смеси.
Силикаты натрия — это не что иное, как водный и втоже время щелочной раствор силикатов натрия или жидкое стекло.
Силикат натрия в стиральном порошке
Натрия силикат является заменителем фосфатов в стиральных порошках и служит для смягчения воды. Он значительно повышает эффективность и качество стирки, препятствует отложению солей на внутренних конструкциях стиральных машин. Силикат натрия — защелачивает раствор и способствует удержанию частиц грязи в растворе во взвешенном состоянии
Силикат натрия входит в состав некоторых стиральных порошков.
Вред силиката натрия
Вредное воздействие силиката натрия мы можем ощутить в двух случаях:
Силикат натрия может вызывать аллергические реакции при употреблении внутрь или при взаимодействии с кожей.
В группе риска люди, склонные к аллергии и маленькие дети. В некоторых странах пищевая добавка Е550 запрещена в продуктах питания.
Вредное воздействие на организм жидкого стекла еще недостаточно изучено.
Чтобы минимизировать возможный вред для здоровья, желательно выбирать продукты питания, стиральные порошки и косметику без силиката натрия.
Для стирки детских вещей рекомендуем использовать детский стиральный порошок без химии.
метасиликат натрия
Стекло в состоянии жидкости или зачастую используемая в производстве добавка для пищевых продуктов Е550 и представляет собой метасиликат натрия.
Получение такого вещества изначально было осуществлено в начале 1818 года в германии. Авторство получение вещества принадлежит немецкому химику Яну Непомук фон Фуксу.
Такому соединению характерно широкое распространение в природных условиях. Содержание силикатов зафиксировано в части равной чуть меньше половины группы, объединяющей все известные соединения минеральных веществ, а именно:
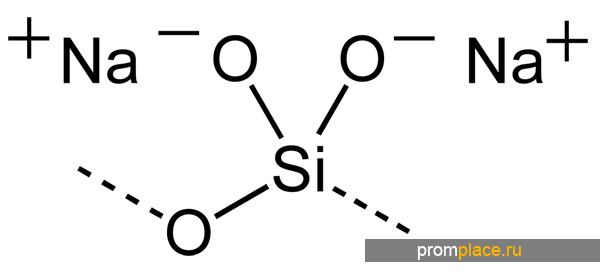
В уравнениях химических реакций метасиликат натрия принято обозначать с помощью следующей молекулярной формулы:
Na2SiO3.
Использование данной формулы актуально для безводного метасиликата натрия или иначе называемого типичным.
Краткая характеристика вещества
Разновидности силикатов
Любая натриевая соль кремниевых кислот, обозначаемая формулой общего типа, на практике и представляет собой силикат натрия.
В общей формульном выражении соединения mNa2O*nSiO2, где определяются отношения чисел молекул SiО2 и Na2О, такое соотношение величин получило название кремнеземного модуля. Смысл такого модуля в том, чтобы точно определять степень растворимости и иные явно выраженные свойства натриевых силикатов.
Колебания значений модуля, как правило, находятся в пределах показателей:
Натрия метасиликат встречается в 2 – х вариантах кристаллической формы:
Натрия метасиликат отображается в химических уравнениях и реакциях формульным выражением:
Основные реакции Nа2SiОЗ
Бороться с нежелательными последствиями и возникновением реакций последнего случая можно с помощью правильно подобранной упаковки вещества, главным критерием отбора которой является ее повышенная непроницаемость в отношении водяного пара и воздушных поступлений.
Также стекло в жидком состоянии отличается хорошо протекающей сильной щелочной реакцией. Это объясняется протеканием их гидролиза, где образуются гидроксид – ионы:
Nа2ОSiО2 + 2Н2О = 2Nа+ +SiО2*Н2О + 2ОН
Способы получения в промышленности
Метасиликат натрия пятиводный доступно получить при осуществлении метода, основой которого является изогидрическая кристаллизация кремнеземистых щелочных растворов.
Основным способом, обеспечивающим гарантированное получение кристаллизованных гидратов в отношении натрия метасиликата пятиводного, шестиводного, девятиводного, является обеспечение успешного протекания следующей реакции:
SiО2 + NаСО3 = NаSiО3 + СО2
Сферы применения натрия метасиликата
Вещество Na2SiO3 широко применяется в следующих производственно – промышленных областях:
Требования к безопасности использования вещества
Метасиликат натрия как пятиводный, так и шести-, девятиводный не представляет опасности в отношении провоцирования взрывов. Следовательно особые повышенные требования к соблюдению пожарной техники безопасности не предъявляются.
Степень воздействия и влияния вещества на человеческий организм позволяет отнести Na2SiO3 к группе веществ II класса опасности.
Правила при транспортировке
При транспортной перевозке натрия метасиликата обязательно наличие маркировочного символа в соответствии с ГОСТ – 14192, где подразумевается нанесение знаков, указывающих на ограждение вещества от влияния влаги и исключение контактов с кожными покровами и слизистыми оболочками.
Виды упаковки и меры хранения
В случае упаковки метасиликата натрия, как правило, используются:
Вне зависимости от того, у кого приобретается продукция, каждому покупателю следует обратить внимание на качество и соответствие метасиликата натрия установленным требованиям.
Метасиликат натрия
| Метасиликат натрия | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Метасиликат натрия; силикат натрия |
| Традиционные названия | Кремнекислый натрий |
| Химическая формула | Na2SiO3 |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветные или белые кристаллы |
| Молярная масса | 122,06 г/моль |
| Плотность | 2,4; 2,61 г/см³ |
| Термические свойства | |
| Температура плавления | 1088; 1089 °C |
| Энтальпия образования (ст. усл.) | −1535 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 18,8 20 ; 92,3 90 г/100 мл |
| Оптические свойства | |
| Показатель преломления | 1,52 |
| Классификация | |
| Рег. номер CAS | 6834-92-0 |
| Рег. номер PubChem | 23266 |
| SMILES | [Na+].[Na+].[O-][Si]([O-])=O |
| Регистрационный номер EC | 229-912-9 |
| RTECS | VV9275000 |
Метасиликат натрия — неорганическое соединение, соль щелочного металла натрия и метакремниевой кислоты с формулой Na2SiO3, бесцветные или белые кристаллы, растворяется в холодной воде, образует кристаллогидрат.
Содержание
Получение
Физические свойства
Метасиликат натрия образует бесцветные или белые кристаллы ромбической сингонии, пространственная группа C cm2, параметры ячейки a = 0,6078 нм, b = 1,053 нм, c = 0,4825 нм, Z = 4.
Хорошо растворим в холодной воде, концентрированные растворы образуют коллоидный раствор «жидкое стекло» гидрозоля SiO2•n H2O.
Из водных растворов выделяется кристаллогидрат Na2SiO3•9H2O, который плавится при 47°С в собственной кристаллизационной воде и начинает разлагаться при температуре выше 100°С.
Разлагается в горячей воде.
Химические свойства
Применение
Литература
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | — | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Полезное
Смотреть что такое «Метасиликат натрия» в других словарях:
МЕТАСИЛИКАТ НАТРИЯ — разновидность силикатов натрия … Металлургический словарь
метасиликат натрия — метакремнекислый натрий, кремнекислый натрий … Cловарь химических синонимов I
Метасиликат калия — Общие Систематическое наименование Метасиликат калия; силикат калия Традиционные названия Кремнекислый калий Химическая формула K2SiO3 Физические свойства … Википедия
Натрия фосфаты — Известны следующие фосфаты натрия: Дигидрофосфат натрия NaH2PO4 Гидрофосфат натрия Na2HPO4 Ортофосфат натрия Na3PO4 Применение Употребляются для буферных растворов различного назначения, как эмульгаторы в пищевой промышленности … Википедия
Метасиликат марганца(II) — Общие Систематическое наименование Метасиликат марганца(II) Традиционные названия Кремнекислый марганец Химическая формула MnSiO3 Физические свойства … Википедия
натрия метасиликат — natrio metasilikatas statusas T sritis chemija formulė Na₂SiO₃ atitikmenys: angl. sodium metasilicate rus. натрий метакремнекислый; натрия метасиликат ryšiai: sinonimas – dinatrio trioksosilikatas … Chemijos terminų aiškinamasis žodynas
НАТРИЯ СИЛИКАТЫ — соли к т кремния. Бесцв. кристаллы или стеклообразные в ва. Известны: метасиликат Na2SiO3, ортосиликат Na4SiO4, пиросиликат Na6Si2O7, a также пентаоксодисиликат Na2Si2O5, октаоксотрисиликат Na4Si3O8, гептаоксотрисиликат Na2SiO3, октасиликат… … Химическая энциклопедия
Гексафторосиликат натрия — Общие Систематическое наименование Гексафторосиликат натрия Химическая формула Na2[SiF6] Физические свойства Состояние (ст. усл.) Бесцвет … Википедия
Ортосиликат натрия — Общие Систематическое наименование Ортосиликат калия; силикат калия Традиционные названия Кремнекислый калий Химическая формула Na4SiO4 Физические свойства … Википедия
Гексагидроксоплюмбат(IV) натрия — Общие Систематическое наименование Гексагидроксоплюмбат натрия Химическая формула Na2[Pb(OH)6] Физические свойства Состояние (ст. усл.) … Википедия
Натрий метасиликат — понятие, свойства, интересные факты
Натрий метасиликат — неорганическое соединение, натриевая 
Информация о растворимых натриевых стеклах встречается уже в XVI веке в трудах алхимиков, но химически грамотный анализ реактива и способ его производства был разработан в Германии в начале ХХ века. В 1828 году был построен первый завод по изготовлению растворимого силикатного стекла.
Белый порошок с бесцветными кристалликами, без запаха. Технический продукт может быть сероватым или с желтоватым оттенком. Активно поглощает из воздуха влагу и углекислоту. Хорошо растворяется в воде при комнатной температуре, образует кристаллогидраты с пятью и девятью молекулами воды. Разлагается при нагревании и в горячей воде. Вещество не слеживается при хранении, кристаллики механически прочные (не образует пылеобразного порошка).
 |  |
| Натрий метасиликат 5-водный | Натрий метасиликат безводный |
Водный раствор является выраженно щелочным. Реактив взаимодействует с кислотами и щелочами, углекислым газом. Взаимодействие водного раствора с кислотами приводит к выделению гелеобразной кремниевой кислоты. Концентрированные растворы образуют густую жидкость — коллоидный раствор, натриевое жидкое стекло.
— Знаменитая компания Henkel, известная своей бытовой химией, начиналась с завода по изготовлению стирального порошка на основе силиката натрия. Завод был основан в 1876-м году Ф. Хенкелем. До сих пор в стиральных порошках компании Henkel обязательным ингредиентом является силикат натрия.
— Силикаты входят в состав многих камней, 
— Любопытно, что раствор метасиликата натрия в небольшой концентрации — идеальная среда для хранения свежих яиц. В этом растворе их можно хранить более девяти месяцев в нормальных условиях, при комнатной температуре.
— Силикаты натрия часто используют для обработки декораций для театров и киностудий. Пропитанные этим веществом деревянные конструкции практически не горят.
— Всем известный канцелярский клей мгновенного схватывания — это раствор метасиликата натрия.
— Если вам нужно починить дома фарфоровую или стеклянную статуэтку, плафон, декоративную тарелку (не пищевую!) или вазу, воспользуйтесь простым и доступным составом. Смешайте растолченный мел с жидким стеклом (канцелярским клеем) до густоты сметаны и сразу используйте. Смесь быстро застывает и дает прочное соединение. Шов будет белого цвета. Смесью жидкого стекла и цемента можно склеивать камни.
Из следующей статьи вы узнаете о хранении метасиликата натрия, мерах предосторожности при работе с ним, и о сферах его применения.
Натрий метасиликат — востребованный в промышленности и строительстве реактив
Вторая статья о метасиликате натрия. Первую статью, в которой рассказывается об основных особенностях и свойствах реактива, и в которой приводятся инетерсные факты о нем, можно прочитать здесь.
Реактив относится ко второму классу опасности. Разъедает кожу 
Хранить натрий метакремнекислый следует в сухих помещениях в герметичной таре, защищенной от попадания влаги и воздуха. В противном случае, в результате поглощения углекислоты из воздуха вещество постепенно разлагается с выделением нерастворимой кремниевой кислоты. Транспортировать натрий метасиликат можно автомобильным и железнодорожным транспортом, в том числе и навалом. В последнем случае следует принять меры, чтобы защитить продукт от влаги. Фасуют реактив, как правило, в герметично запаянные пластиковые водостойкие мешки, которые для надежности помещают во внешние тканевые или многослойные бумажные мешки.
В лабораториях растворы реактива хранят в стеклянных бутылях, герметично укупоренных резиновой или силиконовой пробкой. Пробковые и стеклянные пробки могут очень прочно приклеиться к горловине.
 |  |  |
| Пробка резиновая | Стекло жидкое натриевое | Пробка силиконовая |