метаболическая кардиомиопатия что это такое лечение
Кардиомиопатия при метаболических нарушениях (I43.1*)
Версия: Справочник заболеваний MedElement
Общая информация
Краткое описание
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
AL-амилоидоз включает:
— первичный идиопатический амилоидоз;
— амилоидоз при множественной миеломе;
— амилоидоз при В-клеточных опухолях;
— амилоидоз при болезни Вальденстрема.
Предшественником AL-амилоидоза служат легкие цепи моноклонального Igλ и Х-типов.
Основные органы-мишени: желудочно-кишечный тракт (ЖКТ), сердце, почки.
ATTR-амилоидоз включает:
— семейную амилоидную полинейропатию;
— семейную амилоидную кардиопатию;
— старческий амилоидоз (у лиц, старше 70 лет).
Аβ2М-диализный амилоидоз является новой формой системного амилоидоза.
Аβ-амилоидоз развивается при болезни Альцгеймера, иногда регистрируются семейные случаи.
Варианты старческого амилоидоза сердца:
— диффузные интерстициальные фибриллярные отложения в миокарде;
— мультифокальный массивный амилоидоз миокарда;
— диффузный (интерстициальный, сетчатый, псевдогипертрофический) кардиальный амилоидоз коронарных артерий (мультинодулярный стенозирующий коронарный амилоидоз);
— амилоидоз аорты.
Этиология и патогенез
Амилоидная кардиопатия развивается при первичной (идиопатической) системной семейной кардиопатической и старческой формах амилоидоза.
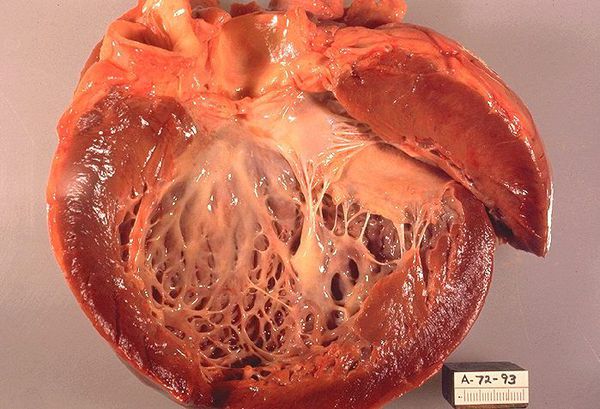
При первичном амилоидозе амилоид наиболее часто откладывается вокруг коллагена в строме органа, вследствие этого миокард утолщается и уплотняется («резиновый» миокард), иногда не спадается на вскрытии. Эти свойства миокарда являются причиной резкого снижения его податливости. Кардиопатический амилоидоз является типичным вариантом рестриктивной кардиомиопатии.
При первичном амилоидозе увеличение массы миокарда в некоторых случаях бывает настолько выраженным, что на вскрытии сердце занимает большую часть грудной клетки. Отложения амилоида делают миокард ригидным, но полости желудочков не дилатированы, зато предсердия резко расширены, в результате чего сердце на рентгеновском снимке имеет форму «боксерской перчатки». В результате резкого утолщения стенок сердца, оно внешне несколько напоминает гипертрофическую кардиомиопатию.
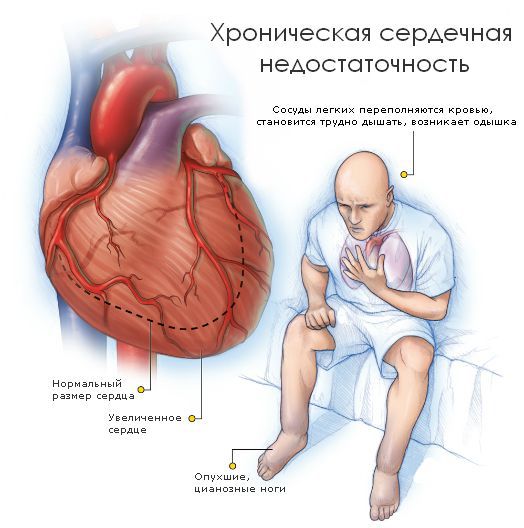
У пациентов с кардиопатическими формами идиопатического или семейного амилоидоза, развивается хроническая сердечная недостаточность (при нерасширенных желудочках сердца) вследствие невозможности адекватного расслабления желудочков в диастолу.
У некоторых пациентов амилоид откладывается на клапанах сердца, что вызывает регургитацию потока крови, которая клинически проявляется систолическим шумом. Как результат в обоих желудочках возникают резкое повышение конечного дистолического давления, снижение сердечного выброса, а в дальнейшем и снижение сократимости левого желудочка.
Эпидемиология
Факторы и группы риска
— у пациентов с хронической сердечной недостаточностью, рефрактерной к стандартному медикаментозному лечению.
Клиническая картина
Cимптомы, течение
Диагностика
ЭхоКГ-признаки при амилоидозе сердца:
1. Дилатация верхней и нижней полых, печеночных и легочных вен. Инспираторный коллапс нижней полой вены, присутствующий в норме, может быть резко снижен или отсутствует.
2. Маленькие полости желудочков при большом размере предсердий.
3. Снижение скоростей потока в печеночных венах на вдохе и реверсия диастолического потока на вдохе.
4. Увеличение конечно-диастолической толщины межжелудочковой перегородки (МЖП) ≥ 12 мм при отсутствии каких-либо иных причин гипертрофии (артериальная гипертензия, аортальный стеноз).
5. Гомогенное утолщение атриовентрикулярных клапанов (часто сопровождается небольшой регургитацией).
6. Диффузное утолщение других стенок сердца, включая стенку правого желудочка и межпредсердную перегородку.
ЭКГ-изменения при амилоидозе сердца:
— низкий вольтаж без специфических изменений реполяризации или сочетание низкого вольтажа и эхокардиографических признаков большой массы миокарда;
— патологические зубцы Q, «симулирующие» инфаркт миокарда;
— аритмии и нарушения проводимости.
Радиоизотопная диагностика амилоидоза сердца показывает значительное повышение накопления изотопа в миокарде.
Лабораторная диагностика
При амилоидозе специфические лабораторные изменения отсутствуют.
Характерны значительно повышение СОЭ (50-70 мм/ч) и анемия (в ряде случаев отмечаются гиперфибриногенемия, тромбоцитоз).
Применяются специальные пробы на амилоид (с конгорот, метиленовой синью, которые в норме изменяют окраску мочи, но у больных амилоидозом они фиксируются амилоидом и выводятся с мочой в минимальных количествах) и электрофоретическое исследование белков мочи.
Дифференциальный диагноз
3. Идиопатическая рестриктивная кардиомиопатией (эндомиокардиальная болезнь). Дифференциация основана на типичных отличиях морфофункционального состояния левого желудочка по данным ЭхоКГ и характера нарушений его диастолического наполнения при радионуклидной вентрикулографии и катетеризации сердца. В обоих случаях важным диагностическим значением обладает выявление внесердечного амилоидоза.
Лечение
Затруднено лечение ХСН у больных АL-амилоидозом. Это связано с повышенной чувствительностью к сердечным гликозидам, усугублением ХСН на фоне приема ингибиторов кальциевых каналов и развитием угрожающих жизни нарушений проводимости при назначении бета-адреноблокаторов. По сути лечение сводится к назначению массивных доз мочегонных средств.
При синдроме слабости синусового узла малоперспективно применение искусственного водителя ритма, поскольку пациенты могут погибнуть от прочих нарушений ритма и проводимости.
В настоящее время для лечения амилоидной кардиомиопатии начинают применять трансплантацию сердца.
Что такое кардиомиопатия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Кузнецова Т. Н., кардиолога со стажем в 26 лет.
Определение болезни. Причины заболевания
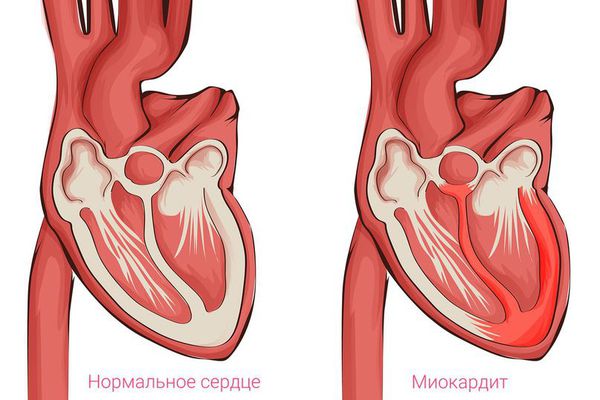
Пусковым механизмом возникновения кардиомиопатии поначалу считали процесс воспаления в сердце, который мог быть спровоцирован вирусными, бактериальными и аутоиммунными повреждениями клеток. Исходя из этой теории, назначение антибиотиков, противовирусных и противовоспалительных препаратов должно было привести к регрессии повреждения и восстановлению функции сердца. Однако практика это не подтвердила.
Риск развития кардиомиопатий повышен у лиц с отягощённой наследственностью, а также после перенесённых острых инфекционных заболеваний. Для появления вторичных кардиомиопатий важно наличие системных аутоиммунных заболеваний, эндокринной патологии (сахарный диабет, тиреотоксикоз) и токсических факторов.
Первичные кардиомиопатии чаще выявляют в детском и молодом возрасте, вторичные же возможны в любом возрасте.
Симптомы кардиомиопатии
Специфических, характерных только для кардиомиопатии симптомов не существует. Именно эта особенность и затрудняет раннюю диагностику заболевания. Кардиомиопатия длительно протекает бессимптомно или малосимптомно, в развёрнутой стадии похожа по клинике на проявления ишемической болезни сердца, различных пороков сердца.
Первыми жалобами, с которыми пациенты обращаются к врачу, являются:
Патогенез кардиомиопатии
За последние годы благодаря возможностям генетики было установлено, что причиной многих кардиомиопатий являются генетические мутации, которые приводят к выработке дефектных белков кардиомиоцита. От того, какой белок рабочей клетки миокарда (кардиомиоцита) изменился, зависит развитие определённого вида кардиомиопатии.
Подобные изменения бывают также при наследственных нарушениях обмена веществ и лизосомальных болезнях накопления (редких заболеваниях, при которых нарушается функция внутриклеточных органелл лизосом). Из-за врождённой нехватки ферментов, перерабатывающих углеводсодержащие продукты, в организме накапливаются крупные молекулы гликогена, гликопротеина и др., которые повреждают организм. Таких заболеваний известно более сотни, но их распространённость невелика. Как правило, проявляются они в детском и молодом возрасте и помимо поражения сердца затрагивают практически весь организм: кости, мышцы, нервную систему, зрение и слух. Самыми изученными болезнями накопления являются гемохроматоз, болезнь Пике и болезнь Фабри.
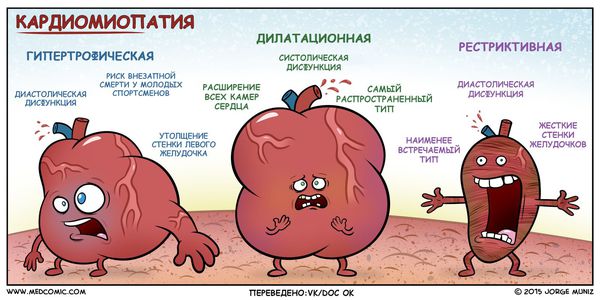
Классификация и стадии развития кардиомиопатии
По мере накопления информации были выявлены самые распространённые типы кардиомиопатии и их семейные формы:
К редким формам кардиомиопатии относят также системные заболевания и патологические состояния, при которых возникают так называемые вторичные кардиомиопатии: диабетическая, тиреотоксическая, алкогольная, аутоиммунная и другие.
Исходя из причины развития болезни, становится ясным, что кардиомиопатии могут быть как изолированными – первичными, так и являться частью системного заболевания, т. е. быть вторичными.
В России традиционно применяется клинико-морфологическая классификация первичных кардиомиопатий, где кардиомиопатии разделяются на:
Анатомическая классификация гипертрофической кардиомиопатии в зависимости от локализации:
I. Гипертрофия левого желудочка:
В зависимости от наличия обструкции выносного тракта левого желудочка (область между межжелудочковой перегородкой и передней створкой митрального клапана) в покое и при нагрузке выделяют два типа гипертрофической кардиомиопатии :
К тяжело выявляемым видам относится аритмогенная дисплазия правого желудочка, при которой происходят структурные изменения в строении стенки правого желудочка — замещение кардиомиоцитов фиброзно-жировой тканью и развитие аритмии.
Неклассифицируемые кардиомиопатии: некомпактный миокард, стресс-индуцированная кардиомиопатия.
Вторичные (специфические) кардиомиопатии: при имеющемся известном заболевании тяжесть поражения сердца более выражена и не соответствует причине:
Осложнения кардиомиопатии
Особенности течения кардиомиопатии представляют угрозу для жизни. Болезнь может дебютировать сразу внезапной смертью или жизнеугрожающими аритмиями : фибрилляцей желудочков, желудочковой тахикардией. Высокий риск внезапной сердечной смерти связан с такими факторами риска, как:
С утяжелением недостаточности все симптомы становятся более выраженными. Выделяют пять стадий сердечной недостаточности:
Диагностика кардиомиопатии
Особых признаков, характерных для этого заболевания, при сборе жалоб и осмотре пациента выявить не удаётся.
При клиническом осмотре обращают на себя внимание признаки сердечной недостаточности различной степени выраженности, аритмии, возможны тромбоэмболические осложнения.
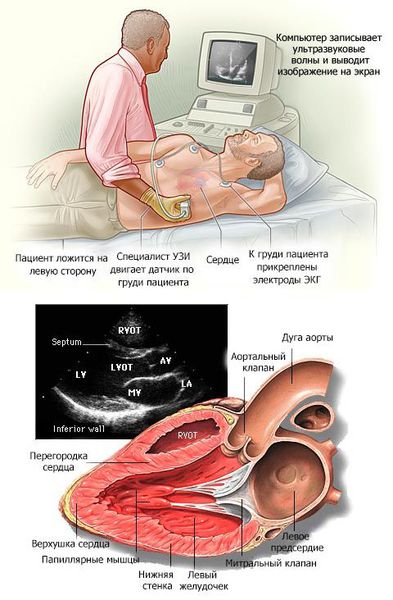
В основном кардиомиопатии выявляются при проведении эхокардиографии (ЭХОКГ) и электрокардиографии (ЭКГ). Дополнительно применяются рентгеноконтрастная вентрикулография и магнитно-резонансная томография (МРТ) с контрастированием гадолинием.
В современной кардиологии всё больше распространяются новые методы визуализации сердца и сосудов — например, магнитно-резонансная томография (МРТ). Но её недостатком является дороговизна оборудования и малая доступность методики из-за отсутствия качественного оборудовании и специалистов.
На стандартной ЭКГ также могут быть зарегистрированы изменения в виде признаков гипертрофии миокарда левого желудочка, а также признаки его перегрузки и различные нарушения ритма сердца.
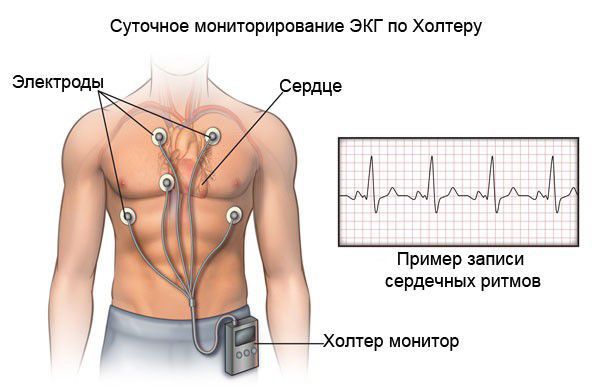
При холтеровском мониторировании ЭКГ также фиксируются нарушения ритма и проводимости практически в 100 % случаях. Выявление таких нарушении ритма сказывается на подборе базисной терапии кардиомиопатии.
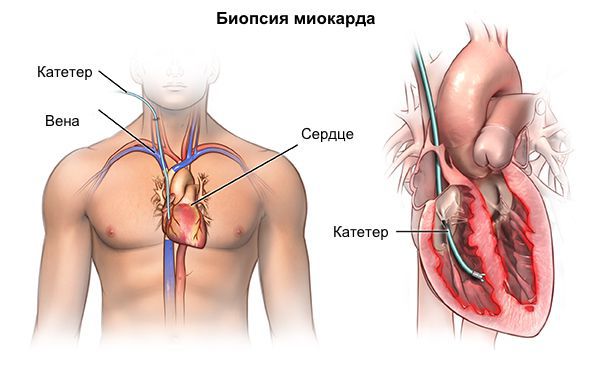
В особых случаях для уточнения диагноза редких форм кардиомиопатии (например, при амилоидозе) возможна прижизненная биопсия миокарда. Методика инвазивная, потенциально опасная для пациента, требует использования уникального комплекса аппаратуры и высочайшей квалификации специалистов, что возможно только в нескольких научных кардиологических центрах РФ.
Из лабораторных методов диагностики помимо стандартных анализов крови (клинического и биохимического), необходимо отметить ДНК-диагностику. Она является «золотым стандартом» при подозрении на кардиомиопатию согласно мировым (европейским и американским) руководствам. Этот подход на данный момент является практически единственным, который применим для раннего выявления и прогнозирования риска развития семейных форм кардиомиопатии. В России такой уровень диагностики возможен в единичных лабораториях и является дорогостоящей процедурой из-за своей уникальности.
Лечение кардиомиопатии
По современным представлениям стратегия лечения пациента определяется в процессе разделения больных на категории в зависимости от типа кардиомиопатии.
Все больные с выявленной кардиомиопатией, независимо от течения заболевания (в том числе и бессимптомные), нуждаются в динамическом наблюдении. Кратность наблюдения и объём обследований определяются индивидуально. В обязательный перечень входят стандартные анализы (клинический и биохимический анализ крови), ЭКГ, ЭХОКГ и холтеровское мониторирование ЭКГ.
Лечебная тактика зависит от множества факторов и подбирается индивидуально. При этом учитываются анатомические особенности — обструкция выносного тракта левого желудочка, растяжение полостей сердца, наличие клапанной патологи, стадия сердечной недостаточности и также сопутствующие заболевания. Необходимо выявлять факторы, повышающие риск внезапной смерти и жизнеугрожающих аритмий [15]
При дилатационной кардиомиопатии необходимо лечить причину развития растяжения полостей сердца, если это возможно. В медикаментозной терапии сердечной недостаточности применяют все стандартные группы лекарств:
Помимо лекарств в ряде случаев прибегают к хирургическим методам лечения кардиомиопатии.
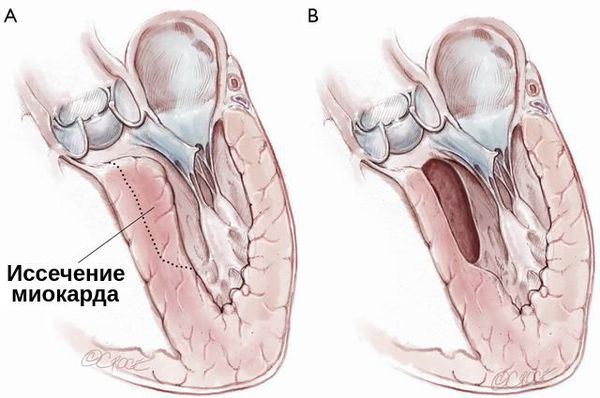
При гипертрофической кардиомиопатии применяется септальная миэктомия — иссечение миокарда, расположенного в основании межжелудочковой перегородки. Она может быть дополнена и вмешательством на изменённом митральном клапане: вальвулопластикой, протезированием митрального клапана и коррекцией кольца митрального клапана.
При тяжёлой обструктивной гипертрофической кардиомиопатии рассматривается проведение операции — иссечения части сердечной мышцы или более щадящая методика — чрескожная транслюминальная алкогольная абляция. При ней через катетер вводится до 3 мл 96 % спирта в зону максимальной гипертрофии миокарда и вызывается его инфаркт. Из-за этого мышца уменьшается в размере, исчезает препятствие (обструкция) току крови через митральное кольцо. Далее проводится установка кардиостимулятора для синхронизации работы всех отделов сердца. Эта процедура проводится кардиохирургами в специализированных отделениях.
Прогноз. Профилактика
Прогноз при гипертрофической кардиомиопатии также неблагоприятный, но смертность не такая высокая — в первый год умирают 1 % заболевших, чаще от внезапной смерти, обусловленной факторами риска (наследственностью, тахикардией, предшествующим обмороками, понижением давления).
При рестриктивной кардиомиопатии прогноз неблагоприятный, так как заболевание часто находят уже на поздней стадии развития. Лечение только симптоматическое и поддерживающее.
Для человека с выявленной кардиомиопатии частота посещений и обследований устанавливается индивидуально.
Диагностика и лечение метаболических кардиомиопатий, возникающих при нарушениях обмена жирных кислот, у детей
Рассмотрены причины метаболических кардиомиопатий (КМП), возникающих на фоне нарушений обмена жирных кислот. Выделены экстракардиальные и кардиальные критерии диагностики. Ранняя диагностика позволяет своевременно начать специфическое лечение, направленно
Are examined the reasons for metabolic cardiomyopathy (KMP), disturbances of the exchange of fatty acids appearing against the background. The extracardial and cardiac criteria of diagnostics are listed. Early diagnostics makes it possible to begin the specific treatment in proper time, directed toward the correction of metabolic disorders.
Кардиомиопатии (КМП) — гетерогенная группа заболеваний сердца, характеризующихся структурной перестройкой миокарда, с непрерывно прогрессирующим течением и неблагоприятным прогнозом. В большинстве случаев диагностика КМП основывается на клинических симптомах и данных функционального обследования, в первую очередь эхокардиографии [1–3]. При этом истинная этиология КМП не всегда устанавливается. По данным наиболее крупного регистра КМП у детей США и Канады среди группы, в которой причина КМП была установлена, в 29,1% был диагностирован миокардит, в 24,2% — семейная изолированная КМП, в 22,2% — нейромышечные заболевания, в 15,4% — врожденные нарушения метаболизма и в 8,8% — различные генетические синдромы [3–6].
Причинами метаболических КМП являются врожденные нарушения обмена веществ или нарушения функции органелл клетки. Нарушения метаболизма жирных кислот являются наиболее частой причиной развития метаболических КМП. По данным педиатрического регистра при гипертрофических КМП в 20% случаев выявлены нарушения транспорта карнитина или дефекты окисления жирных кислот, нарушения окислительного фосфорилирования [7]. При дилатационных КМП дефекты транспорта карнитина/нарушения оксидации жирных кислот встречаются в 40% [8]. Наследственные дефекты обмена жирных кислот являются причиной не менее 5% случаев внезапной детской смерти [9].
Нарушения метаболизма жирных кислот могут возникать вследствие дефицита карнитина, нарушения транспорта карнитина при недостаточности ферментов, обеспечивающих перенос соединений карнитина, а также при дефектах оксидации жирных кислот [10].
Дефицит карнитина можно определить как дефицит внутриклеточного содержания карнитина, при котором концентрация карнитина в плазме менее 20 мкмоль/л, а содержание карнитина в тканях менее 20% от нормы. В зависимости от причины дефицита карнитина выделяют первичный дефицит карнитина, возникающий при генетически детерминированных дефектах метаболизма карнитина, и вторичный дефицит карнитина, связанный с нарушением обмена органических кислот, дефицитом ацил-КоА-дегидрогеназ, дефектами в цепи дыхательных ферментов митохондрий, рядом соматических заболеваний и патологических состояний [11].
Первичный дефицит карнитина может проявляться в двух формах: системной [13, 14] и мышечной [11, 16]. Системный дефицит карнитина обусловлен мутацией гена SLC22A5, локализованного на длинном плече 5-й хромосомы (5q319), продуктом которого является белок, переносящий карнитин (OCTN2). Результатом этой мутации является дефицит карнитина в тканях. Заболевание наследуется по аутосомно-рецессивному типу [13–14]. При гомозиготной форме сроки манифестации заболевания варьируют от 1 месяца до 7 лет, в среднем 2 года. При гетерозиготной форме манифестация заболевания возникает в подростковом возрасте [14–16].
При раннем дебюте заболевания первыми признаками являются отказ от кормления, раздражительность, низкая прибавка в весе, отставание в физическом и психомоторном развитии. Характерным признаком является гипокетотическая гипогликемическая энцефалопатия (вялость, сонливость, повторная рвота), имеющая приступообразное течение. Во время гипогликемического криза возникают общая слабость, тахикардия, церебральная дисфункция (повышенная возбудимость, раздражительность). В дальнейшем развиваются гепатомегалия, стеатоз печени, нарушения желудочно-кишечного тракта (боли в животе, диарея), скелетная миопатия (мышечная слабость, гипотония), синдром Рейе. Как правило, дети часто болеют интеркуррентными заболеваниями: инфекционные заболевания верхних дыхательных путей и острый гастроэнтерит. У ряда пациентов возникает гипохромная анемия. Тяжесть заболевания варьирует от легких до крайне тяжелых вариантов. При легком течении отставание в физическом и психомоторном развитии может быть единственным проявлением заболевания [14–16].
На ЭКГ определяется высокий вольтаж комплексов QRS за счет компенсаторной гипертрофии субэпикардиальных слоев миокарда. Обязательным признаком являются смещение сегмента ST ниже изолинии в стандартных и левых грудных отведениях, отрицательный зубец Т в этих отведениях, однако могут быть «гигантские» зубцы Т, превышающие по величине зубец R желудочкового комплекса (специфичный признак карнитиновой КМП); признаки гипертрофии левого желудочка, левого предсердия. Рентгенологически определяется кардиомегалия преимущественно за счет увеличения левого желудочка и левого предсердия. Данные эхокардиографии (ЭХО-КГ) выявляют резкое снижение фракции выброса, значительную дилатацию левого желудочка и левого предсердия, гипокинезию межжелудочковой перегородки, смещение митрального клапана к задней стенке левого желудочка, уплотнение эхосигнала от эндокарда.
У гетерозиготных носителей мутации гена SLC22 A5 карнитиновая недостаточность может проявиться в более старшем возрасте в виде гипертрофической КМП [16].
Лабораторные признаки системного дефицита карнитина: низкий уровень карнитина в тканях (печени, мышцах); приступы гипогликемии, не сопровождающиеся кетозом; повышение активности трансаминаз, уровня аммиака в крови; гипохромная анемия. Уровень свободного карнитина в крови обычно резко снижен. При исследовании методом тандемной масс-спектрометрии содержание свободного карнитина (С0) 70–100. В фибробластах снижена активность карнитинпальмитоилтрансферазы I (около 10% от нормы), окисление пальмитата составляет около 5% от нормы [23, 24].
Дефицит карнитинпальмитоилтрасферазы II. Наследование аутосомно-рецессивное, вызывается мутациями в гене карнитинпальмитоилтрансферазы II. Заболевание может протекать в трех формах: неонатальной (летальной), детской (инфантильной) и поздней (форма взрослых).
Неонатальная (летальная) форма характеризуется манифестацией с первых дней жизни, прогрессирующим течением, очень тяжелым состоянием детей и плохим прогнозом. Заболевание проявляется полиорганным поражением. У новорожденных развиваются гипотермия, летаргия, судороги, гипотония, гиперрефлексия и гепатомегалия, почечная недостаточность. Характерны дисморфии лица, контрактуры коленей и локтей, длинные сужающиеся пальцы рук и ног, гепатомегалия (макровезикулярный стеатоз), поликистоз почек, дисплазия почечной паренхимы, гидронефроз, тубулярные расстройства (проксимальный и дистальный канальциевый ацидоз), грубые изменения ЦНС (вентрикуломегалия, кальцификаты, дисплазия мозолистого тела, полимикрогирии, кисты паравентрикулярные и базальных ядер) [25].
Поражение сердца проявляется с рождения в виде гипертрофии левого желудочка или бивентрикулярной гипертрофии, реже возможно развитие кардиомегалии с низкой сократительной способностью сердца. В большинстве случаев регистрируются нарушения ритма сердца, возникновение желудочковой тахиакардии часто является причиной внезапной смерти [25].
Лабораторные признаки: некетотическая гипогликемия, увеличение в сыворотке, моче и тканях длинноцепочечных ацилкарнитинов (С16, С18), снижение плазменного общего и свободного карнитина, длинноцепочечная дикарбоновая ацидурия, гипераммониемия, увеличение общего билирубина, трансаминаз печени, кретинфосфокиназы, высокое содержание дикарбоксильных кислот в моче. Заболевание верифицируется выраженным снижением активности (менее 10% от нормы) карнитинпалмитоилтрансферазы II в большинстве тканей, отсутствием белка CPT II [24, 25].
При морфологическом исследовании обнаруживается накопление липидов в ткани печени, почек, скелетных мышц, легких, надпочечников и др.
Инфантильная форма манифестирует с 3 месяцев, провоцируется лихорадочными состояниями и нарушениями питания. Характерны гепатомегалия, миопатический синдром, судороги. Поражение сердца — по типу дилатационной КМП. Миопатическая форма (поздняя) протекает благоприятно, может дебютировать как в детском возрасте, так и у взрослых. Основные проявления: боли в мышцах, обычно сопровождающиеся миоглобинурией. Характерна высокая активность креатинфосфокиназы в крови, при голодании может возникать умеренный кетоз. Изменения со стороны сердца минимальны [24].
Дефицит карнитинацилкарнитинтранслоказы — редкое аутосомно-рецессивное заболевание, приводящее к нарушению утилизации длинноцепочечных жирных кислот [24]. Выделяют две формы заболевания: неонатальная и инфальтильная. Неонатальная форма характеризуется высокой летальностью вследствие сердечно-легочной недостаточности. Основные проявления: нарушение общего состояния и психомоторного развития, расстройства дыхания, изменения со стороны ЦНС в виде мышечной слабости, судорог, возможно развитие комы на фоне голодания, гепатомегалия с нарушением функции печени.
Поражение сердца встречается чаще по типу дилатационной КМП, характерно снижение систолической функции, возможны нарушения ритма: брадикардия, атриовентрикулярная блокада, желудочковая экстрасистолия, тахикардия. На ЭКГ — признаки гипертрофии левого желудочка. У новорожденных описаны случаи внезапной смерти вследствие апноэ, кардиореспираторного ареста. Если заболевание возникает в более позднем возрасте, то КМП протекает на фоне мышечной слабости и энцефалопатии [10, 26].
Отклонения в лабораторных показателях включают гипогликемию при отсутствии кетоза, увеличение в крови уровня аммиака, иногда калия и мочевой кислоты, высокую активность креатинфосфокиназы, трансаминаз, дикарбоксильную и гидроксидикарбоксильную ацидурию, а также увеличение уровня ацилкарнитинов в крови (С16–С18) в сочетании с низким уровень свободного карнитина (С0). Патология верифицируется низкой активностью карнитин-ацилкарнитин-транслоказы.
Дефекты окисления жирных кислот. Карнитин-ацилтрансферазы осуществляют перенос карнитина к ацильным компонентам коротких, средних и длинных цепей. Ацил-КоА-дегидрогеназы длинных цепей обеспечивают внутримитохондриальную бета-оксидацию жирных кислот с длинными карбоновыми цепями. Ацил-КоА-дегидрогеназы средних цепей регулируют внутримитохондриальное окисление жирных кислот средней длины карбоновых цепей. Ацил-КоА-дегидрогеназы коротких цепей обуславливают внутримитохондриальное окисление жирных кислот с короткой длиной карбоновых цепей, являются буфером ацильных групп, регулируя их поступление в цикл Кребса [27–29].
Дефицит ацил-КоА-дегидрогеназы жирных кислот с очень длинной углеродной цепью возникает в результате мутации гена дегидрогеназы очень длинной цепи ацил-КоА, наследование аутосомно-рецессивное. Мультисистемная патология: поражаются печень (гепатомегалия, стеатоз печени, гепатоцеллюлярный некроз), мышцы. Симптомами поражения мышц являются гипотония, мышечная слабость, связанная с голоданием или инфекцией, боль в мышцах при физической нагрузке, ригидность мышц, рабдомиолиз при физической нагрузке. Миопатические эпизоды вызваны физическими упражнениями, голоданием, инфекцией, воздействием низких температур. По срокам появления первых признаков выделяют 3 формы заболевания: неонатальную, детскую и позднюю [27–29].
Неонатальная форма характеризуется ранней манифестацией, в течение первых дней жизни, с развитием КМП и ранней смерти. Поражение сердца по типу гипертрофической КМП в сочетании со сниженной контрактильной способностью, часто возникают жизнеугрожающие нарушения сердечного ритма. Во время гипогликемической комы возможно развитие асистолии и внезапной смерти [30].
При детской форме (около 40% больных) начальные симптомы обычно появляются на протяжении первого года жизни. Поздняя форма характеризуется более благоприятным течением, манифестирует в подростковом возрасте, клинически проявляется болями в мышцах, как правило, сердце не вовлекается в патологический процесс.
Лабораторные признаки: некетоновая гипогликемия, дикарбоновая ацидурия, повышение концентрации лактата в крови. Диагностический маркер — снижение свободного карнитина при увеличении ацилкарнитинов (С14:1 и С14, С16OH), повышение активности креатинфосфокиназы, ацидурия дикарбоксильных кислот с длинной углеродной цепью (С14–С18) [23]. Специфична низкая активность дегидрогеназы очень длинной цепи ацил-КоА в фибробластах или мононуклеарных лейкоцитах.
Дефицит ацил-КоА-дегидрогеназы жирных кислот со средней длиной углеродной цепи возникает в результате мутации гена средней цепи ацил-КоА-дегидрогеназы, наследования аутосомно-рецессивное. Наиболее распространенное нарушение окисления жирных кислот [27, 29].
Характер поражения сердца аналогичен таковому при карнитиновой КМП. Часто возникают тяжелые нарушения сердечного ритма, остановка синусового узла, желудочковая тахикардия (по типу приступов пируэтной тахикардии (torsades de pointes)) [10, 30]. Дефицит ацил-КоА-дегидрогеназы жирных кислот со средней длиной углеродной цепи является в 1–3% причиной внезапной смерти у детей раннего возраста [10].
Лабораторные признаки: гипогликемия, метаболический ацидоз, дикарбоновая ацидурия средних цепей, ацилглицинурия, низкое содержание плазменного карнитина. Может отмечаться умеренная кетонурия. В крови повышен уровень среднецепочечных ацилкарнитинов (С6–С10). В моче определяется специфическая органическая ацидурия с преобладанием среднецепочечных дикарбоновых кислот, глициновых конъюгатов [27–28].
Дефицит ацил-КоА-дегидрогеназы жирных кислот с короткой длиной углеродной цепи. Возникает в результате мутации гена короткой цепи ацил-КоА-дегидрогеназы, наследование аутосомно-рецессивное.
Генерализованная форма может проявиться у новорожденных или детей первого года жизни, течение неблагоприятное, возможен летальный исход. Характерны судороги, задержка развития, микроцефалия, повторные приступы рвоты, прогрессирующая мышечная слабость, вялость, сонливость. Поражение сердца характеризуются дилатационной КМП, осложненной тяжелой СН. При мышечной форме первые признаки болезни появляются в старшем возрасте. В клинической картине на первый план выступают миопатические расстройства, низкая толерантность к физической нагрузке. Поражение сердца по типу дилатационной КМП протекает субклинически и выявляется обычно у подростков [29, 30].
Множественный дефицит ацил-КоА-дегидрогеназ описан как глутаровая ацидурия 2-го типа, наследование аутосомно-рецессивное. Патология обусловлена дефектом электронно-транспортного флавопротеина и дефицитом нескольких флавопротеин-содержащих дегидрогеназ, что значительно снижает эффективность митохондриального бета-окисления. Нарушены функции изовалерил-, изобутирил-, метилбутирил-, глутарил-КоА-дегидрогеназ, участвующих в метаболизме ряда аминокислот и холина.
Выделяют несколько клинических форм: неонатальную форму с врожденными аномалиями (летальную), неонатальную форму без врожденных аномалий, позднюю форму.
Метаболические проявления включают тяжелый метаболический ацидоз, гипогликемию, гипераммониемию. Кетоз выражен умеренно или отсутствует, гиперлактат- и гиперпируватемия с увеличением их соотношения до 20 и выше (норма
И. В. Леонтьева, доктор медицинских наук, профессор
Ю. М. Белозеров, доктор медицинских наук, профессор
ФГБУ НИИ педиатрии и детской хирургии Минздравсоцразвития России, Москва