мало фолликулов в яичниках что это значит в 44 года
Что такое снижение овариального резерва? Причины возникновения, диагностику и методы лечения разберем в статье доктора Каменецкого Б. А., репродуктолога со стажем в 30 лет.
Определение болезни. Причины заболевания
Распространение вспомогательных репродуктивных технологий привело к тому, что овариальный резерв и его снижение рассматриваются с позиций ответа яичника на воздействие гонадотропных препаратов. Гонадотропины — группа препаратов, оказывающих влияние на половые железы, в том числе способствующие созреванию фолликулов в яичниках. Нормальный овариальный резерв — адекватному ответ яичников на стимуляцию. Под адекватным ответом понимается требуемый рост фолликулов и получение достаточного количества ооцитов. Достаточное количество определяется не столько числом получаемых ооцитов, сколько количеством полученных после оплодотворения эмбрионов с правильным хромосомным набором.
В зависимости от возраста женщины для получения одного нормального эмбриона требуется разное количество ооцитов:
Причины развития СОР можно условно разделить на две группы:
Симптомы снижения овариального резерва
Снижение овариального резерва — процесс, растянутый во времени, которые чаще всего протекает без симптомов. Причиной, заставляющей женщину обратиться к врачу, является отсутствие беременности (бесплодие).
Патогенез снижения овариального резерва
К другим причинам, оказывающим негативное влияние на уровень овариального резерва, относятся:
Классификация и стадии развития снижения овариального резерва
С накоплением данных стало понятно, что в группу пациентов со сниженным овариальным резервом, а как следствие с неадекватным ответом на стимулирующую терапию, включены женщины с разными причинами возникновения и механизмами развития патологии. Это затрудняло планирование адекватной терапии. В связи с этим в 2016 году была сформирована рабочая группа POSEIDON ( Patient-Oriented Strategies Encompassing Individualize Oocyte Number) [37] по разработке новых критериев и классификации пациентов со сниженным овариальным резервом и бедным ответом яичников на стимуляцию.
Чтобы представить более детальную картину, были предложены клинически значимые критерии, которые могут помочь врачу в ведении пациентов. Для определения групп с низким прогнозом на стимуляцию предложены две новые категории [37] :
Первая группа включает количество получаемых при стимуляции ооцитов:
Вторая группа объединяет «качественные» и «количественные» параметры, а именно:
В результате введения этих категорий выделяют четыре группы пациентов со сниженным овариальным резервом и низким ответом на стимулирующую терапию:
Выделение отдельных групп решает практическую задачу — планирование терапии с учётом детальных критериев для пациентов разных этиопатогенетических групп.
Осложнения снижения овариального резерва
Вторым по значимости осложнением является преждевременное истощение яичников и, как следствие, нарушение менструальной функции вплоть до её полного угасания. Снижение овариального резерва приводит к критическому снижению количества ооцитов и нарушение менструального цикла по типу:
Диагностика снижения овариального резерва
Диагностика строится на совокупности анамнестических и клинико-лабораторных данных. Наиболее важным является возраст. Клинические проявления снижения овариального резерва зачастую начинают проявляться после 35 лет.
Очень часто в анамнезе есть упоминания о раннем наступлении климакса у ближайших родственников по женской линии (мать, старшие сестры).
Основными жалобами являются нарушение (чаще сокращение продолжительности и интенсивности) менструального цикла и бесплодие.
Из объективных критериев:
Лечение снижения овариального резерва
Патогенетического лечения не существует. Терапия направлена прежде всего на устранение последствий снижения овариального резерва, а именно преодоления бесплодия.
В программах вспомогательной репродукции в зависимости от принадлежности пациентки к той или иной группе по критериям POSEIDON рассматриваются различные стратегии стимулирующей терапии для получения большего количества ооцитов.
Для первой и второй групп применяется пять основных стратегий отдельно или в комбинациях:
Стратегии, предложенные для стимуляции пациенток третьей и четвёртой групп:
При невозможности получения достаточного количества ооцитов рекомендовано использование донорских ооцитов.
Прогноз. Профилактика
Для профилактики бесплодия рекомендовано:
Профилактика ятрогенных осложнений:
«Препаратов, улучшающих качество яйцеклеток, не существует». Что важно знать об овариальном резерве
Чем старше женщина, планирующая беременность, тем актуальнее для нее вопрос овариального резерва. Что влияет на качество яйцеклеток? Можно ли узнать их количество? И «экономятся» ли они во время беременности и кормления грудью?
На эти и другие вопросы ответила Лаура Константиновна Ольшанская, врач акушер-гинеколог первой квалификационной категории медицинского центра «ИдеалМед».
Что такое репродуктивное здоровье
Способность к деторождению тесно связана с понятием репродуктивного здоровья.
С понятием репродуктивного здоровья коррелирует и термин овариальный резерв. Разобраться в нем поможет детальное рассмотрение особенностей работы яичников.
Как работают яичники
Яичники — это парные женские половые железы, расположенные в полости малого таза. Это место, где созревают женские половые клетки — яйцеклетки. Также яичники являются железами внутренней секреции и, соответственно, вырабатывают половые гормоны.
Яичники состоят из двух слоев — поверхностного слоя (коркового) и мозгового вещества, в котором находятся фолликулы в разных стадиях развития и регресса.
Овариальный резерв можно оценивать по-разному.
Это маркер качества ооцитов (женских половых клеток, участвующих в размножении, — незрелых яйцеклеток, вырабатывающихся в яичнике).
Это маркер резерва фолликулов. Клиническая оценка происходит на 2-5 день цикла:
При количестве фолликулов от 8 до 20 говорят об умеренной и/или хорошей частоте наступления беременности.
Сколько яйцеклеток дано женщине
Каждая из женщин рождается с определенным запасом яйцеклеток. С 3-4 недели внутриутробного развития у эмбриона начинается закладка половых желез.
До 22 недель беременности их количество равно 4,5-5 млн, после чего снижается. К моменту рождения их количество составляет около 2 млн, к периоду полового созревания (11-13 лет) — 400 тысяч, к периоду менопаузы — 1000 единиц.
Их нельзя нарастить, пересадить, добавить. Их столько, сколько есть изначально, и становится меньше с каждым годом.
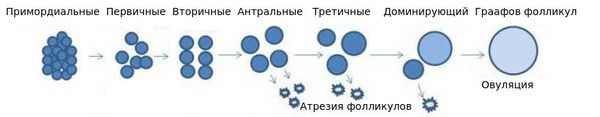
Из 400 тысяч фолликулов к моменту полового созревания только около 400 станут доминантными.
Это значит, что они смогут выпустить зрелую яйцеклетку, способную к оплодотворению. Остальные подвергнутся атрезии (запрограммированной гибели).
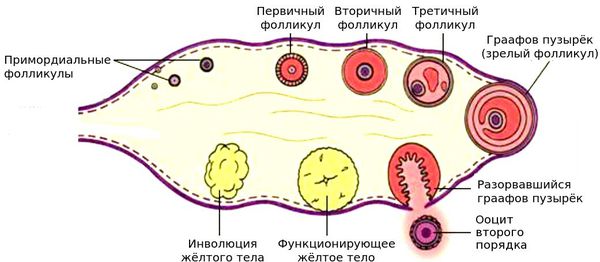
Жизненный цикл фолликулов
С самого рождения девочки ее яичники содержат ряд незрелых, первичных фолликулов, в которых находятся одинаково незрелые первичные ооциты. И для того чтобы яйцеклетка была готова к оплодотворению, она должна пройти стадии роста, «созревания» вместе с фолликулами — местом, где она «обитает».
Фолликул проходит 3 стадии роста и формирования:
То есть доминантный фолликул, видимый на УЗИ на 14-й день цикла, созревал не две недели, а целых 200 дней.
В естественном цикле у женщин вырастает один, крайне редко два доминантных фолликула. Параллельно с этим десяток фолликулов, которые могли бы стать, но так и не стали доминантными, просто погибают — подвергаются атрезии.
Овариальный резерв и ЭКО
Вопреки расхожему стереотипу, стимуляция овуляции при прохождении процедуры ЭКО не истощает запас яйцеклеток. Яйцеклетки, которые стимулируют, все равно бы «умерли» в течение естественного цикла в этом месяце.
Фолликулы, которые не прошли первые две стадии роста, нечувствительны к действию препаратов для стимуляции овуляции. Те же, которые уже чувствительны, все равно погибают или становятся доминантными вне зависимости от каких-либо факторов или препаратов.
Стимуляция овуляции не истощает овариальный резерв и не приближает климакс.
Фолликулогенез — непрерывный процесс, а значит, яичники в любое время содержат фолликулы на разных стадиях развития. Большинство фолликулов «умрет» и никогда не завершит весь цикл развития.
Как сохранить яйцеклетки
Единственный способ сохранить яйцеклетки — криоконсервация, то есть заморозка ооцитов.
Яйцеклетки стареют — так же, как и люди. После 35 лет повышается количество хромосомных аномалий. Частота наступления беременностей снижается, а частота выкидышей — возрастает.
Как только яйцеклетка стареет или «портится», ее невозможно восстановить. Препаратов, улучшающих качество яйцеклеток, не существует.
Яйцеклетка имеет очень короткий срок жизни. Как только она покидает яичник (период овуляции), она будет жить всего 12-24 часа. Вот почему время имеет решающее значение при планировании беременности.
Яйцеклетки очень нежные. Их нельзя просто заморозить, так как они повредятся кристаллами льда. Поэтому используются специальные методики мгновенной заморозки, при которой не успевает образоваться лед.
Для оценки состояния овариального резерва имеют значение:
«Запас яйцеклеток» для поздней беременности
Поделиться:
Если вы читали предыдущую статью о проблемах зачатия в возрасте «за 40», то, возможно, у вас возник вопрос: «Неужели все так фатально? Может быть, есть шанс сэкономить яйцеклетки и продлить их продуктивный век?». На этот счет ходят разные догадки, и сейчас мы разберемся, какие из них верны, а какие нет.
Миф об экономии яйцеклеток
Я достаточно часто сталкиваюсь с убеждением, что женщины, принимающие оральные контрацептивы, экономят яйцеклетки. Казалось бы, все сходится: контрацептивы подавляют овуляции, значит, яйцеклетки не расходуются и ждут своего шанса. Признаюсь, это было бы великолепно, но, увы, это не правда.
Дело в том, что начальные фазы роста и созревания фолликулов совершенно не зависят от гормонов и происходят непрерывно, начиная с внутриутробного периода. Современные противозачаточные таблетки способны лишь не допустить активного роста фолликула до лидирующего состояния и заблокировать овуляцию. Все остальные фолликулы (большинство) точно так же подвергаются регрессу и больше не смогут принимать участие в репродуктивных процессах.
Более того, до сих пор среди исследователей и ученых случаются споры о том, что длительный прием КОК может привести к угнетению резерва ооцитов в яичниках. Действительно, у пациенток, длительно принимающих КОК, яичники уменьшаются в размерах. Однако подобные эффекты обратимы, а для оценки истинного состояния яичников следует проводить исследования не ранее чем через 3 месяца после прекращения гормональной контрацепции.
КОК и сохранение фертильности
Тем не менее гормональные контрацептивы вносят свой вклад в сохранение фертильности. Нет нежелательных беременностей — нет абортов, а значит, нет травмы эндометрия и хронического эндометрита. Нет циклических колебаний гормонального фона — нет сбоев и поломок, нет образования кист, а значит, нет необходимости в операциях по поводу апоплексии или кисты яичника.
Сгущение цервикальной слизи, характерное для эстроген-гестагенных контрацептивов, не позволяет инфекционным агентам проникать в матку и маточные трубы и вызывать воспалительные процессы. А значит, вероятность трубно-перитонеального бесплодия стремится к нулю.
Эффект отмены (rebound effect)
Способность гормональных контрацептивов ускорить наступление беременности хорошо известна. Безусловно, это далеко не 100%-ный способ, но после отмены КОК в первые 4 цикла благополучно беременеет 60 % женщин.
Считается, что во время приема контрацептивов в яичниках накапливается группа вторичных фолликулов, готовых ринуться «в бой», как только поступит команда. При этом действительно могут возникнуть условия для одновременного созревания нескольких доминантных фолликулов и незначительно повышается вероятность многоплодной беременности.
Оценка овариального резерва
Если проблема отложенного материнства для вас актуальна, то в первую очередь стоит побеспокоиться и сдать определенные анализы женщинам:
Для того чтобы приблизительно оценить сохранность запасов яйцеклеток в яичниках, врачи определяют уровень АМГ (антимюллерового гормона) и используют УЗИ. Кровь на АМГ следует сдать на 3–5-й дни менструального цикла натощак, за 24 часа исключив прием гормональных препаратов.
УЗИ для оценки овариального резерва делают прямо во время менструации — на 2–5-й день цикла. Врач измерит длину, ширину и толщину яичников для определения их объема и подсчитает количество видимых фолликулов в каждом яичнике. Считается нормальным, если в этот период в яичниках находится от 5 до 15 фолликулов диаметром 2–5 мм. Если фолликулов меньше 5, а объем яичника меньше 3 кубических сантиметров, то речь идет о снижении пула годных яйцеклеток.
Отложить про запас
Эффективность процедуры зависит от возраста женщины в момент извлечения яйцеклетки. По данным за 2014 год, в США благополучная имплантация происходит в 43 % случаев, если яйцеклетка извлечена до 35 лет, однако после 35 шансы тают буквально на глазах, в итоге при криоконсервации яйцеклеток у женщин старше 40 лет вероятность успеха стремится к нулю. В то же время женщины, прошедшие процедуру до 30, имеют шансы никогда не воспользоваться «запасом», самостоятельно родив всех желанных детей.
Еще одним возможным методом сохранения фертильности является заморозка части яичника. Это позволяет сохранить большое количество ооцитов в первичных фолликулах без стимуляции яичников, но требует хирургического вмешательства для получения фрагментов тканей. Такой вариант чаще всего предлагают молодым женщинам перед началом химиотерапии или лучевой терапии.
Сейчас криоконсервация ооцитов практически не уступает в эффективности заморозке эмбрионов 2 и, безусловно, предпочтительнее для женщин, которые не определились с выбором отца для будущего ребенка. Исследователи считают, что программы криоконсервации могут стать наиболее востребованной обществом «страховкой» от бесплодия, связанного с поздней реализацией репродуктивных планов. Так это или нет — покажет время.
1 Wilson C, Check JH, Summers-Chase D. Successful pregnancies from embryos cryopreserved more than ten years: two case reports // Clin Exp Obstet Gynecol. 2006; 33(2): 79.
2 Ho JR, Woo I, Louie K et al. A comparison of live birth rates and perinatal outcomes between cryopreserved oocytes and cryopreserved embryos // J Assist Reprod Genet. 2017; 34(10): 1359. Epub 2017 Jul 17.
Возраст как причина снижения репродуктивного потенциала. Пути преодоления бесплодия у женщин старшей возрастной группы. Донорство ооцитов
ВОЗРАСТНОЕ СНИЖЕНИЕ РЕПРОДУКТИВНОЙ ФУНКЦИИ НЕИЗБЕЖНО. СКОРОСТЬ ЭТОГО СНИЖЕНИЯ ОПРЕДЕЛЯЕТСЯ СОЧЕТАНИЕМ ГЕНЕТИЧЕСКИХ ФАКТОРОВ И ВЛИЯНИЯ ОКРУЖАЮЩЕЙ СРЕДЫ. ДАННАЯ ОСОБЕННОСТЬ ЖЕНСКОГО ОРГАНИЗМА ДАЕТ ВОЗМОЖНОСТЬ ЗАЧАТИЯ В ТОМ ВОЗРАСТЕ, КОГДА МОЛОДАЯ ЗДОРОВАЯ ЖЕНЩИНА МОЖЕТ ПОЛНОЦЕННО ЗАБОТИТЬСЯ О СВОИХ ДЕТЯХ. ОКОНЧАТЕЛЬНОМУ УГАСАНИЮ РЕПРОДУКТИВНОЙ ФУНКЦИИ ПРЕДШЕСТВУЕТ ПОЗДНИЙ РЕПРОДУКТИВНЫЙ ПЕРИОД, В КОТОРОМ СПОСОБНОСТЬ К ЗАЧАТИЮ УЖЕ КРАЙНЕ НИЗКА.
В позднем репродуктивном периоде у женщины еще присутствуют менструации, но способность к зачатию резко снижается. Гормональная функция яичников прекращается в возрасте менопаузы, то есть обычно ближе к 50 годам. На практике после 40 лет получить беременность с собственными ооцитами даже при ЭКО достаточно сложно.
КОГДА НАЧИНАЕТСЯ ПОЗДНИЙ РЕПРОДУКТИВНЫЙ ПЕРИОД?
В настоящее время он сдвинут уже к 35–38 годам. Такое увеличение возраста объясняется современными социальными реалиями, в которых женщина откладывает рождение детей на возраст после 30 лет из-за необходимости обучения, получения профессии, карьеры и создания материальной базы для будущих детей. Но мало кто из женщин знает, что инволютивные процессы, снижающие вероятность спонтанной беременности, начинаются уже после 30 лет и после 35 лет значительно ускоряются.
КОГДА ЗАКАНЧИВАЕТСЯ РЕПРОДУКТИВНЫЙ ВОЗРАСТ?
По определению ВОЗ, репродуктивный возраст определен до 49 лет. Это значит, что у большинства женщин к 49 годам теряется способность к спонтанной беременности. Но на самом деле данная способность у большинства женщин теряется значительно раньше. И это данные средние по популяции, не учитывающие синдром преждевременного истощения яичников и оперативные вмешательства на яичниках. Зная это, врачам необходимо вовремя ориентировать пациенток на вспомогательные репродуктивные технологии, а не тратить время на восстановление естественной фертильности.
Существует представление, что женщина способна к зачатию до тех пор, пока у нее присутствует менструация и определяются фолликулы. Но в подавляющем большинстве случаев это не так. Каковы же основные патогенетические механизмы снижения фертильности у женщин старшего возраста? Их всего два: снижение количества яйцеклеток и снижение качества яйцеклеток, причем вторая причина мешает зачатию значительно больше, чем первая, а врачи часто учитывают только количество яйцеклеток, ориентируясь на количество фолликулов на УЗИ. Известно, что с возрастом все меньше фолликулов инициируются к росту в каждом цикле. Так, по данным M. Faddy и R. Gosden, в возрасте 20–25 лет ежедневно происходит рост 50 примордиальных фолликулов, в 34–35 лет – 17 фолликулов, а в 44–45 лет – не более трех, да и скорость атрезии фолликулов после 36 лет возрастает вдвое, что, конечно, приводит к истощению фолликулярного резерва. Но, казалось бы, для беременности достаточно одной яйцеклетки, тогда почему же она не наступает даже при наличии трех и более яйцеклеток? Именно потому, что для беременности необходима одна генетически и морфологически полноценная яйцеклетка, способная к оплодотворению. А вот именно таких яйцеклеток после 35 лет становится катастрофически мало и с каждым годом все меньше. Поэтому, чтобы получить полноценную яйцеклетку после 40 лет, приходится переработать большое количество материала. Иногда удается попасть на такую яйцеклетку с первой попытки ЭКО, и тогда мы получаем беременность с первого раза. Но зачастую приходится повторять попытки именно по причине плохого качества получаемых эмбрионов.
ЧТО ПРОИСХОДИТ С ЯЙЦЕКЛЕТКАМИ С ВОЗРАСТОМ?
Результаты цитогенетического анализа ооцитов, полученных у пациенток различных возрастных групп, показывают планомерное увеличение их дегенеративных форм у женщин старше 35 лет. По данным Боярского К. Ю. и Гайдукова С. Н., в ооцитах обнаруживаются деформация и лизис структурных элементов, фрагментация и вакуолизация ядра и другие визуальные признаки клеточной дегенерации. В геноме эмбрионов, полученных из ооцитов женщин старшей возрастной группы, значительно увеличивается частота хромосомных аномалий. Чаще всего встречаются анеуплоидии из-за нерасхождения хромосом или запаздывания хромосомы при анафазном движении. Анеуплоидии могут проявляться моносомией или трисомией по какой-либо паре хромосом. Наиболее часто встречающиеся трисомии – это синдром Дауна (21 пара), синдром Эдвардса (18 пара) и синдром Патау (13 пара), а моносомии – это синдром Шерешевского-Тернера (Х-хромосома). Но их частота очень условна, так как эти патологии чаще диагностируются у доношенных плодов именно потому, что возможно донашивание беременности и рождение ребенка с данными патологиями. Трисомии же по остальным парам приводят к полной нежизнеспособности эмбрионов и, соответственно, к прерыванию беременности на более ранних сроках и поэтому остаются недиагностированными и неучтенными. Именно благодаря им частота невынашивания у женщин старшей возрастной группы значительно выше, чем у молодых женщин. Данные, учитывающие распространенность хромосомных аномалий не только у новорожденных, но и у абортусов, позволяют сделать вывод, что у женщин старше 42 лет до трети всех зачатий имеют отклонения в генетике эмбрионов. Более же грубые нарушения в генетике яйцеклетки приводят к тому, что она не оплодотворяется и беременность попросту не наступает.
ПОКАЗАНИЯ ДЛЯ ИСПОЛЬЗОВАНИЯ ДОНОРСКИХ ООЦИТОВ ПОДРАЗДЕЛЯЮТ НА АБСОЛЮТНЫЕ И ОТНОСИТЕЛЬНЫЕ
КАК ПРЕОДОЛЕТЬ ДОСТАТОЧНО СЕРЬЕЗНЫЙ БАРЬЕР ГЕНЕТИКИ НА ПУТИ К БЕРЕМЕННОСТИ?
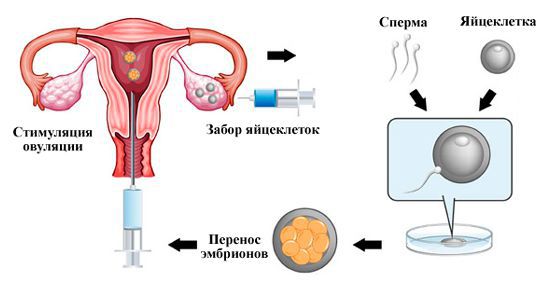
Пути здесь два. Первый – это повторять процедуры ЭКО до тех пор, пока не удастся получить жизнеспособный эмбрион. Этот способ достаточно сложен и с финансовой точки зрения, и с точки зрения гормональной нагрузки на организм женщины. Одним из путей решения этих проблем может быть применение ЭКО в естественном цикле. Данный вид ЭКО используется, если у женщины в процессе стимуляции не удается вырастить больше одного ооцита. При нем не применяются стимулирующие препараты, пунктируется только один фолликул, выросший у женщины самостоятельно. Это позволяет уменьшить гормональную нагрузку на организм женщины в ходе многочисленных стимуляций, а также удешевить каждую попытку ЭКО. Но существенным недостатком данного метода является высокая частота преждевременной овуляции фолликула, когда на протяжении нескольких месяцев не удается произвести пункцию фолликула по причине его овуляции до пункции. На практике же получить беременность даже ежемесячными процедурами ЭКО у женщин старшей возрастной группы достаточно сложно, а зачастую и невозможно. На сегодняшний день не существует способов улучшить качество ооцитов у женщины и заставить работать ее яичники лучше, поэтому возникает необходимость брать яйцеклетки у женщин, у которых они хорошего качества и достаточного количества.
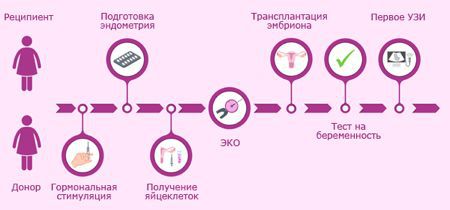
В связи с этим более выгодным видится второй путь – это использование донорских ооцитов. Безусловно, решение об использовании донорского материала должна принимать исключительно супружеская пара. Врач обязан разъяснить, что данный ребенок не будет генетически родным для женщины, а будет генетически родным только мужчине. Переходить к использованию донорского материала необходимо, исключительно если все остальные способы получения беременности в данной паре исчерпаны. Очевидной причиной более высокой эффективности программ ЭКО с использованием донорских ооцитов является то, что в них используются яйцеклетки молодых женщин, имеющие лучшее качество, в которых значительно реже встречаются хромосомные аберрации. Это доказывает, что для наступления беременности важнее качество ооцитов, а не соматический и гинекологический статус пациенток (не учитывая, конечно, грубую соматическую или гинекологическую патологию, препятствующую наступлению и вынашиванию беременности).
В настоящее время к донорским ооцитам обращаются до 20% пациенток, выполняющих ЭКО. Такому увеличению частоты использования донорского материала в последнее время поспособствовало значительное усовершенствование методов криоконсервации эмбрионов, позволяющее обеспечить 95% выживаемости эмбрионов после разморозки. Применяемая в настоящее время витрификация эмбрионов позволяет замораживать, хранить и размораживать эмбрионы без потери их качества и жизнеспособности. Поэтому в большинстве донорских программ используются именно замороженные эмбрионы. Это более удобно, не требует синхронизации циклов биологической матери и донора ооцитов и позволяет максимально адекватно подготовить эндометрий реципиента к переносу эмбрионов.
Обследование донора ооцитов проводится практически в том же объеме, что и при стандартной подготовке к программе ЭКО, дополнительно необходимо заключение психиатра и генетическое обследование. Донором ооцитов может быть соматически, психически и гинекологически здоровая женщина 19–35 лет.
Согласно существующему законодательству использование донорских ооцитов возможно только при полном информированном согласии обоих супругов и донора ооцитов. Обязательно оформление соответствующих нормативных документов. Финансовые вопросы регламентируются либо пациентами самостоятельно (например, в случае привлечения в качестве донора ооциов родственников или знакомых пары), либо специализированными юридическими агентствами. Медицинскому персоналу следует воздержаться от финансовой стороны вопроса.
В заключение хотелось бы сказать, что получение беременности у женщин старшего репродуктивного возраста – достаточно сложная, трудоемкая и длительная работа. Учитывая длительность и малую результативность этих усилий, зачастую пациентка отчаивается получить беременность и отказывается от дальнейшего лечения. В эти моменты возможно и даже желательно использовать помощь психологов, которая позволяет женщине наименее болезненно пережить все этапы необходимого лечения.