Что означает s элемент в химии
Химия s-, р-элементов
Урок 32. Химия 11 класс ФГОС
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Химия s-, р-элементов»
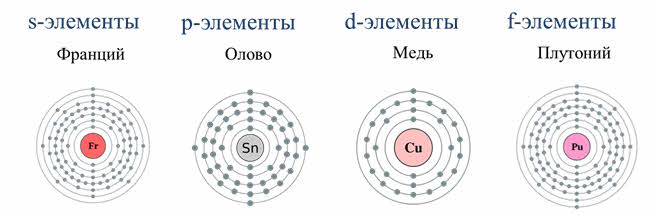
Элементы в периодической системе Менделеева делятся на эс, пэ, дэ и эф-элементы. Это разделение осуществляется на основе того, сколько энэргетических уровней имеет электронная оболочка атома и каким уровнем заканчивается заполнение электронной оболочки электронами.
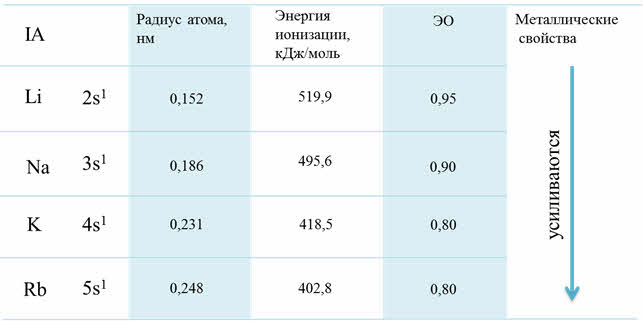
К s-элементам относятся элементы первой А группы – щелочные металлы. Электронная формула щелочных металлов эн-эс-один.
Поэтому для них характерна степень окисления плюс один. Элементы первой А группы обладают сходными свойствами из-за сходного строения электронной оболочки.
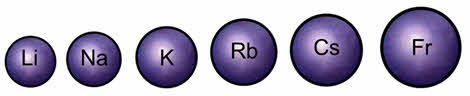
Но при увеличении радиуса в группе от лития к францию связь валентного электрона с ядром ослабевает и уменьшается энэргия ионизации. Атомы щелочных металлов легко отдают свой валентный электрон, поэтому они являются сильными восстановителями.
Из-за высокой химической активности щелочные металлы в природе встречаются только в виде соединений. Простые вещества, образованные элементами первой А группы, представляют собой серебристо-белые металлы, которые легко режутся ножом. Все щелочные металлы относятся к лёгким и легкоплавким металлам.
К эс-элементам относятся также элементы второй A группы, из них кальций, стронций, барий называют щелочноземельными металлами. На внешнем энэргетическом уровне у них по два электрона. Из-за своей высокой химической активности они встречаются в природе только в виде соединений. Металлы второй A группы имеют металлический блеск с различными оттенками: от серого до серебристого, температура плавления их выше, чем у щелочных металлов, плотность их меньше пяти грамм на сантиметр кубический, поэтому их относят к легкоплавким металлам.
К p-элементам относятся 30 элементов от третьей А до восьмой А группы периодической системы; пэ-элементы расположены во втором и третьем малых периодах, а также в четвертом, пятом и шестом больших периодах.
Элементы третьей А-группы имеют один электрон на пэ-орбитали. Начиная с четвёртой А и заканчивая восьмой А группой наблюдается заполнение пэ-подуровня до шести электронов. Общая электронная формула пэ-элементов эн-эс-два-эн-пэ-шесть.
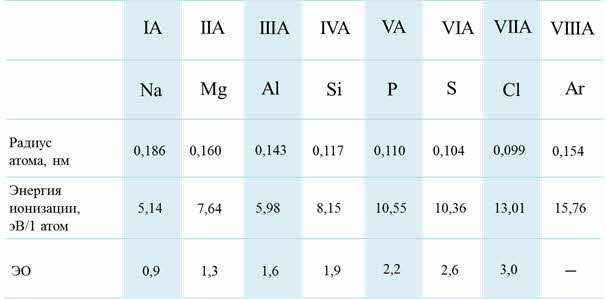
В периодах при увеличении заряда ядра атомные радиусы и ионные радиусы пэ-элементов уменьшаются, энэргия ионизации и сродства к электрону возрастают, электроотрицательность увеличивается, неметаллические свойства элементов усиливаются.
Изменение свойств по периодам
В группах сверху вниз радиусы атомов увеличиваются, энэргия ионизации и сродства к электрону уменьшается, электроотрицательность уменьшается, усиливаются металлические свойства, а неметаллические свойства ослабевают.
Изменение свойств по группам
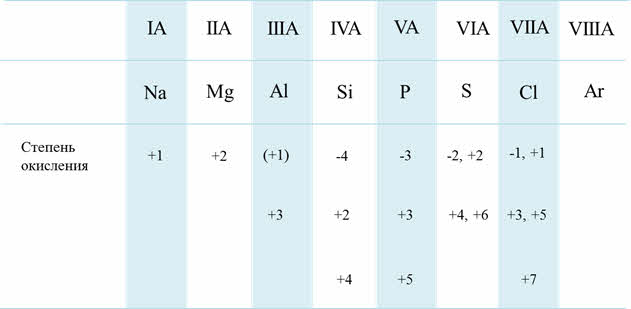
Кроме этого, по периоду с увеличением порядкового номера возрастает высшая степень окисления, а также возможность степеней окисления. Например, у кремния возможны такие степени окисления, как минус четыре, плюс два, плюс четыре; а у хлора – минус один, плюс один, плюс три, плюс пять, плюс семь.
Изменение СО по периоду
Если рассмотреть от первой до третьей А группы, то можно увидеть, что в группе сверху вниз увеличиваются металлические свойства, а также возрастает активность металлов. Например, во второй A группе металлические свойства и активность бария выражены гораздо сильнее, чем у магния.
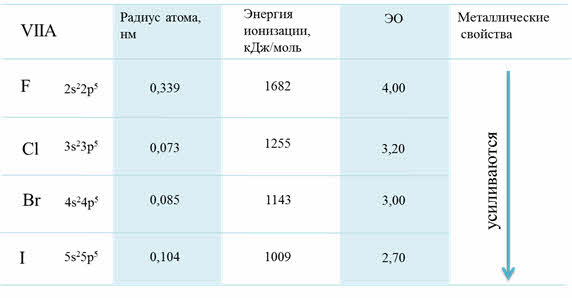
Рассмотрим для примера седьмую A группу – семейство галогенов. В этой группе сверху вниз радиус атома увеличивается, энергия ионизации уменьшается и электроотрицательность также уменьшается.
Возрастание активности металла
Если рассмотреть группы от четвёртой А до седьмой А, то можно проследить, что в этих группах сверху вниз уменьшается активность неметаллов, уменьшается стабильность соединений в высшей степени окисления, возрастает стабильность соединений в более низкой степени окисления. Например, в пятой A группе висмут проявляет металлические свойства и для него, в отличие от фосфора, наиболее характерна степень окисления плюс три.
Изменение свойств в VIIA группе
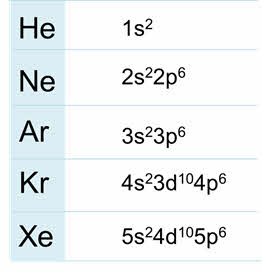
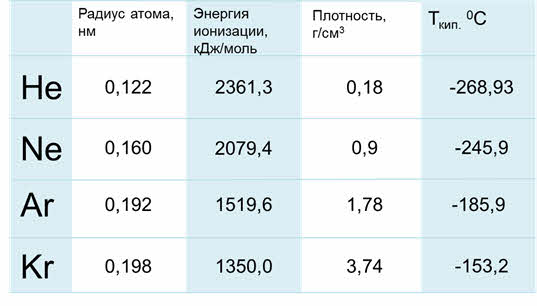
Благородные газы – элементы восьмой A группы. У них завершён внешний энэргетический уровень, причём у гелия два электрона на внешнем уровне, он относится к эс-элементам, а все остальные благородные газы относятся к пэ-элементам.
Радиус атомов у благородных газов увеличиваются сверху вниз, энергия ионизации уменьшается, плотность сверху вниз увеличивается, также как температура кипения.
Таким образом, к эс-элементам относятся элементы первой A и второй A группы, к пэ-элементам относятся элементы от третьей до восьмой А группы. Отличительной особенность этих элементов является то, что их валентные электроны расположены на эс- или пэ-подуровне.
По периоду слева направо у них наблюдается уменьшение радиуса атомов, увеличивается энергия ионизации и энергия сродства к электрону, электроотрицательность увеличивается, металлические свойства ослабевают, а усиливаются неметаллические.
В группах сверху вниз наблюдается иная закономерность: радиусы атомов увеличиваются, уменьшается энергия ионизации и энергия сродства к электрону, электроотрицательность уменьшается, металлические свойства усиливаются, а неметаллические ослабевают.
s-элементы
s-блок в периодической таблице элементов — электронная оболочка, включающая в себя первые два слоя s-электронов.
Эти элементы отличаются тем, что в атомном состоянии высокоэнергичный электрон находится на s-орбитали. Исключая водород и гелий, эти электроны очень легко переходят и формируются в позитивные ионы при химической реакции. Конфигурация гелия химически весьма стабильна, следовательно, именно по этому гелий не имеет стабильных изотопов; иногда, благодаря этому свойству, его объединяют с инертными газами.
Остальные элементы, имеющие этот блок, все без исключения являются сильными восстановителями и поэтому в свободном виде в природе не встречаются. Элемент в металлическом виде может быть получен только с помощью электролиза растворенной в воде соли. Дэви Гемфри, в 1807 и 1808 году, стал первым кто отсоединил соли кислот от s-блок-металлов, за исключением лития, бериллия, рубидия и цезия. Бериллий был впервые отделен от солей независимо двумя учёными: Ф. Вулером и А. А. Бази в 1828 году, в то время как литий был сепарирован Р. Бунзеном только в 1854 году, который, после изучения рубидия, отделил его спустя 9 лет. Цезий не был выделен в чистом виде вплоть до 1881 года, после того как Карл Сеттерберг подверг электролизу цианид цезия.
Твердость элементов, имеющих s-блок, в компактном виде (при обычных условиях) может варьироваться от очень малой (все щелочные металлы — их можно разрезать ножом) до довольно высокой (бериллий). Исключая бериллий и магний, металлы очень реакционноспособны и могут быть использованы в сплавах со свинцом в малых количествах ( Опасность и хранение
Все элементы, имеющие s-оболочку, являются опасными веществами. Они пожароопасны, требуют особого пожаротушения, исключая бериллий и магний. Храниться должны в инертной атмосфере аргона или углеводородов. Бурно реагируют с водой, продуктом реакции является водород, например:

исключая магний, который реагирует медленно, и бериллия, который реагирует только когда его оксидная плёнка снята с помощью ртути. Литий имеет схожие свойства с магнием, так как находится, относительно периодической таблицы, рядом с магнием.
См. также
Полезное
Смотреть что такое «s-элементы» в других словарях:
Элементы-индикаторы — элементы, указывающие на наличие м ний и рудных тел. Являются важным поисковым признаком оруденения, когда основные рудообразующие металлы не дают одназначных выводов о ценности геохим. аномалии. Подразделяются на несколько гр.: 1) элементы,… … Геологическая энциклопедия
ЭЛЕМЕНТЫ (КОМПОНЕНТЫ) ПОЛЕЗНЫЕ — составные части полезного ископаемого, представляющие интерес для промышленности. В Э. п. входят элементы главные и второстепенные, включая элементы примеси, элементы спутники и элементы легирующие. Геологический словарь: в 2 х томах. М.: Недра.… … Геологическая энциклопедия
ЭЛЕМЕНТЫ ВТОРОСТЕПЕННЫЕ — присутствующие в руде в низких и чрезвычайно низких содер., но существенно влияющие на промышленную ценность м ния. Обычно не определяют контура рудных залежей. При значительном скоплении Э. в. минимальное бортовое содер. главных полезных… … Геологическая энциклопедия
ЭЛЕМЕНТЫ — ЭЛЕМЕНТЫ (лат. elementa семантическая калька греч. στοιχεία, от στοίχος ряд, собств. член ряда), термин античной философии, первоначально «буквы» (алфавита), затем простейшие начала, элементы (старославянская транскрипция «стихии»). Уже… … Античная философия
ЭЛЕМЕНТЫ-ПРИМЕСИ — химические элементы, присутствующие в минералах других элементов в виде изоморфных примесей или тонких механических включений; иногда извлекаются в качестве попутных или даже основных (напр., золото из пирита) компонентов. В число элементов… … Большой Энциклопедический словарь
Элементы химические — (a. chemical elements; н. chemische Elemente; ф. elements chimiques; и. elementos quimicos) составные части простых и сложных тел, представляющие собой совокупность атомов c одинаковым зарядом атомных ядер и одинаковым числом электронов в … Геологическая энциклопедия
Элементы-примеси — второстепенные элементы в г. п. и рудах, образующие самостоятельные м лы. Многие из них имеют промышленное значение и путем обогащения могут выделяться в концентраты. См. Элементы второстепенные. Геологический словарь: в 2 х томах. М.: Недра. Под … Геологическая энциклопедия
ЭЛЕМЕНТЫ — № 105 110 сверхтяжёлые искусственно полученные радиоакт. хим. элементы. Элементы с ат. номером 104 110 наз. т р а н с а к т и н о и д н ы м и. Элемент № 105 (нуклид с массовым числом А= 261, T1/2=1,6 с) получен в 1970 в Дубне группой Г. H.… … Физическая энциклопедия
ЭЛЕМЕНТЫ КОРАБЛЯ ТАКТИКО-ТЕХНИЧЕСКИЕ — характеризующие его как боевую единицу следующие: элементы нападения артиллерия, торпеда, мина, глубинные бомбы и т. д.; элементы защиты броня, противоминная защита, противохимическая защита; маневренные элементы скорость хода, поворотливость,… … Морской словарь
S-элементы
Из Википедии — свободной энциклопедии
s-Элементы в периодической таблице элементов — химические элементы, электронная оболочка которых включает в себя первые два s-электрона. Такие элементы объединяются в группу, называемую s-блок.
К s-элементам относятся:
S-элементы отличаются тем, что в невозбужденном состоянии высокоэнергетичный электрон атомов находится на s-орбитали. Исключая водород и гелий, эти электроны очень легко отщепляются и формируются в положительные ионы при химической реакции. Конфигурация гелия химически стабильна; за счёт этого его относят к инертным газам.
S-элементы (кроме гелия) являются сильными восстановителями и поэтому в свободном виде в природе не встречаются. Элемент в металлическом виде может быть получен только с помощью электролиза расплава соли. Гемфри Дэви, в 1807 и 1808 году, стал первым, кто выделил s-металлы из их солей, за исключением лития, бериллия, рубидия и цезия. Бериллий был впервые выделен из солей независимо двумя учёными: Ф. Вулером и А. А. Бази в 1828 году, в то время как литий был выделен Р. Бунзеном только в 1854 году, который, после изучения рубидия, выделил его спустя 9 лет. Цезий не был выделен в чистом виде вплоть до 1881 года, до того, как Карл Сеттерберг подверг электролизу цианид цезия.
Твёрдость s-элементов в компактном виде (при обычных условиях) может варьироваться от очень малой (все щелочные металлы — их можно разрезать ножом) до довольно высокой (бериллий). Исключая бериллий и магний, металлы очень реакционноспособны и могут быть использованы в сплавах со свинцом в малых количествах ( Энциклопедичный YouTube
Список химических элементов по символам
Содержание
Это список химических элементов по символам, содержащий символы, которые в данный момент используются для обозначения химических элементов и признаны Международным союзом теоретической и прикладной химии как лучшие из предложеных и исторических символов. Также для каждого элемента указывается атомный номер, атомная масса или самый стабильный изотоп, номера группы и периода в периодической таблице и источник названия элемента, если он не совпадает с текущим названием.
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
Символы, используемые в данный момент
| Символ | Название | Происхождение символа | Атомный номер | Атомная масса | Группа | Период |
|---|---|---|---|---|---|---|
| Ac | Актиний | 89 | [227]1 | 7 | ||
| Ag | Серебро | лат. Argentum | 47 | 107,8682 (2)2 | 11 | 5 |
| Al | Алюминий | 13 | 26,9815386 (8) | 13 | 3 | |
| Am | Америций | 95 | [243]1 | 7 | ||
| Ar | Аргон | 18 | 39,948 (1)2 4 | 18 | 3 | |
| As | Мышьяк | 33 | 74,92160 (2) | 15 | 4 | |
| At | Астат | 85 | [210]1 | 17 | 6 | |
| Au | Золото | лат. Aurum | 79 | 196,966569 (4) | 11 | 6 |
| B | Бор | 5 | 10,811 (7)2 3 4 | 13 | 2 | |
| Ba | Барий | 56 | 137,327 (7) | 2 | 6 | |
| Be | Бериллий | 4 | 9,012182 (3) | 2 | 2 | |
| Bh | Борий | 107 | [264]1 | 7 | 7 | |
| Bi | Висмут | 83 | 208,98040 (1) | 15 | 6 | |
| Bk | Берклий | 97 | [247]1 | 7 | ||
| Br | Бром | 35 | 79,904 (1) | 17 | 4 | |
| C | Углерод | 6 | 12,0107 (8)2 4 | 14 | 2 | |
| Ca | Кальций | 20 | 40,078 (4)2 | 2 | 4 | |
| Cd | Кадмий | 48 | 112,411 (8)2 | 12 | 5 | |
| Ce | Церий | 58 | 140,116 (1)2 | 6 | ||
| Cf | Калифорний | 98 | [251]1 | 7 | ||
| Cl | Хлор | 17 | 35,453 (2)2 3 4 | 17 | 3 | |
| Cm | Кюрий | 96 | [247]1 | 7 | ||
| Co | Кобальт | 27 | 58,933195 (5) | 9 | 4 | |
| Cr | Хром | 24 | 51,9961 (6) | 6 | 4 | |
| Cs | Цезий | 55 | 132,9054519 (2) | 1 | 6 | |
| Cu | Медь | лат. Cuprum | 29 | 63,546 (3)4 | 11 | 4 |
| Db | Дубний | 105 | [262]1 | 5 | 7 | |
| Ds | Дармштадтий | 110 | [271]1 | 10 | 7 | |
| Dy | Диспрозий | 66 | 162,500 (1)2 | 6 | ||
| Er | Эрбий | 68 | 167,259 (3)2 | 6 | ||
| Es | Эйнштейний | 99 | [252]1 | 7 | ||
| Eu | Европий | 63 | 151,964 (1)2 | 6 | ||
| F | Фтор | 9 | 18,9984032 (5) | 17 | 2 | |
| Fe | Железо | лат. Ferrum | 26 | 55,845 (2) | 8 | 4 |
| Fm | Фермий | 100 | [257]1 | 7 | ||
| Fr | Франций | 87 | [223]1 | 1 | 7 | |
| Ga | Галлий | 31 | 69,723 (1) | 13 | 4 | |
| Gd | Гадолиний | 64 | 157,25 (3)2 | 6 | ||
| Ge | Германий | 32 | 72,64 (1) | 14 | 4 | |
| H | Водород | 1 | 1,00794 (7)2 3 4 | 1 | 1 | |
| He | Гелий | 2 | 4,002602 (2)2 4 | 18 | 1 | |
| Hf | Гафний | 72 | 178,49 (2) | 4 | 6 | |
| Hg | Ртуть | лат. Hydrargyrum | 80 | 200,59 (2) | 12 | 6 |
| Ho | Гольмий | 67 | 164,930 32 (2) | 6 | ||
| Hs | Хассий | 108 | [277]1 | 8 | 7 | |
| I | Иод | 53 | 126,904 47 (3) | 17 | 5 | |
| In | Индий | 49 | 114,818 (3) | 13 | 5 | |
| Ir | Иридий | 77 | 192,217 (3) | 9 | 6 | |
| K | Калий | лат. Kalium | 19 | 39,0983 (1) | 1 | 4 |
| Kr | Криптон | 36 | 83,798 (2)2 3 | 18 | 4 | |
| La | Лантан | 57 | 138,90547 (7)2 | 6 | ||
| Li | Литий | 3 | 6,941 (2)2 3 4 5 | 1 | 2 | |
| Lr | Лоуренсий | 103 | [262]1 | 3 | 7 | |
| Lu | Лютеций | 71 | 174,967 (1)2 | 3 | 6 | |
| Md | Менделевий | 101 | [258]1 | 7 | ||
| Mg | Магний | 12 | 24,3050 (6) | 2 | 3 | |
| Mn | Марганец | 25 | 54,938045 (5) | 7 | 4 | |
| Mo | Молибден | 42 | 95,94 (2)2 | 6 | 5 | |
| Mt | Мейтнерий | 109 | [268]1 | 9 | 7 | |
| N | Азот | 7 | 14,0067 (2)2 4 | 15 | 2 | |
| Na | Натрий | лат. Natrium | 11 | 22,98976928 (2) | 1 | 3 |
| Nb | Ниобий | 41 | 92,906 38 (2) | 5 | 5 | |
| Nd | Неодим | 60 | 144,242 (3)2 | 6 | ||
| Ne | Неон | 10 | 20,1797 (6)2 3 | 18 | 2 | |
| Ni | Никель | 28 | 58,6934 (2) | 10 | 4 | |
| No | Нобелий | 102 | [259]1 | 7 | ||
| Np | Нептуний | 93 | [237]1 | 7 | ||
| O | Кислород | 8 | 15,9994 (3)2 4 | 16 | 2 | |
| Os | Осмий | 76 | 190,23 (3)2 | 8 | 6 | |
| P | Фосфор | 15 | 30,973762 (2) | 15 | 3 | |
| Pa | Протактиний | 91 | 231,03588 (2)1 | 7 | ||
| Pb | Свинец | лат. Plumbum | 82 | 207,2 (1)2 4 | 14 | 6 |
| Pd | Палладий | 46 | 106,42 (1)2 | 10 | 5 | |
| Pm | Прометий | 61 | [145]1 | 6 | ||
| Po | Полоний | 84 | [210]1 | 16 | 6 | |
| Pr | Празеодим | 59 | 140,90765 (2) | 6 | ||
| Pt | Платина | 78 | 195,084 (9) | 10 | 6 | |
| Pu | Плутоний | 94 | [244]1 | 7 | ||
| Ra | Радий | 88 | [226]1 | 2 | 7 | |
| Rb | Рубидий | 37 | 85,4678 (3)2 | 1 | 5 | |
| Re | Рений | 75 | 186,207 (1) | 7 | 6 | |
| Rf | Резерфордий | 104 | 2611 | 4 | 7 | |
| Rg | Рентгений | 111 | [272]1 | 11 | 7 | |
| Rh | Родий | 45 | 102,905 50 (2) | 9 | 5 | |
| Rn | Радон | 86 | [220]1 | 18 | 6 | |
| Ru | Рутений | 44 | 101,07 (2)2 | 8 | 5 | |
| S | Сера | 16 | 32,065 (5)2 4 | 16 | 3 | |
| Sb | Сурьма | лат. Stibium | 51 | 121,760 (1)2 | 15 | 5 |
| Sc | Скандий | 21 | 44,955912 (6) | 3 | 4 | |
| Se | Селен | 34 | 78,96 (3)4 | 16 | 4 | |
| Sg | Сиборгий | 106 | [266]1 | 6 | 7 | |
| Si | Кремний | лат. Silicium | 14 | 28,0855 (3)4 | 14 | 3 |
| Sm | Самарий | 62 | 150,36 (2)2 | 6 | ||
| Sn | Олово | лат. Stannum | 50 | 118,710 (7)2 | 14 | 5 |
| Sr | Стронций | 38 | 87,62 (1)2 4 | 2 | 5 | |
| Ta | Тантал | 73 | 180,94788 (2) | 5 | 6 | |
| Tb | Тербий | 65 | 158,92535 (2) | 6 | ||
| Tc | Технеций | 43 | [98]1 | 7 | 5 | |
| Te | Теллур | 52 | 127,60 (3)2 | 16 | 5 | |
| Th | Торий | 90 | 232,03806 (2)1 2 | 7 | ||
| Ti | Титан | 22 | 47,867 (1) | 4 | 4 | |
| Tl | Таллий | 81 | 204,3833 (2) | 13 | 6 | |
| Tm | Тулий | 69 | 168,93421 (2) | 6 | ||
| U | Уран | 92 | 238,02891 (3)1 2 3 | 7 | ||
| Uub | Унунбий | 112 | [285]1 | 12 | 7 | |
| Uuh | Унунгексий | 116 | [292]1 | 16 | 7 | |
| Uup | Унунпентий | 115 | [288]1 | 15 | 7 | |
| Uuq | Унунквадий | 114 | [289]1 | 14 | 7 | |
| Uut | Унунтрий | 113 | [284]1 | 13 | 7 | |
| V | Ванадий | 23 | 50,9415 (1) | 5 | 4 | |
| W | Вольфрам | нем. Wolfram | 74 | 183,84 (1) | 6 | 6 |
| Xe | Ксенон | 54 | 131,293 (6)2 3 | 18 | 5 | |
| Y | Иттрий | 39 | 88,90585 (2) | 3 | 5 | |
| Yb | Иттербий | 70 | 173,04 (3)2 | 6 | ||
| Zn | Цинк | 30 | 65,409 (4) | 12 | 4 | |
| Zr | Цирконий | 40 | 91,224 (2)2 | 4 | 5 |
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Переходные металлы |
| Лёгкие металлы | Полуметаллы | Неметаллы | Галогены | Инертные газы |
Другие символы, которые выглядят как символы элементов
Ссылки
Полезное
Смотреть что такое «Список химических элементов по символам» в других словарях:
Список химических элементов по атомным номерам — См. также: Список химических элементов по символам и Алфавитный список химических элементов Это список химических элементов, упорядоченный в порядке возрастания атомных номеров. В таблице приводятся название элемента, символ, группа и период в… … Википедия
Алфавитный список химических элементов — См. также: Список химических элементов по атомным номерам и Список химических элементов по символам Алфавитный список химических элементов. Азот N Актиний Ac Алюминий Al Америций Am Аргон Ar Астат At … Википедия
ISO 4217 — (ИСО 4217) Коды для представления валют и фондов Codes for the representation of currencies and funds (англ.) Codes pour la représentation des monnaies et types de fonds (фр.) … Википедия
Римские цифры — Часы куранты Спасской башни Системы счисления … Википедия