Сидеропенический синдром что это такое
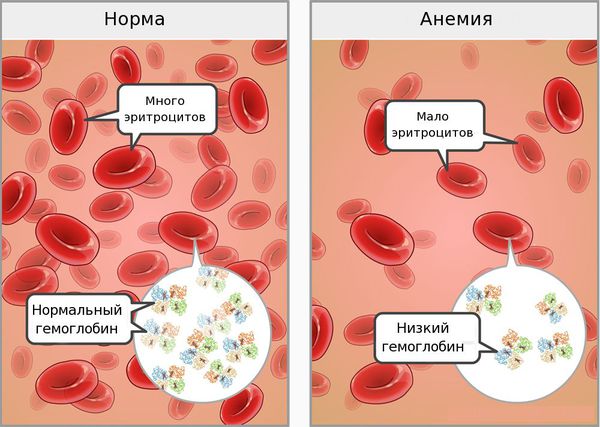
Анемия: причины,симптомы и лечение.
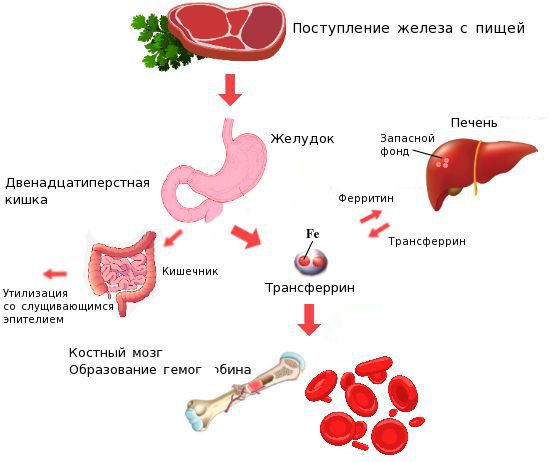
Всасывание железа
Ежедневная потребность организма в железе у женщин 1,5-2 мг. В желудочно-кишечном тракте у здорового человека всасывается только 10% от общего количества железа, съеденного с пищей (1–2 мг). Улучшают всасывание железа: аскорбиновая кислота, фруктоза, цитраты, содержащиеся в свежих фруктовых соках, бананах, красных бобах, цветной капусте. Уменьшают всасывание железа из пищи: фосфаты, дубящие вещества, комплексные полисахариды, полифенолы, оксалаты, содержащиеся в крупах, яйцах, сыре, чай. Действие чая, содержащего танин, особенно поразительно: при его употреблении усвоение железа шестикратно снижается (до 2%).
В пищевых продуктах содержится 2 типа железа — гемовое (органическое) и негемовое (неорганическое). Наиболее полно всасывается гемовое железо. Такое железо содержится в нежирных сортах мяса, рыбы, птицы. Поглощение железа из продуктов животного происхождения варьирует от 6% до 22%, в то время как из растительной пищи усваивается около 1% железа. Подавляют всасывание железа жиры (сало, масло сливочное и растительное), соевый протеин, кофе, молочные продукты.
В организме человека содержится около 3-4 г железа, из которых 70% – жизненно необходимое, активное, 30% – депонированное в тканях и 0,1% – транспортное. Основная масса железа сконцентрирована в гемоглобине (около 1500-3000 мг). В депо (ферритин и гемосидерин внутренних органов) находится от 500 до 1500 мг, в миоглобине и различных дыхательных ферментах – не более 500 мг.
Причины дефицита железа:
1.Повышенная потребность организма в железе при беременности
За период беременности организм женщины тратит более 1000 мг железа.Потребность женщины в железе во время беременности может достигать 15-18 мг/сут, в то время как вне беременности ежедневная потребность составляет около 2 мг. Это приводит к уменьшению депонированного железа у всех женщин к концу беременности.
Для восстановления запасов железа, расходуемого в течение беременности, родов и грудного вскармливания, требуется не менее 2-3 лет.
2.Алиментарный дефицит железа.
Этот вид дефицита железа встречается при недостаточном его поступлении с продуктами питания: вегетарианство, увлечение диетами с низким содержанием животных белков.
При беременности вегетарианская диета недопустима.
4. Особенности течения беременности на ранних сроках
Этот вид анемии обусловлен снижением зоны всасывания железа при гастритах, дуоденитах, энтеритах, резекции желудка и обширных участков тонкой кишки.
Осложнения беременности при железодефицитной анемии
Анемия беременных является патологическим фоном, который способствует развитию целого ряда осложнений беременности и родов.
Проявления железодефицитной анемии
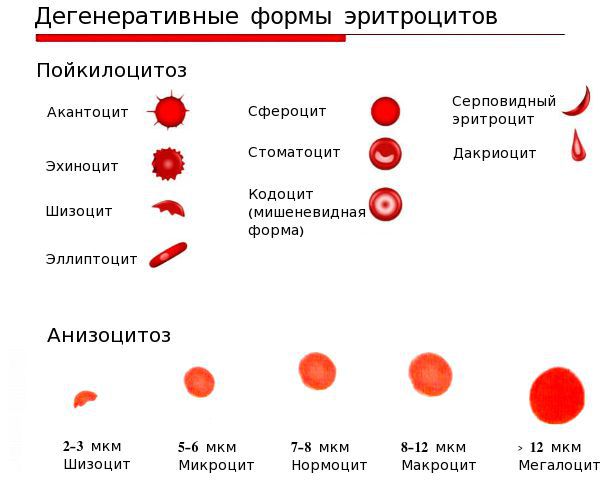
Проявления анемии складываются из 2 основных синдромов: сидеропенического и общеанемического.
Сидеропенический синдром проявляется:
Общеанемический синдром проявляется при снижении уровня гемоглобина и эритроцитов.
Его проявления:
Диета при железодефицитных состояниях
Необходимо помнить о том, что восполнение дефицита железа с помощью диетотерапии невозможно, хотя при установлении железодефицитного состояния следует соблюдать четкие рекомендации по питанию, как одного из компонентов комплексной терапии анемии.
При составлении рациона необходимо учитывать не общее содержание железа в продуктах питания, а его форму, которая определяет его всасывание. Так, абсорбция железа из мясных продуктов (содержащих гемовое железо), составляет 17-22%, из растительных продуктов (негемовое железо) – только 2-3%.
Необходимо учитывать содержание железа в продуктах питания.
Что такое железодефицитная анемия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Головко О. А., терапевта со стажем в 12 лет.
Определение болезни. Причины заболевания
Основные причины развития ЖДА:
Группы риска по ЖДА:
Симптомы железодефицитной анемии
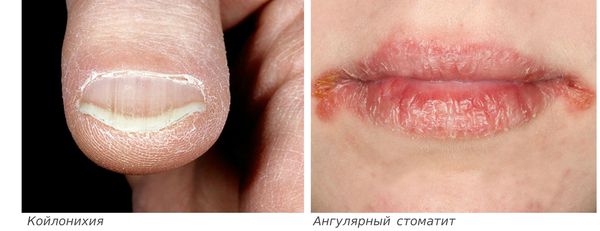
Сидеропенический синдром связан с недостатком железа в тканях и проявляется нарушениями со стороны кожи и слизистых оболочек:
Анемический синдром проявляется слабостью, быстрой утомляемостью, сонливостью днём и плохим засыпанием ночью, головокружениями, обмороками, частыми головными болями, шумом в ушах, мельканием «мушек» перед глазами, одышкой при физической нагрузке, увеличением частоты сердечных сокращений, неприятными ощущениями в области сердца, пониженным артериальным давлением.
При ЖДА может наблюдаться умеренное повышение температуры тела (до 37,5 ° С), которое исчезает после лечения железосодержащими препаратами.
Зачастую снижение содержания гемоглобина происходит постепенно, при этом многие органы адаптируются к анемии. В связи с этим жалобы больных не всегда соответствуют показателям содержания гемоглобина. Многие пациенты, особенно женщины, свыкаются с неважным самочувствием, приписывая его переутомлению, психическим и физическим перегрузкам.
Патогенез железодефицитной анемии
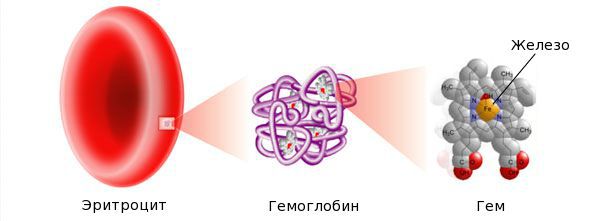
Железо — жизненно важный для человека микроэлемент, который входит в состав гемоглобина крови, миоглобина мышц, отвечает за транспорт кислорода в организме и протекание многих биохимических реакций.
Железо поступает в организм в виде двухвалентного (мясная пища) и трёхвалентного (растительная пища) ионов. Первый всасывается легко, второй под действием соляной кислоты в желудке должен превратиться в двухвалентный. Далее он поступает в двенадцатиперстную кишку и начальные отделы тощей кишки, затем двухвалентное железо вновь переводится в трёхвалентное. В дальнейшем часть этого железа поступает в депо слизистой оболочки тонкой кишки, а другая всасывается в кровь, где соединяется с трансферрином (белком-переносчиком железа, синтезируемым в печени). Если содержание железа в организме избыточно, то оно задерживается в клетках кишечника и в дальнейшем удаляется из организма вместе со слущивающимся эпителием.
При снижении кислотности в желудке (атрофический гастрит, резекция желудка, приём препаратов, снижающих кислотность, гиповитаминоз С) нарушается ионизация железа в желудке, что ведёт к дальнейшему нарушению всасывания железа и развитию ЖДА. При резекции и хронических заболеваниях кишечника (дуоденит, хронический энтерит, целиакия) нарушается всасывание железа, что опять же приводит к развитию ЖДА.
Ферменты, содержащие железо, принимают участие в синтезе гормонов щитовидной железы и поддержании иммунитета, поэтому при дефиците железа нарушаются защитные и адаптационные силы организма и весь обмен веществ.
Классификация и стадии развития железодефицитной анемии
Выделяют три стадии железодефицитных состояний: прелатентный дефицит железа, латентный дефицит и железодефицитную анемию (ЖДА).
Для прелатентного дефицита железа характерно снижение запасов железа в костном мозге:
На этой стадии симптомов может не быть.
Латентный (скрытый) дефицит железа влияет на тканевой обмен. На этой стадии запасы железа начинают истощаться, но организм ещё не успел отреагировать снижением гемоглобина. Возникают первые проявления заболевания — человека может беспокоить повышенная утомляемость, слабость, одышка при физической нагрузке, ломкость ногтей, сухость кожи, выпадение волос. Но эти симптомы пока выражены незначительно.
Латентный дефицит железа характеризуется:
На третьей стадии (собственно ЖДА) снижается уровень гемоглобина и эритроцитов.
Для железодефицитной анемии характерно:
Для этой стадии характерна ярко выраженная клиническая симптоматика, хотя зачастую люди списывают эти проявления на переутомление.
В норме уровень гемоглобина в крови: у женщин — 120-140 г/л, у мужчин — 130-160 г/л.
Степени тяжести ЖДА (на основании снижения уровня гемоглобина Hb):
Осложнения железодефицитной анемии
У беременных с ЖДА повышается риск преждевременных родов и задержки роста плода. У детей недостаток железа приводит к задержке роста и интеллектуального развития.
Диагностика железодефицитной анемии
Минимальный объём исследований:
Биохимический анализ крови покажет снижение уровня сывороточного железа и ферритина, увеличение общей железосвязывающей способности сыворотки и растворимых трансферриновых рецепторов, снижение коэффициента насыщения трансферрина железом (НТЖ).
Лечение железодефицитной анемии
Лечение проводится железосодержащими препаратами, в основном для приёма внутрь и значительно реже для внутримышечного или внутривенного введения. Препараты нельзя принимать без назначения врача, так как переизбыток железа опасен своими последствиями — поражением зубов, развитием гепатита, цирроза печени, сахарного диабета и сердечно-сосудистых заболеваний. Также возможны тяжёлые аллергические реакции.
При анемии следует изменить рацион питания и включить в него продукты, содержащие железо в наиболее усвояемой форме — телятину, говядину, баранину, мясо кролика, печень, язык. Важно помнить, что из мяса усваивается до 30 % железа, из рыбы — 10 %, а из растительной пищи — всего лишь 3-5 %.
При анемии коррекция дефицита железа не может быть достигнута только изменением питания. Причина этого в том, что усвоение железа из пищи ограничено, а в препаратах оно содержится в большей концентрации.
При анемии лёгкой и средней степени тяжести препараты железа лучше принимать внутрь вместе с аскорбиновой или фолиевой кислотой, так как они улучшают всасываемость железа.
Если препараты железа невозможно применять внутрь (например, при непереносимости или нарушении всасывания железа в кишечнике), то их вводят внутримышечно или внутривенно. Инъекционные препараты железа используют только в стационаре, так как они могут вызывать шоковые реакции. Их нельзя применять во время беременности и лактации.
При тяжёлой анемии (гемоглобин менее 70 г/л) и по жизненным показаниям в условиях стационара проводят переливание эритроцитарной массы.
В качестве лечебно-профилактического средства пациентам, у которых нет сахарного диабета, можно использовать гематоген. В его состав входят железо, связывающее белки, получаемые из крови крупного рогатого скота, а также аскорбиновая кислота и необходимый комплекс белков. Однако это достаточно калорийный продукт — в 100 г гематогена содержится 350–500 килокалорий, об этом следует помнить, включая его в рацион.
Прогноз. Профилактика
Прогноз при ЖДА благоприятный. В большинстве случаев заболевание успешно лечится амбулаторно. Но если не анемию не лечить, то она может прогрессировать, ухудшая общее самочувствие. ЖДА сложно скорректировать в следующих случаях:
Для профилактики ЖДА следует:
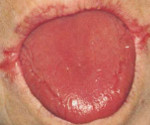
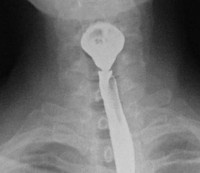
Синдром Пламмера-Винсона — патологическое дисфагическое состояние, обусловленное сужением пищевода и атрофией эпителия верхних отделов ЖКТ на фоне железодефицитной анемии. Проявляется затруднениями глотания в сочетании с бледностью кожи и слизистых, головокружениями, болезненностью и покраснением языка, трещинами в углах рта, сухостью кожи, деформацией ногтевых пластин. Диагностируется с помощью общего анализа крови, определения уровней железа, ферритина, проведения эзофагоскопии, рентгенографии пищевода. Для лечения используют препараты, содержащие железо, В-витаминные комплексы. При стойкой обструкции выполняют баллонную дилатацию, бужирование пищевода.
МКБ-10
Общие сведения
Сидеропеническую дисфагию (болезнь Пламмера-Винсона, синдром Келли-Паттерсона) в 1911-1919 годах независимо друг от друга описали американские физиологи Г.С. Пламмер, П.П. Винсон и британские ларингологи Д.Р. Паттерсон, А. Браун-Келли. Заболеванию более подвержены белые женщины климактерического возраста, хотя известны случаи диагностики синдрома у подростков и даже детей. Патология выявляется крайне редко, самые высокие показатели заболеваемости отмечались в XX столетии на территории скандинавских стран. Уменьшение распространенности сидеропенической дисфагии связано с улучшением питания и эффективной медикаментозной коррекцией железодефицитных состояний. Актуальность своевременной диагностики расстройства обусловлена высоким риском развития сопряженного рака пищевода.
Причины синдрома Пламмера-Винсона
Хотя заболевание стойко ассоциировано с железодефицитной анемией и гипосидерозом, его этиология на сегодняшний день окончательно не установлена. С учетом характерных патоморфологических и клинических проявлений специалистами в сфере гастроэнтерологии, гематологии, иммунологии предложено несколько теорий происхождения сидеропенической дисфагии:
В качестве предпосылок к развитию расстройства рассматривается неполноценное питание, наследственная несостоятельность ферментов, участвующих в метаболизме железа, заболевания, сопровождающиеся хронической кровопотерей (метроррагии, геморрой, язвенная болезнь и др.), нарушение всасывания макроэлементов, витаминов при ахилии, энтеритах, другой патологии ЖКТ. У пожилых пациентов определенную роль могут играть инволюционные нарушения утилизации железа.
Патогенез
Механизм развития синдрома Пламмера-Винсона продолжает изучаться. Считается, что патогенез сидеропенической дисфагии основан на системных изменениях в тканях, связанных с железо-витаминной недостаточностью. В эпителиальной оболочке пищеварительных органов происходят гиперкератические и атрофические процессы, приводящие к сухости и истончению слизистых. Ситуация усугубляется повреждением железистой ткани с апоптозом секретирующих клеток, эпителиоцитов выводных протоков желез, выделением более густого секрета. В результате в верхнем отделе пищевода образуются небольшие липкие пленки (пищеводные мембраны), которые задерживают продвижение твердой части пищи и провоцируют спастическое сокращение мускулатуры. Атония дистальной части пищеводной трубки, вызванная низким содержания миоглобина в мышечных клетках, нарушает эзофагеальную перистальтику и препятствует нормальному прохождению пищевого комка.
Симптомы синдрома Пламмера-Винсона
Клиническая картина заболевания развивается постепенно. Вначале возникают признаки анемического синдрома: бледность кожи, слизистых оболочек, быстрая утомляемость, головные боли и головокружение, нечеткость зрения, учащение пульса, снижение артериального давления. Типичные симптомы сидеропенической дисфагии — воспалительная атрофия слизистой оболочки языка, которая проявляется его покраснением, жжением, сглаженностью, сухостью, болезненностью при пережевывании пищи. Характерно выделение небольшого количества вязкой слюны, появление чувствительных трещин в углах губ (ангулярный хейлит). У многих пациентов выявляется кератоконъюнктивит, кожа становится сухой, ногти — ложкообразными, отмечаются признаки себореи. При прогрессировании заболевания обнаруживается дисфагия (нарушение глотания) вначале твердой, а затем и жидкой пищи. Возможны боли и тяжесть в левом подреберье, обусловленные увеличением селезенки. Типично сезонное обострение синдрома в весенний период.
Осложнения
При тяжелом течении симптомокомплекса Пламмера-Винсона у пациентов наблюдается стремительная потеря массы тела вплоть до кахексии, что вызвано невозможностью проглатывания пищи из-за значительного сужения пищевода. Длительное белково-энергетическое голодание ведет к дистрофическим изменениям в мышцах и внутренних органах. При выраженном снижении уровня гемоглобина может возникать анемическая кома, вызванная недостаточным поступлением кислорода в структуры головного мозга. При вовлечении в атрофический процесс слизистой желудка развивается гастрит с пониженной кислотностью, усугубляющий расстройства пищеварения. Наиболее опасное осложнение синдрома, выявляющееся у 3-15% больных, — плоскоклеточный рак пищевода, глотки, реже наблюдаются злокачественные неоплазии дыхательных путей.
Диагностика
Постановка диагноза может представлять затруднения вследствие неспецифичной клинической картины и низкой распространенности заболевания. О возможном наличии синдрома Пламмера-Винсона свидетельствует сочетание дисфагии с сидеропенической анемией и сужением пищевода. Наиболее информативными в диагностическом плане являются:
Для исключения других причин анемического синдрома может назначаться исследование клеточного состава костного мозга (миелограмма). Для обнаружения структурных изменений при выраженной спленомегалии производят УЗИ селезенки. Дифференциальную диагностику проводят с дивертикулами и злокачественными опухолями пищевода, кардиоспазмом, эзофагоспазмом, ахалазией пищевода, склеродермией, стриктурами органа после термических или химических ожогов, грыжей пищеводного отверстия диафрагмы, новообразованиями средостения, наследственными формами анемий, синдромом функциональной дисфагии, болезнью Меллера-Гунтера. Кроме осмотра гастроэнтеролога пациенту рекомендованы консультации онколога, хирурга, оториноларинголога, терапевта, гематолога, невролога, иммунолога, ревматолога.
Лечение синдрома Пламмера-Винсона
Тактика ведения пациента основана на вероятных причинах и механизмах развития заболевания. Обычно стойкого терапевтического эффекта удается достичь консервативными методами и изменением рациона с употреблением достаточного количества белка, продуктов, содержащих витамины группы В. Рекомендованная схема лечения включает следующие лекарственные средства:
При наличии сведений о патологических состояниях, осложнившихся анемией и сидеропенией, этиопатогенетическая терапия основного заболевания проводится по соответствующим протоколам лечения. Пациентам со стойкой дисфагией и выраженной эзофагеальной обструкцией для разрыва пленок, устранения спазма выполняется бужирование или баллонная дилатация пищевода.
Прогноз и профилактика
Исход заболевания зависит от выраженности структурных изменений пищевода и наличия функциональных расстройств других органов. Прогноз относительно благоприятный, после проведения комплексного лечения у большинства пациентов с расстройством Пламмера-Винсона наступает выздоровление. Меры профилактики заболевания неспецифичны, предусматривают соблюдение сбалансированной диеты, употребление продуктов с высоким содержанием железа и витамина С, посильные физические нагрузки, отказ от вредных привычек. Для предупреждения развития осложнений все больные, перенесшие синдром сидеропенической дисфагии, после выздоровления подлежат длительному диспансерному наблюдению.
Лечение анемии
Железодефицитная анемия ЖДА — это гипохромная микроцитарная анемия, развивающаяся в результате абсолютного дефицита железа в организме.
Помимо анемического синдрома, для нее характерно нарушение функции кожи, ее придатков и слизистых оболочек — сидеропенический синдром.
ЖДА — это последняя стадия дефицита железа; до появления анемии часто при подробном расспросе и осмотре пациента можно обнаружить проявления сидеропении, что позволит своевременно выявить причину дефицита железа и предотвратить развитие ЖДА.
Эпидемиология
Впервые ЖДА описал немецкий врач Й. Ланге в 1554 г., а препараты для ее лечения впервые применил Т. Сиденгам в XVII в. Анемии, развивающиеся в результате дефицита железа в организме, наиболее широко распространены в клинической практике. По данным ВОЗ, около 2,5 млрд человек на Земле имеют скрытый дефицит железа и 1 млрд человек страдает ЖДА.
Достоверно доказано влияние ЖДА на увеличение частоты материнской и детской смертности. ЖДА встречаются у 12–13 % детей в возрасте от 6 мес. до 2 лет. В развивающихся странах этот показатель значительно выше: в Индии и странах Африки он достигает 72–76 %. В развитых странах Европы и Северной Америки ЖДА выявляется у 7,5–11 % всех женщин детородного возраста, а у 20–25 % наблюдается скрытый тканевой дефицит железа. Значительно большая частота ЖДА в странах Азии, Африки и Латинской Америки, где она достигает эпидемических величин и составляет 45–60 %. Из всех анемий, встречающихся в клинической практике, около 80 % являются железодефицитными. В Российской Федерации сведений по частоте ЖДА нет, однако, по нашим данным, в Москве ее частота составляет 30–35 % среди женщин детородного возраста, а скрытого дефицита железа — до 60 %.
Развитие анемии
Со временем дефицит железа прогрессирует, течет долгие годы латентно, а затем, после полного истощения запасов железа в депо, развивается ЖДА. Основной механизм развития анемии — нарушение гемоглобинообразования в эритрокариоцитах костного мозга. В основе патологии эритропоэза при дефиците железа лежит нарушение синтеза гема, в результате которого гемоглобинизация эритронормобластов запаздывает по сравнению с процессом обратного развития ядерных структур. Поскольку синтез гемоглобина из-за дефицита железа страдает в большей степени, чем образование эритроцитов, для ЖДА при сравнительно умеренном снижении числа эритроцитов свойственно более выраженное падение содержания в них гемоглобина, что проявляется гипохромией эритроцитов и развитием гипохромной микроцитарной анемии.
Второй патологический механизм, который имеет место в условиях дефицита железа, — это снижение образования других важнейших белков, участвующих в накоплении и транспорте кислорода. Уменьшается содержание миоглобина в поперечнополосатой мускулатуре. Нарушение образования цитохромов и каталаз приводит к угнетению энергетического обмена всех клеток организма, при этом в основном страдают быстро делящиеся ткани (кожа и слизистые оболочки).
В зависимости от причин, вызывающих дефицит железа, выделяется пять групп ЖДА:
1) хронические постгеморрагические ЖДА;
2) ЖДА, связанные с нарушением всасывания и поступления железа с пищей;
3) ЖДА, связанные с недостаточным исходным уровнем железа в организме (чаще у детей);
4) ЖДА, обусловленные повышением потребности организма в железе (без кровопотери);
5) ЖДА, связанные с нарушением транспорта железа.
Стадии дефицита железа
В настоящее время выделяют несколько стадий дефицита железа:
1. Предрасположенность к развитию железодефицита (вегетарианство, подростковый возраст в сочетании с нарушением менструального цикла у девочек, частые роды, наличие хронических заболеваний ЖКТ или женской репродуктивной системы, связанных с кровопотерей).
2. Предлатентный дефицит железа. На этой стадии нет никаких лабораторных критериев дефицита железа, однако можно определить повышение абсорбции 59Fe3+ в ЖКТ, которое может превышать 50 % (в норме 10–15 %).
3. Латентный дефицит железа. Характеризуется развитием сидеропенического синдрома, снижением запасов железа в организме по данным лабораторных исследований.
Лечение анемии
Лечение ЖДА строится на следующих принципах. До начала лечения обязательно следует выявить и по возможности устранить причину развития ЖДА
Для лечения надо использовать только лекарственные железосодержащие препараты. Вне зависимости от тяжести анемии лечение начинается с пероральных препаратов, исключая противопоказания (острая язва желудка и двенадцатиперстной кишки, эрозивный гастрит), невозможность использования пероральных препаратов (нарушение глотания, отсутствие сознания, интубация и др.).
Лечебная доза пероральных препаратов железа составляет 100– 200 мг элементарного железа в сутки (максимально 300 мг), разделенная на 2 приема. Использование парентеральных средств возможно только при доказанном абсолютном дефиците железа, лечение должно проводиться только в стационаре, вводится только расчетная доза препарата. Внутримышечное введение препаратов железа в настоящее время не применяется. Трансфузии эритроцитарной массы обычно не используются. Они показаны только пожилым людям при наличии тяжелой анемии.
Сроки лечения при использовании пероральных препаратов железа зависят от тяжести анемии, составляют 3–4 мес. при использовании препаратов Fe2+ или 4–6 мес. при использовании препаратов Fe3+.