мэг что это такое химия
Моноэтиленгликоль
Этиленглико́ль (гликоль; 1,2-диоксиэтан; 1,2-этандиол), HO—CH2—CH2—OH — простейший представитель многоатомных спиртов.
В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Вещество не имеет запаха и обладает сладковатым вкусом. Попадание этиленгликоля или его растворов внутрь приводит к необратимым изменениям в организме и к летальному исходу (подробнее [Monograph.pdf]).
Содержание
Получение
Основной промышленный метод получения этиленгликоля — гидратация этилена окиси при 10 ат и 190—200°С или при 1 ат и 50—100°С в присутствии 0,1—0,5% серной (или ортофосфорной) кислоты; в качестве побочных продуктов при этом образуются диэтиленгликоль и незначительное количество высших полимергомологов этиленгликоля.
Применение
Важным свойством этиленгликоля является способность понижать температуру замерзания воды, поэтому вещество нашло широкое применения как компонент автомобильных антифризов и тормозных жидкостей. Корозионно активен, поэтому применяется с ингибиторами коррозии.
Этиленгликоль является исходным сырьём для производства взрывчатого вещества нитрогликоля.
Также применяется в производстве целлофана, полиуретанов и ряда других продуктов. В ограниченных масштабах этиленгликоль так же применяют как растворитель печатных и некоторых других красок, в производстве чернил и паст для шариковых ручек, в органическом синтезе.
Меры безопасности
Статьи
Что лучше использовать для системы обогрева дома: воду или антифриз
Стандартным теплоносителем для автономных систем обогрева частных домов является вода. Ее используют уже в течение многих лет. Но последнее время производители стали предлагать переход на антифриз, отмечая ряд его преимуществ. Чтобы понять, стоит ли применять незамерзающую жидкость, не является ли она обычным маркетинговым ходом, что вообще лучше для установленной отопительной системы, следует рассмотреть и провести сравнение двух видов теплоносителя.
Замена теплоносителя в системе отопления загородного дома
В современных системах автономного обогрева вместо обычной воды применяется антифриз. У такого вещества есть срок службы. Поэтому по его истечению надо проводить замену незамерзающей жидкости в котле во избежание появления проблем в работе всей отопительной установки. Поменять теплоноситель в частном доме можно самостоятельно. Для этого надо знать ряд правил, учитывать важные моменты и следовать алгоритму.
Применение антифриза в отопительной системе частного дома
Даже если система отопления отличается повышенной надежностью и хорошим качеством исполнения, вероятность промерзания в зимний период исключить нельзя. Применение антифриза в отопительной системе частного дома существенно снижает риск этой неприятности. Рассмотрим, какие преимущества у « незамерзаек », каким требованиям они должны отвечать, каковы правила их использования.
Водно-гликолевый раствор: что это?
Моноэтиленгликоль: история получения, свойства, область использования
Моноэтиленгликоль (МЭГ) — двухатомный спирт, простейший представитель категории многоатомных спиртов, называемых также полиолами. Это бесцветная, несколько маслянистая жидкость со сладковатым привкусом и без запаха. Многие задают вопрос: есть ли различия между моноэтиленгликолем и этиленгликолем? Различия нет. Это наименования одного и того же соединения.
Наши менеджеры не только оформят заказ, но и помогут грамотно сформировать его, а также предоставят всю необходимую информацию и материалы для успешной реализации.
Для заказа продукции вы можете обратиться в отдел сбыта по телефону +7(8313) 27-52-47.
Отгрузка продукции производится в любой подходящей для Вас таре и отправляется любым, удобным для Вас способом, в следующие города:
Понятие и свойства
Этиленгликоль (МЭГ, моноэтиленгликоль) – химический реактив, который 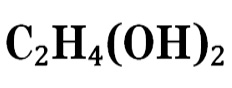
К списку свойств этиленгликоля можно отнести и свойства гликолей. Так, с такими химреактивами, как органические кислоты, образует сложные эфиры, щелочи и щелочные металлы – гликоляты. При окислении этиленгликоля возможно образование смесей гликолевого альдегида и щавелевой кислоты купить которую по доступной цене предлагает наш интернет магазин, а при окислении молекулярным кислородом – смесь муравьиной кислоты.
Данное химическое соединение выпускается двух марок: антифризный и волоконный, к последнему предъявляют очень серьезные требования к количественному содержанию примесей альдегидов.
Открытие этиленгликоля
Данный химический реактив впервые был получен химиком Вюрцом во Франции в середине XIX века. До начала Первой мировой войны он не имел широкого применения, позже в Германии во время военных действий его стали использовать как заменитель глицерина в процессе производства взрывчатых веществ. К 1930 году этиленгликоль стал активно использоваться многими известными производителями динамита.
Токсические и ядовитые действия этиленгликоля зависят от ряда факторов, среди которых следует выделить:
— количество;
— индивидуальную чувствительность организма;
— состояние нервной системы;
— степень наполнения желудка и другие.
Дозы, которые могут привести в организме к необратимым изменениям и вызвать смертельное отравление этиленгликолем, могут варьироваться от 100 до 700 мл. По данным ряда исследований для человека летальной дозой является 50-200 мл. При поражении этиленгликолем смертность очень высока и составляет примерно 60 % всех случаев отравления.
Применение
Области применения данного химического реактива весьма разнообразны. 
— в машиностроительной (в производстве тосола, тормозных жидкостях, антифриза);
— в текстильной (как растворитель красящих веществ);
— энергетической (как теплоноситель в отопительных системах);
— в химической (при производстве полимеров: целлофана, полиуретана, при синтезе высокотемпературных растворителей, для предотвращения процесса образования гидрата метана);
— электротехнической (в качестве вещества, защищающее объекты от замораживания, при производстве конденсаторов, как составляющий компонент в системе жидкостного охлаждения компьютеров);
— в военной (как исходное сырьё при производстве нитрогликоля – взрывоопасного вещества).
Меры безопасности, хранение
Хранить этиленгликоль необходимо в лабораторной посуде из стали, стойкой к коррозии, в закрытых неотапливаемых помещениях.
В связи с тем, что этиленгликоль ядовит, важно не допускать его попадания внутрь организма, так как это токсичное вещество влечет за собой необратимые изменения в работе внутренних органов и может привести к летальному исходу.
Этиленгликоль в соответствии с классификацией химвеществ причислен к третьему классу опасности: он взрывоопасен и горюч, поэтому при работе с ним следует придерживаться особых мер безопасности, используя защитные средства для органов дыхания – противогазы, респираторы, маски; для органов зрения – защитные очки; для кожных покровов – перчатки нитроловые, фартук, бахилы и другие резинотехнические изделия. Лабораторное оборудование и приборы должны быть использованы согласно требованиям инструкции по безопасности при работе с ядовитыми веществами.
Необходимо знать, что в случае отравления МЭГ первая доврачебная помощь должна быть проведена в срочном порядке. Это, прежде всего, промывание желудка плюс слабительные, вызывание рвоты, врачебная – назначение антидота.
Качественные химические реактивы по доступной цене
К выбору приобретения химических реактивов, а также любого другого лабораторного оборудования в Москве следует отнестись с особой ответственностью, так как от качества данной продукции зависят и результаты исследовательских процессов. Как кальций хлористый купить или молочную кислоту купить, так и этиленгликоль стоит в специализированных магазинах, где соблюдаются требования по хранению и отпуску товаров. Одним из таких является магазин химических реактивов Москва розница и оптовая торговля Prime Chemicals Group. Мы специализируемся только по продаже только сертифицированного лабораторного оборудования и химвеществ.
«ПраймКемикалсГрупп» – надежный помощник в оснащении Вашей лаборатории!
Этиленгликоль (моноэтиленгликоль), диэтиленгликоль, пропиленгликоль и их расстворы
Диэтиленгликоль
Физические свойства диэтиленгликоля и этиленгликоля близки. Диэтиленгликоль отличается от этиленгликоля лучшей растворимостью, меньшей летучестью, более высокой температурой кипения и вязкостью. Температура замерзания водного раствора несколько выше чем у этиленгликоля, хотя и незначительно.
Диэтиленгликоль превосходно смешивается с водой и большим количеством различных органических соединений: одноатомными спиртами, пропиленгликолем и другими гликолями, этилцеллозольвом и другими целлозольвами и карбитолами, этаноламином, ацетоном, фенолом, уксусной кислотой, фурфуролом, пиридином в широком интервале температур. В диэтиленгликоле не растворимы минеральные и многие растительные масла.
Диэтиленгликоль реже используется в качестве антифриза по сравнению с этиленгликолем. Однако скорее это связано не с тем, что он имеет менее подходящие для этой цели свойства (температура замерзания водных растворов и другие характеристики различаются не столь значительно) а с тем, что этиленгликоль является более привычным и доступным продуктом и объем его производства больше. При этом в некоторых случаях применение диэтиленгликоля в смеси этиленгликолем позволяет получать антифризы с более высокими эксплуатационными свойствами.
Диэтиленгликоль используется в качестве избирательного (селективного) растворителя с целью экстракции различных веществ из нефти и нефтепродуктов, таких как ксилол, толуол, бензол, т. к. хорошо растворяет ароматические углеводороды и не способен к растворению парафиновых и нафтеновых углеводородов. Благодаря более высокой растворимости диэтиленгликоль предпочтительней этиленгликоля для этих целей. При этом получаются продукты высокой степени чистоты.
Благодаря высокой гигроскопичности диэтиленгликоль широко используется для удаления водяных паров из газов, прокачиваемых по трубопроводам. Удалять водяные пары необходимо с целью предотвращения образования в трубопроводах конденсата и ледяных пробок. Также с помощью диэтиленгликоля можно очищать газы и от других примесей, например сероводорода и углекислого газа.
Дигликоль применяется в качестве сырья при синтезе различных полимерных материалов: ненасыщенных полиэфирных смол, щелочестойких алкидных смол, термостойких и огнестойких полиуретанов, а также используется при синтезе различных модифицирующих компонентов для полимерных материалов: пластификаторов, стабилизаторов, антиоксидантов, активаторов полимеризации, отвердителей эпоксидных смол.
Токсичность диэтиленгликоля ниже чем этиленгликоля. Пары не представляют высокой опасности при вдыхании. Однако прием внутрь также чрезвычайно опасен.
Водные растворы пропиленгликоля и этиленгликоля
| Раствор | Температура замерзания | Плотностьпри 20˚С | Раствор | Температура замерзания | Плотностьпри 20˚С |
| Пропиленгликоль 30% | -13˚С | 1,023 | Этиленгликоль 30% | -15˚С | 1,038 |
| Пропиленгликоль 35% | -20˚С | 1,028 | Этиленгликоль 35% | -20˚С | 1,045 |
| Пропиленгликоль 40% | -25˚С | 1,032 | Этиленгликоль 40% | -25˚С | 1,052 |
| Пропиленгликоль 45% | -30˚С | 1,035 | Этиленгликоль 45% | -30˚С | 1,058 |
| Пропиленгликоль 50% | -35˚С | 1,038 | Этиленгликоль 50% | -35˚С | 1,064 |
| Пропиленгликоль 55% | -45˚С | 1,040 | Этиленгликоль 55% | -43˚С | 1,071 |
| Пропиленгликоль 60% | -55˚С | 1,042 | Этиленгликоль 60% | -50˚С | 1,077 |
| Пропиленгликоль 65% | -60˚С | 1,043 | Этиленгликоль 65% | -60˚С | 1,083 |
| Пропиленгликоль 70% | -65˚С | 1,044 | Этиленгликоль 70% | -70˚С | 1,088 |
Из-за склонности растворов гликолей к переохлаждению фактическая температура замерзания может отличаться в пределах 2˚С.
Плотность водных растворов этиленгликоля при различных температурах
| Температура,˚С | Концентрация этиленгликоля ГОСТ 19774 высшего сорта в водном растворе (по массе) | |||||||||
| 10% | 20% | 30% | 40% | 50% | 60% | 70% | 80% | 90% | 100% | |
| -45 | 1,11 | 1,125 | 1,137 | |||||||
| -40 | 1,108 | 1,122 | 1,134 | |||||||
| -35 | 1,087 | 1,105 | 1,12 | 1,131 | ||||||
| -30 | 1,086 | 1,103 | 1,118 | 1,129 | ||||||
| -25 | 1,068 | 1,085 | 1,101 | 1,115 | 1,126 | |||||
| -20 | 1,067 | 1,083 | 1,098 | 1,112 | 1,123 | 1,133 | ||||
| -15 | 1,066 | 1,081 | 1,096 | 1,109 | 1,12 | 1,13 | 1,137 | |||
| -10 | 1,017 | 1,32 | 1,048 | 1,064 | 1,079 | 1,094 | 1,107 | 1,117 | 1,127 | 1,134 |
| -5 | 1,016 | 1,31 | 1,047 | 1,062 | 1,077 | 1,091 | 1,104 | 1,114 | 1,123 | 1,131 |
| 0 | 1,015 | 1,03 | 1,046 | 1,061 | 1,075 | 1,088 | 1,101 | 1,111 | 1,12 | 1,127 |
| 5 | 1,014 | 1,029 | 1,044 | 1,059 | 1,073 | 1,085 | 1,097 | 1,108 | 1,116 | 1,124 |
| 10 | 1,013 | 1,027 | 1,042 | 1,056 | 1,07 | 1,083 | 1,094 | 1,105 | 1,113 | 1,120 |
| 15 | 1,012 | 1,026 | 1,041 | 1,054 | 1,067 | 1,08 | 1,091 | 1,102 | 1,10 | 1,117 |
| 20 | 1,011 | 1,024 | 1,038 | 1,052 | 1,064 | 1,077 | 1,088 | 1,098 | 1,106 | 1,113 |
| 25 | 1,009 | 1,022 | 1,036 | 1,05 | 1,061 | 1,074 | 1,084 | 1,094 | 1,102 | 1,11 |
| 30 | 1,007 | 1,021 | 1,034 | 1,047 | 1,058 | 1,071 | 1,081 | 1,091 | 1,099 | 1,106 |
| 35 | 1,006 | 1,019 | 1,032 | 1,045 | 1,055 | 1,067 | 1,078 | 1,087 | 1,096 | 1,103 |
| 40 | 1,004 | 1,017 | 1,029 | 1,041 | 1,052 | 1,064 | 1,074 | 1,084 | 1,093 | 1,099 |
| 45 | 1,002 | 1,014 | 1,026 | 1,038 | 1,049 | 1,06 | 1,071 | 1,081 | 1,089 | 1,096 |
| 50 | 0,999 | 1,012 | 1,023 | 1,035 | 1,046 | 1,057 | 1,067 | 1,077 | 1,085 | 1,093 |
| 55 | 0,996 | 1,009 | 1,021 | 1,032 | 1,043 | 1,054 | 1,064 | 1,073 | 1,082 | 1,089 |
| 60 | 0,994 | 1,006 | 1,018 | 1,029 | 1,04 | 1,051 | 1,06 | 1,069 | 1,078 | 1,085 |
| 65 | 0,991 | 1,003 | 1,014 | 1,026 | 1,037 | 1,047 | 1,057 | 1,065 | 1,074 | 1,081 |
| 70 | 0,988 | 1,0 | 1,011 | 1,023 | 1,034 | 1,044 | 1,053 | 1,062 | 1,07 | 1,078 |
| 75 | 0,986 | 0,997 | 1,008 | 1,019 | 1,029 | 1,04 | 1,05 | 1,058 | 1,066 | 1,074 |
| 80 | 0,983 | 0,994 | 1,005 | 1,016 | 1,026 | 1,036 | 1,046 | 1,054 | 1,063 | 1,07 |
| 85 | 0,979 | 0,99 | 1,001 | 1,012 | 1,022 | 1,032 | 1,042 | 1,05 | 1,059 | 1,067 |
| 90 | 0,976 | 0,987 | 0,997 | 1,009 | 1,018 | 1,028 | 1,038 | 1,046 | 1,055 | 1,063 |
| 95 | 0,973 | 0,983 | 0,993 | 1,005 | 1,014 | 1,024 | 1,034 | 1,043 | 1,051 | 1,059 |
| 100 | 0,969 | 0,98 | 0,99 | 1,0 | 1,01 | 1,02 | 1,03 | 1,04 | 1,047 | 1,055 |
Значения плотности растворов этиленгликоля в воде приведены в г/см3.
Формула этиленгликоля: как это вещество изменило нашу жизнь
Утро многих людей начинается похоже: выпиваем бутылку воды, заводим машину, чтобы поехать на работу, сидим в офисе, задумчиво глядя на стену с календарем, где уже отмечены даты отпуска. Но мало кто знает, что ничего этого бы не было, если бы не этиленгликоль (моноэтиленгликоль, или МЭГ), благодаря которому появилась пластиковая тара, антифриз и даже краска для стены. Рассказываем о незаменимых свойствах этиленгликоля и сферах его применения.

Многопрофильное вещество
Этиленгликоль – один из наиболее популярных видов нефтехимического сырья и компонент для многих промышленных продуктов. Это двухатомный спирт, который в очищенном виде выглядит, как бесцветная жидкость без запаха. Вещество достаточно токсично и отнесено к третьему классу опасности по международной классификации.
Но полвека с момента его открытия этиленгликоль фактически «пролежал на полке».
От нефти к «зеленым» технологиям. История создания этиленгликоля
История производства этиленгликоля началась в середине 19 века. Впервые это вещество в 1859 году синтезировал французский химик Шарль Адольф Вюрц. Вначале — из диацетата этиленгликоля, а в год спустя – гидратацией этиленоксида. Но потом еще полвека этиленгликоль не получал широкого распространения.
Наиболее масштабное производство этиленгликоля начала компания Carbide в 1937 году, используя технологию газофазного окисления этилена и этиленоксида. Монополия на такой способ производства сохранялась до 1953 года.
За счет низкой себестоимости и более конкурентного набора свойств к середине 20 века этиленгликоль полностью вытеснил глицерин из промышленного производства динамита, а также из состава охлаждающей жидкости, спрос на которую стремительно рос с развитием машиностроения.
Сейчас этиленгликоль производится в основном путем гидратации (присоединение молекул воды) оксида этилена. В одном из вариантов это происходит при давлении в 10 атмосфер и температуре около 180 градусов в присутствии кислотного катализатора. На выходе получается жидкость, содержащая до 90% чистого этиленгликоля.
Побочные продукты – диэтиленгликоль и триэтиленгликоль – также используются в промышленности, например, в дезинфекторах, системах охлаждения воздуха и при производстве пластификаторов.
Другой вариант синтеза МЭГ – гидратация этилена с участием серной или ортофосфорной кислот при давлении в 1 атмосферу и температуре 50-100 градусов.
На фоне прогнозируемого сокращения добычи углеводородов повышается интерес к экологичным методам выпуска этиленгликоля. Американская компания IPCI нашла новый способ производства многоатомных спиртов из сахаров любого происхождения и уже запустила по этой технологии завод на 10 тыс. тонн продукции в год в Китае.
Запустить заводы по производству этиленгликоля из растительного сырья в середине 2020-ых годов планируется и в Европе.
После отвязки цены на МЭГ от нефтяных котировок, рынок станет прозрачнее, а сферы применения этиленгликоля могут расшириться за счет разработки новых продуктов.
Пластик, антифриз и краски. Где используется этиленгликоль?
Основная часть МЭГ идет на производство полиэтилентерефталата (ПЭТ). Это одна из разновидностей полимеров, продукт поликонденсации этиленгликоля с терефталевой кислотой. ПЭТ применяется для получения синтетических волокон, пленок и пластиковых бутылок.
Именно со сферой ПЭТ связаны позитивные перспективы роста объемов потребления этиленгликоля. Популярность полиэтилентерефталата гарантируют разнообразные потребительские качества: продукция из ПЭТ выдерживает температуры от — 40 градусов до + 70 градусов, ударопрочна и практически не впитывает запахи.
Эксперты уверены, что потребление ПЭТ, а, следовательно, и этиленгликоля будет расти в ближайшие годы, несмотря на запланированное ужесточение в ЕС и некоторых других странах норм использования продукции из полиэтилентерефталата. Тем более что сроки внедрения новых требований существенно сдвинулись вправо из-за ситуации с коронавирусом, которая повысила спрос на одноразовую пластиковую посуду и тару.
Алексей Костин, генеральный директор Центра отраслевых исследований
Хотя ПЭТ незаменим во многих областях, этот продукт из первичного сырья будет замещать его рециркулированная версия из вторсырья. Степень влияния будет зависеть от регулирования в странах потребления ПЭТ, которые могут ввести обязательный норматив на r-PET в волокне или взять на себя какие-либо обязательства в области текстильного бизнеса. Например, установить пошлину на ввоз пряжи, тканей или даже одежды в зависимости от содержания в этих продуктах r-PET.
Еще один крупный сектор применения этиленгликоля в качестве сырья – изготовление охлаждающих жидкостей. Добавленный в воду МЭГ мешает ей замерзнуть в ледяной монолит, что является угрозой для двигателя, и помогает сформировать отдельные ледяные кристаллы, которые не препятствуют запуску мотора.
Благодаря низкой температуре замерзания в смеси с водой, этиленгликоль используются в противообледенительных жидкостях для авиации, которыми самолеты покрывают перед взлетом.
В качестве компонента антифриза МЭГ впервые стали использоваться еще в 1926 году, а более масштабное применение началось незадолго до Второй мировой войны в основном в военной технике.
На тот момент мало кто обращал внимание на главную проблему охлаждающих жидкостей с использованием этиленгликолей – коррозию металла двигателя от соприкосновения с ним.
Во многом это объяснялось тем, что детали были чугунные, а радиаторы – латунные. Но с внедрением автопроизводителями в 1960-ых годах более легких сплавов, в частности, алюминия, пришлось искать ответ на вопрос агрессивного воздействия МЭГ на детали автомобилей. Проблему решили ингибиторы коррозии, которые замедляли окисление этиленгликоля, оберегая двигатель.
Этиленгликоль широко используется при производстве красок как растворитель. В текстильном секторе он применяется для формирования тканей и скручивания нитей, а также как один из главных составляющих красителей для кожи.
Многообещающая динамика
Объемы производства этиленгликоля, которые уже сейчас в мире приближаются к 30 млн. тонн, постоянно увеличиваются.
В Китае к 2020 году их выпуск за последние пять лет вырос на треть, превысив 10 млн. тонн. Еще около 6 млн. тонн производит второй по величине экспортер – Саудовская Аравия.
По прогнозам экспертов, как минимум до 2025 года динамика роста спроса на МЭГ составит 5-6% в год. Россия пока не занимает существенной доли в мировом производстве. В 2020 году внутренние производители (СИБУР, Казаньоргсинтез и Нижнекамскнефтехим) выпустили менее 400 тыс. тонн этиленгликолей, что связано с низкими темпами увеличения спроса внутри страны и высокой конкуренцией на экспорте.
Благодаря возможности разностороннего применения, этиленгликоль стал незаменимым компонентом для многих промышленных отраслей. При этом экономическая эффективность его применения и перспективы дальнейшего развития в качестве экологичного сырья гарантируют МЭГ стабильный спрос еще долгие годы.




