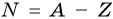Что общего между атомом и молекулой
Атомы и молекулы: что о них известно
Атомы и молекулы: Freepick
С изучения атомов и молекул начинается знакомство с химией. Современной науке известны миллионы молекул. Разобраться с их строением и свойствами помогут особенности мельчайшей частицы — атома.
Что такое атомы
С древних времен люди стремились изучить природу вещей, которые их окружали. Постепенно пришли к мысли о том, что все вокруг состоит из мельчайших частиц.
По мере развития науки появилось понятие об атомах и молекулах. Эти частички чрезвычайно малы, и невооруженным глазом их не разглядеть. Любое крошечное количество вещества, например, пылинка, содержит невероятно большое количество атомов и молекул.
Что же такое атом? Так называют мельчайшую химически неделимую частицу вещества, а также наименьшую часть химического элемента, которая отражает его свойства. Атомы очень маленькие: их размеры находятся в диапазоне от 1 до 5 ангстрем (обозначается — Å.). Один ангстрем — это 10⁻¹⁰ м.
Когда атомы только открыли, их считали самыми маленькими из возможных частиц. Но сегодня нам известна их внутренняя структура:
Например, в атоме гелия есть ядро с двумя протонами и двумя нейтронами, а вокруг него двигаются по своим орбитам два электрона.
Мир атомов: Freepick
Элементарные или субатомные частицы во всех атомах одинаковы, отличается только их количество:
Ядра атомов заряжены положительно, так как в них находятся положительно заряженные протоны и нейтральные нейтроны. По величине заряд соответствует количеству протонов в ядре и равен порядковому номеру элемента в периодической системе.
Заряды протонов и электронов одинаковые по величине, но имеют противоположные знаки. В любом атоме число протонов и электронов равно. Поэтому заряд ядра и суммарный заряд всех электронов также равны, но имеют противоположные знаки. Следовательно, атом — электронейтральная частица.
Каждый известный атом обозначен специальным символом — латинской буквой. Все они представлены в периодической системе Д. И. Менделеева.
На современном этапе развития науки ученые стремятся разрушить атом, чтобы получить еще более мелкие частички. Однако они очень неустойчивы, и добиться их долговременного существования пока не получается.
Что известно о молекулах
Атомы различным образом соединяются друг с другом. Как из букв алфавита составляются тысячи слов, так одни и те же атомы образуют молекулы большого количества разных веществ, которые видим в окружающем мире.
Молекулой называют наименьшую частицу вещества, которая определяет его свойства и способна к самостоятельному существованию. Каждая молекула строится из атомов, которые составляют ее массу:
Таким образом, вещества не вечны, так как их молекулы не могут быть вечными. Однако их атомы практически вечны. В тех веществах и предметах, которые окружают нас сегодня, находятся атомы, которые существовали еще во времена динозавров, походов Александра Македонского и открытия Колумбом Америки.
Что такое молекулы: Freepick
Хоть молекулы и очень малы, их устройство определяют с помощью различных физических и химических методов. Чистые вещества состоят из молекул одного вида.
Если в физическом теле есть молекулы разных видов, то речь идет о смеси веществ. Когда в быту говорим о чистом воздухе, то называем так сложную смесь различных газообразных веществ. Химику придется серьезно поработать, чтобы выделить из нее отдельные чистые вещества.
Все вещества делят на простые и сложные:
Часто физические тела состоят из молекул нескольких веществ. Их называют смесями. Важно не путать сложные вещества и смеси. Если в сложном веществе содержатся молекулы одного вида, то это не смесь.
Благодаря свойству атомов объединяться в разных вариациях количество веществ, как и видов молекул, бесконечно. Никто не сможет точно назвать число веществ, которые сегодня известны людям. Ориентировочно их количество исчисляется миллионами, а химики каждый день создают новые молекулы.
Таким образом все вещества, которые мы видим вокруг нас, состоят из молекул, а те, в свою очередь, построены из атомов. Ученым удалось исследовать мельчайшие частички — атомы — и подробно описать их структуру. Эти знания стали ключом к пониманию природы молекул и даже дали возможность создавать новые молекулы.
Узнавайте обо всем первыми
Подпишитесь и узнавайте о свежих новостях Казахстана, фото, видео и других эксклюзивах.
Есть ли разница между атомом и молекулой?
Атомы и молекулы — это два самых основных термина, которые используются, когда мы говорим о составе элемента или соединения. Существенная разница между атомом и молекулой состоит в том, что атом рассматривается как мельчайшая частица, составляющая материю. Напротив, молекула — это комбинация двух или более мельчайших единиц, то есть атомов, которые химически связаны вместе.
Всякий раз, когда используются названия атомов и молекул, возникает путаница относительно того, чем они отличаются и какие сходства существуют между ними.
По сути, то, что требует определенного пространства и имеет определенную массу, определяется как материя, которая состоит из атомов и молекул. Все в этой вселенной состоит из атомов. От маленького куска мела до большой доски, от единственной стены до целого дома, от маленького муравья до гигантского человека, от гигантского человека до всей Земли — все состоит из атомов. Но атомы настолько малы, что их невозможно визуализировать человеческим зрением или каким-либо микроскопическим устройством.
| Сравниваемые параметры | Атом | Молекула |
| Основные | Наименьшая неделимая единица материи — атом | Комбинация нескольких атомов, которые можно разделить, представляет собой молекулу |
| Существование | Не независимый | Независимый |
| Составные части | Нуклоны (имеющие протоны, нейтроны) и электроны | Два или более атомов, связанных вместе |
| Природа | Неустойчивый | Устойчивый |
| Видимость | Нет | Да, но только через микроскоп |
| Масса | Примерно равно сумме масс протонов, нейтронов и электронов, составляющих этот атом | Сумма масс каждого отдельного атома, образующего молекулу |
| Форма | Не имеет фиксированной формы, но обычно считается сферическим | Существует в линейных, тригональных, пирамидальных формах и других |
| Реактивность | Высокая | Низкая |
| Размер | Небольшой | Сравнительно большой |
| Связь | Кулоновская сила притяжения связывает субатомные частицы | Ковалентная связь существует между двумя или более атомами |
| Образец | Сера, азот, натрий, углерод и другие | Вода, сахар, углекислый газ, перекись водорода и другие |
Определение атома
Самая маленькая неделимая по природе частица, составляющая материю, известна как атом. Каждый атом состоит из трех основных субатомных компонентов, а именно: электрон, протон и нейтрон. И каждый атом отличается друг от друга, потому что у них разное количество протонов.
Атомы считаются основным строительным материалом любой материи и проявляют свое существование повсюду вокруг нас.
По сути, теория, лежащая в основе этого, согласно Махариши Канаду, заключается в том, что при разделении любой материи будут получены более мелкие и мелкие частицы. Но по прошествии определенного времени частицы станут настолько маленькими, что их дальнейшее деление станет невозможным. Эта окончательная неделимая частица называется атомом.
Слово «атом» образовано от комбинации слов «А» и «томас» (tomas), где «А» означает «не», а «томас» соответствует «вырезать».
Каждый атом проявляет свойства химического элемента, в котором он присутствует. Атомный номер — важнейшее свойство атома, которое соответствует количеству положительных зарядов, существующих в ядре.
Определение молекулы
Химическая комбинация нескольких неделимых мельчайших единиц вещества, то есть атомов, порождает молекулу. Когда два или более атома прочно связаны друг с другом некоторой силой притяжения, их индивидуальная комбинация дает молекулу. Молекула — это мельчайший объект материи, который проявляет независимое существование, может делиться дальше и проявляет характеристики материи.
Комбинация атомов, образующих молекулу, может состоять из одинаковых или разных элементов.
В целом молекулы классифицируются как:
Молекулы элементов: это молекулы, образованные комбинацией атомов одного типа. Например, кислород (O2) — это молекула, состоящая из 2 отдельных атомов кислорода, то есть двухатомная молекула.
Молекулы соединений: это молекулы, состоящие из атомов различных типов элементов.
Например, Оксид кальция (CaO) представляет собой молекулу, которая представляет собой комбинацию атома углерода и кислорода.
Различные атомы в молекуле связаны вместе, разделяя электроны, присутствующие в их внешних оболочках, посредством ковалентной связи.
Ключевые различия между атомом и молекулой
Вывод
Итак, из этого обсуждения мы можем сделать вывод, что атомы и молекулы похожи в том, что оба составляют материю. Однако атомы не могут быть далее разделены, примерами атомов являются азот, сера, углерод и другие. А вот молекулы можно дополнительно разделить, деление которых предоставит нам атомы, показывающие характеристики вещества, некоторыми примерами молекул являются вода, диоксид углерода, и другие.
dymontiger
Интересное в сети!
Курьезы, юмор, а иногда и жесть, все это вы найдете здесь;)
Все разнообразие нашего мира построено из атомов и молекул. Удивительно, как проявления форм жизни образовались лишь на основе протонов, нейтронов и электронов. Элементарная основа позволяет каждому веществу и организму выполнять свою функцию. Так из семи нот пишется музыка разных направлений, разных стилей. Мы собрали 10 самых интересных фактов об атомах и молекулах.
Самый легкий из атомов – атом водорода
В периодической таблице химических элементов водород стоит на первом месте. Его ядро состоит лишь из одного протона, вокруг которого вращается единственный электрон. Простейшее строение определяет минимальную массу, которую может иметь атом – 1,008 а.е.м. или 1,7х10-24 г.
На Земле водород существует в виде соединений с другими веществами или образует двухатомную молекулу Н2. Если считать в массовом отношении, на его долю приходится 1% земной коры. Если перевести массу в количество атомов, то содержание водорода окажется более внушительным – 17%. Этот показатель ставит элемент на второе место после кислорода (52%).
Во Вселенной водород составляет 88,6% от общей доли атомов, находящихся в космосе в виде звездного вещества и космической пыли.
Главной молекулой живой природы является молекула ДНК
В молекуле ДНК сосредоточена информация о строении каждой клетки живого организма, словно это проектное бюро города, где собраны подробные планы всех зданий. Внешне она напоминает перевитую веревочную лестницу, состоящую из двух нитей и соединенную водородными связями. ДНК вирусов может представлять одну цепочку.
Информация зашифрована в генах, то есть участках молекулы. Ген представляет собой определенную последовательность нуклеотидов, способных передать код для построения белков и РНК (информационных, транспортных, рибосомных, матричных).
Спираль ДНК человека, если ее вытянуть, протянется почти на 2 м. Это тем более удивительно, что она умещается в ядре размером меньше микрометра. Свернуться в компактную хромосому молекуле помогают нуклеосомы. На них ДНК наматывается, как на катушку.
Пыль – это частица, состоящая из квадриллиона атомов
Пылью называют твердые минеральные или органические частицы размером не более 0,05 мм. Природа образования может быть как естественной, так и связанной с деятельностью человека (антропогенной). В воздух поднимаются вулканический пепел, морская соль, сухая почва, продукты горения после пожаров, пыльца растений. Человек способствует загрязнению воздуха продуктами отопления и горных разработок, выхлопами автотранспорта, удобрениями. Вспашка земли и оголение почвы выкосами травы опасны выветриванием и переносом верхнего слоя грунта ветром.
Если сравнивать твердую взвесь с газообразными загрязнителями воздуха, то последние присутствуют в виде отдельных молекул. Пыль же в каждой частице содержит огромное число молекул и еще большее число атомов.
Атом может иметь электрический заряд
В составе атома электроны несут отрицательный заряд, протоны – положительный. Нейтроны не имеют заряда, то есть нейтральны. Когда количество протонов равно количеству электронов, заряд атома равен нулю. В случае, если электронов больше или меньше, чем протонов, у атома появляется заряд. Он становится ионом.
Ядро, состоящее из нейтронов и протонов, обладает ощутимой массой. Нужно определенное количество энергии, чтобы заставить его терять протоны. Электроны, которые вращаются вокруг него, значительно легче могут перемещаться от одного атома к другому. Добавление электронов приводит к образованию отрицательного заряда, потеря частиц – положительного. Атомы с положительным зарядом называют катионами, атомы с избытком электронов становятся анионами.
Самый тяжелый из атомов – атом урана
Из природных элементов атом урана имеет самую большую массу – 238,0289 а.е.м. В природе находится в основном в виде изотопа U-238. Атом с его 92 протонами чрезвычайно перегружен, при любой возможности выбрасывает протоны и нейтроны с огромной скоростью.
Открыл элемент германский химик Мартин Клапрот в 1789 году при анализе отработанной руды после добычи серебра. «Странное вещество», похожее на металл было диоксидом урана, но выяснилось это только через 50 лет. Клапрот назвал находку в честь далекой планеты, открытой к этому времени Гершелем.
В конце 19 века во Франции Анри Беккерель обнаружил радиоактивность урана, то есть способность терять частицы. Распад может иметь 14 циклов. Уран превращается в радий, радон и другие элементы, образуя на последней стадии свинец.
Слово «атом» происходит из древнегреческого языка и означает «неделимый»
Еще в Древней Греции философ и математик Демокрит предположил, что окружающее состоит из мельчайших частичек. Отсюда произошел термин «атом» или «atomos». Однако подтверждение теория получила только в результате работы ученых в последние 150 лет и с помощью изобретенного микроскопа.
Первое исследование провел англичанин Джон Дальтон на рубеже 18-19 веков. Он установил, что химические элементы вступают в реакции в строго определенном соотношении (закон кратных отношений).
Сейчас мы знаем, что атом представляет собой наименьшую частицу химического элемента и не всегда является неделимым. В состав атома входит ядро с протонами и нейтронами или просто нуклонами от латинского слова «nucleus» – ядро. Снаружи вокруг атома расположено электронное облако.
Стекло не является твердым телом
Твердость вещества – характеристика, основанная на прочности химических связей между атомами и молекулами. В жидкости частицы могут перемещаться относительно друг друга. В твердых телах они лишены такой возможности.
При производстве стекла молекулы кремния, обычно принимающие структуру кристаллической решетки, не успевают занят положенное им место. Стекло быстро остывает и частицы остаются перемешанными хаотично. Такое вещество называют аморфным, однако все же оно твердое.
Вязкость стекла сопоставима с вязкостью свинца, но ведь свинец никто не называет жидкостью. Бытует мнение, что со временем оконные стекла «стекают» вниз. В пример ставят витражи в средневековых храмах. Следует уточнить, что утолщения в их основании появились не с течением времени, а были изначально. Причина кроется в несовершенстве технологии производства.
Молекула меньше яблока во столько же раз, во сколько яблоко меньше Земли
Чтобы представить видимые и невидимые параметры окружающего мира, представим все молекулы одного кубического сантиметра воздуха в виде кирпичей. Их количества хватило бы для покрытия поверхности планеты на высоту 40-этажного дома.
Размеры молекул и атомов настолько малы, что в решении задач молекулярной физики используют относительные величины. Установить их удалось лишь с изобретением электронного микроскопа. Средний диаметр атома и простейшей молекулы составляет порядка 10-10 м. Так, размер молекулы белка – 43х10-10 м. Крупные молекулы достигают 10-7 м.
В ионный микроскоп можно разглядеть строение кристалла и даже определить межатомные расстояния.
Ученые смогли охладить молекулы монофторида стронция практически до абсолютного нуля
Выбор пал на монофторид стронция (SrF) неслучайно. Принцип охлаждения атомов основан на периодическом повторении поглощения и испускания фотонов под воздействием лазера. Таким образом атом теряет кинетическую энергию. Молекулы не настолько чувствительны. Мешает колебательная и вращательная энергия межатомных связей. У фторида стронция эти явления минимальны.
Группа ученых Йельского университета во главе с Д. Демиллем добилась охлаждения молекулы до 300 мкК (0,0003 К). За счет подобранной длины волны лазер погасил вращательные межатомные движения. В дальнейшем молекулы вели себя аналогично атому.
Практически такое достижение в перспективе можно использовать в квантовых компьютерах.
Скорость движения молекул воды может достигать 650 м/с
Молекулы воды находятся в постоянном тепловом движении. Они колеблются с большой частотой (одно колебание за 10-12 … 10-13 с) возле определенного положения, изредка прыгая на освободившееся соседнее место. Скорость движения при этом может приближаться к 600-650 м/с.
И все же молекулы не разлетаются, остаются жидкостью. Происходит это за счет водородных связей. В молекуле H2O пары электронов смещены в сторону кислорода. Водород, оставшийся практически без электрона, представляет собой положительно заряженное ядро. В результате протон водорода притягивает соседние атомы кислорода, образуя прочную межмолекулярную связь.
Благодаря такому сцеплению вода в условиях Земли принимает в основном жидкое состояние, а не кипит как аналогичные гидриды (серы, селена) при –80°С. Водородные связи определяют физические и химические свойства воды, на которых основана жизнь на нашей планете.
©
Атом, молекула, вещество
Атом — электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. Атомное ядро состоит из элементарных частиц протона и нейтрона; вокруг атомного ядра по замкнутым орбиталям двигаются электроны.
Протон (р) — элементарная частица с относительной массой 1,00728 атомной единицы массы (а.е.м.) и зарядом +1 условную единицу.
Нейтрон (n) — элементарная нейтральная частица с относительной массой 1,00866 атомной единицы массы.
Число нейтронов в ядре N определяют по формуле:
где А — массовое число, Z — заряд ядра, равный числу протонов (порядковому номеру).
Электрон (е – ) — элементарная частица с массой 1/1836 а. е. м. и условным зарядом –1. Число электронов в атоме равно заряду ядра атома.
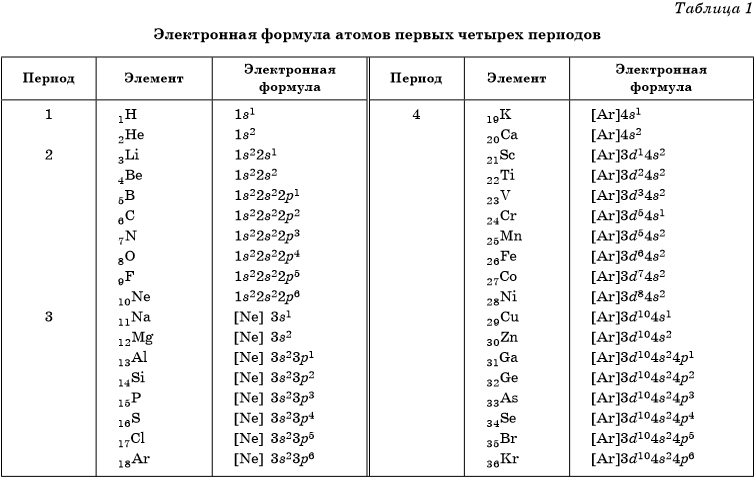
В таблице 1 приведены электронные конфигурации атомов химических элементов первых четырех периодов.
Химический элемент — совокупность атомов с определенным значением (величиной) заряда ядра.
Изотопы — атомы одного и того же элемента, содержащие в своих ядрах одинаковое число протонов, но различное число нейтронов.
Молекула — наименьшая электронейтральная частица вещества, способная к самостоятельному существованию и обладающая его химическими свойствами.
Вещество — любая совокупность атомов и молекул.
Простое вещество образуют одинаковые атомы (например, H2, N2).
Сложное вещество образуют атомы двух и более видов (например, H2SO4, NH3).
Свойства веществ (температуры плавления и кипения, плотность, цвет и т.д.) относятся к совокупности атомов.
Из молекул состоят вещества в газообразном и парообразном состоянии. В твердом состоянии из молекул состоят лишь вещества, кристаллическая решетка которых имеет молекулярную структуру. Это практически все органические вещества, большинство неметаллов, углекислый газ и вода. У них сравнительно низкие температуры плавления и кипения.
В узлах веществ с атомными кристаллическими решетками находятся отдельные атомы, соединенные между собой очень прочными ковалентными связями. Для этих веществ характерны высокая прочность, высокие температуры плавления (например, алмаз, диоксид кремния).
В узлах веществ с металлическими кристаллическими решетками находятся ионы, между которыми двигаются электроны, общие для всего образца. Это обусловливает общие для металлов свойства: высокую электро- и теплопроводность, характерный металлический блеск.
В узлах веществ с ионными кристаллическими решетками находятся ионы. Их образуют вещества с ионной связью. К таким веществам относятся соли, некоторые оксиды и гидроксиды металлов. Вещества с ионной решеткой отличаются сравнительно высокой твердостью и прочностью, они тугоплавки и нелетучи.
Усвоение учебного материала по данной теме на ЕГЭ проводят с помощью заданий базового уровня сложности с кратким ответом.
Атом и молекула – что это и отличия
Мельчайшие частицы – атом и молекула, об этом знают многие люди, но не все могут рассказать подробно, что же это такое. Также сложно, не имея специальных знаний, объяснить, в чем состоят отличия между этими структурами. Из различных исторических источников известно, что про эти структурные единицы знали еще древнегреческие ученые. Так философ Демокрит одним из первых высказал предположение о том, что все известная людям материя состоит из крошечных по своим размерам, неделимых человеческому глазу частиц. Их он назвал атомами. Современные ученые подтвердили эту теорию и установили опытным путем, что вещества состоят из атомов и молекул. Для того чтобы установить разницу межу этими структурными единицами, необходимо сначала дать им определение, а затем сравнить, чтобы определить, в чем состоят различия.
Определение понятий
На первых этапах изучения считалось, что атом и молекула – элементы неделимые. Более глубокие исследования и всесторонние изучения позволили опровергнуть это мнение. Сегодня этими терминами обозначают самостоятельные элементы, которые образуют все, что окружает человека.
Атомом называют мельчайшую структурную единицу, составляющую любое вещество.
Молекулой принято считать элементарную частицу, из которых состоят все окружающие людей вещества, материи и компоненты.
Сравнение
После приведенных определений можно приступить к сравнению элементарных структурных единиц вещества. Атом является наименьшей ее составляющей. Он имеет собственную массу и размер. Основная задача – определение, какими свойствами будет обладать то или иное химическое вещество.
Нужно учитывать, что атом не является конечным элементом. Он в свою очередь делится на ядро и электроны, которые совершают движение по орбите, расположенной вокруг ядра. Подобное строение и определяет, какими свойствами будет обладать то или иное вещество. Особенностью атома является то, что его невозможно увидеть вне компонента, в свободном состоянии. Все атомы имеют тесные связи между собой, которые и образуют молекулу. Происходит это благодаря электрическим зарядам частиц, из которых состоят атомы.
Молекула — это единица, составляющая вещество. В состав молекул входят атомы. Разное их количество определяет свойства. Атомы внутри молекулы имеют межатомные связи. Каждая молекула состоит из атомных ядер и внутренних электронов. Они совершают движение по своим орбитам. В состав входят также внешние валентные электроны. В разных молекулах находится разное количество атомов. Это свойство и определяет разнообразие химических веществ и компонентов. Молекула имеет сложную архитектурную постройку. Так у каждого атома свое место внутри молекулы. Количеством атомов в ней определяются свойства – химические реакции и превращения. Имеющиеся свойства влияет порядок и конфигурация соединения всех атомов. Атомная постройка, которая образует молекулу, может быть жесткой. Также бывают и исключения. Особенность мельчайшей единицы – постоянное движение. Атомы никогда не останавливаются, они продолжают колебание на положенном ему месте в молекуле, чтобы удержать равновесие.
Выводы
Атомы и молекулы – структурные единицы, образующие любое вещество. Атомы образуют молекулу. В составе атома присутствуют еще более мелкие элементы — ядро и электроны, которые движутся по своим орбитам вокруг ядра. Молекулы состоят из атомов (одного или нескольких).
Атом имеет электрический заряд (положительный или отрицательный) а молекула по этому показателю полностью нейтральная. Только молекула в веществе обладает способностью к самостоятельному существованию.